Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Морфогенез ткани тимуса у экспериментальных животных с моделированным адъювантным артритом
Авторы: Каладзе Н.Н., Загорулько А.К., Меметова Э.Я. Крымский государственный медицинский университет им. С.И. Георгиевского, г. Симферополь
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены морфологические изменения ткани тимуса при моделировании адъювантного артрита на 12 белых лабораторных чистопородных крысах линии Wistar. В условиях данного эксперимента выявлены дистрофические изменения клеточных элементов тимуса.
Адъювантный артрит, эксперимент, тимус, крысы.
Ювенильный ревматоидный артрит (ЮРА) — хроническое аутоиммунное системное заболевание соединительной ткани, развивающееся в возрасте до 16 лет, с поражением суставов и внутренних органов. В патогенезе данного заболевания лежит активация клеточного и гуморального звеньев иммунитета [1]. Уникальным комплексным органом нейроэндокринной и иммунной системы, способным продуцировать различные биологически активные вещества, играющие главную роль в иммунологических и многих других физиологических процессах, является тимус (вилочковая железа) [2].
В связи с этим в разрешении проблемы патогенеза, лечения и профилактики ЮРА, а также при поиске и разработке новых лекарственных средств (способов коррекции) большую роль должно сыграть создание адекватной модели на животных [3]. Широкое распространение в настоящее время получила экспериментальная модель артрита у крыс при внутрикожном или подкожном введении полного адъюванта Фрейнда [4]. Масляную эмульсию адъюванта иногда называют неполным адъювантом Фрейнда в отличие от полного адъюванта, который содержит убитые микобактерии, суспензированные в масле [5, 6]. Адъювантный артрит сопровождается типичной аутоиммунной реакцией, основным звеном которой является Т-клеточный иммунитет (О.В. Синяченко и др., 1991; L. Klareskog et al., 1995; S.J. Oliver, E. Brahn, 1996).
Наиболее распространенная разработанная модель ревматоидного полиартрита у крыс по клиническому течению, патологическим и гистологическим данным близка к ревматоидному артриту человека. Она надежна в отношении воспроизведения и позволяет изучать звенья патогенеза ревматоидного артрита, а также выявлять профилактическое и терапевтическое действие лекарственных средств.
Целью нашей работы явилось выявление и изучение изменений в ткани тимуса у экспериментальных животных с моделированным адъювантным артритом.
Материалы и методы
Исследование проведено на 12 белых лабораторных чистопородных крысах (самцы и самки) линии Wistar, 3-месячного возраста, со средней массой 80–120 г. Крысы содержались в одинаковых условиях вивария при 12-часовом дневном и 12-часовом ночном цикле в течение проведения всей экспериментальной части работы. Все эксперименты на животных проводились с соблюдением международных принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1985), а также в соответствии с «Правилами проведения работ с использованием экспериментальных животных» [7, 8]. Так как наша экспериментальная модель сопоставима с детским возрастом человека, то нами были взяты белые крысы породы Wistar в возрасте 14–18 дней (8–10 месяцев жизни человека), массой 16–20 г.
Способ моделирования выполняли следующим образом: под кожу задней лапки крыс (субплантарно) вводили полный адъювант Фрейнда в количестве 0,01 мл, который содержал 0,01 мг БЦЖ, 1–2 р/нед, после 2–3 нед. жизни. Моделировался аутоиммунный процесс путем сенсибилизации организма животного в течение 25 дней.
Животные, у которых предполагалось исследовать ткань вилочковой железы, были разделены на 2 группы, в каждой группе по 6 крыс (n = 6): 1-я группа — здоровые животные породы Wistar (КГ — контрольная группа); 2-ю группу составили животные этой же породы с моделью адъювантного артрита, не получавшие лечения.
У всех экспериментальных животных к 6–7-й неделе развивался полиартрит с преимущественной локализацией в коленных, тазобедренных и плечевых суставах, с менее выраженным поражением мелких сочленений. Клинически отмечалась болезненность суставов при пальпации, ограничение движения в них, особенно в задних конечностях; снижение мышечного тонуса и дряблость мышц; снижение аппетита и потеря массы.
Через 10 дней после окончания эксперимента животных забивали под эфирным наркозом. Забор материала проводился во всех группах, в течение 15 минут отпрепарированную вилочковую железу фиксировали в растворе 2,5% буферного глютаральдегида, для электронной микроскопии. Полутонкие срезы органов (1 мкм) изготавливались на ультратоме УМПТ-7 (Украина). Ультратонкие срезы просматривали и фотографировали на электронных микроскопах ПЭМ-100 (Украина). Увеличение подбиралось адекватно целям исследования и колебалось в пределах 2000–10 000 крат.
Результаты и их обсуждение
Полученные при электронной микроскопии морфологические результаты свидетельствовали о том, что в ходе эксперимента удалось смоделировать хроническое системное воспаление, характерное для ревматоидного артрита, а также выявить изменения в ткани тимуса у экспериментальных животных.
В исследуемой контрольной группе здоровых экспериментальных животных ткань тимуса неизмененная, имеет физиологическое строение. Дольки тимуса состоят из коркового и мозгового вещества. В строении этих компонентов существуют весьма тонкие морфологические различия, не относящиеся к принципиальным. Поэтому при описании ультраструктуры клеток исследуемого органа мы сочли возможным не выделять отдельно клетки мозгового и коркового вещества, тем более что обнаруженные нами изменения в ходе эксперимента имели сходный, однонаправленный характер.
Основу дольки тимуса составила рыхлая, губкоподобная сеть из звездчатых эпителиоцитов (тимоцитов), петли которой инфильтрированы лимфоцитами (рис. 1).
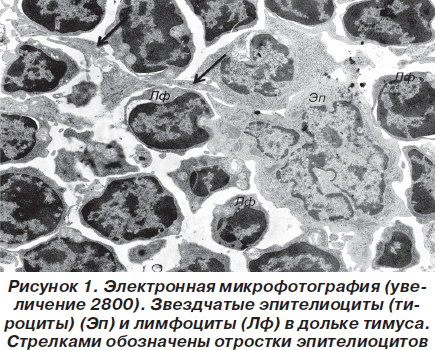
При этом эпителиоциты имели звездчатую форму и контактировали между собой десмосомальным путем за счет длинных цитоплазматических отростков. Ядра звездчатых клеток имели округлую или фестончатую форму, содержали умеренное количество хроматина, преимущественно представленного эуформой с частичной конденсацией вблизи ядерной мембраны в виде глыбок гетерохроматина. В цитоплазме содержится комплекс хорошо развитых органелл, среди которых выделялись митохондрии с параллельными плотно упакованными кристами и матриксом средней электронной плотности, а также канальцы гранулярной и агранулярной цитоплазматической сети, комплекс Гольджи и т.д. Лимфоциты по своей ультраструктурной организации более всего напоминали малые лимфоциты и содержали округлой формы ядро с большим количеством электронно-оптически плотных скоплений хроматина и узкий ободок цитоплазмы (рис. 2).
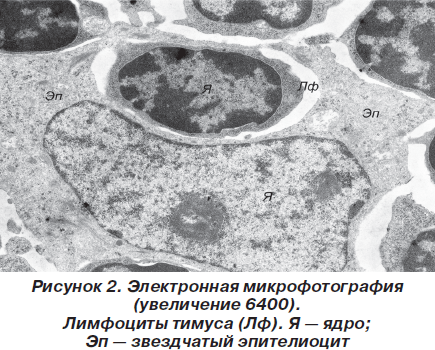
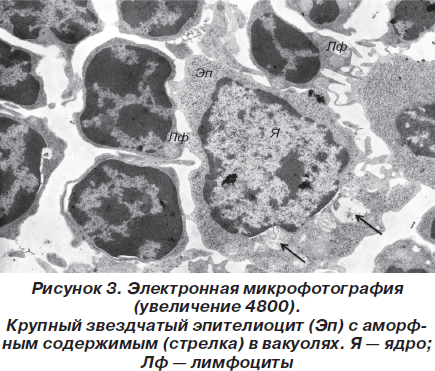
В цитоплазме содержался обычный набор внутриклеточных органелл. Местами, преимущественно в подкапсулярной зоне коркового вещества, встречались немногочисленные лимфобласты с явлениями высокой митотической активности. Характерной особенностью мозгового вещества является наличие телец Гассаля, которые представляют собой концентрические скопления перерождающихся звездчатых эпителиоцитов. Кроме того, в мозговом слое присутствовали крупные эпителиальные клетки с округлым слабой или средней электронной плотности ядром и присутствием в цитоплазме гранул или вакуолей, заполненных аморфным веществом (рис. 3), по-видимому представляющим собой скопления кислых и нейтральных мукополисахаридов.
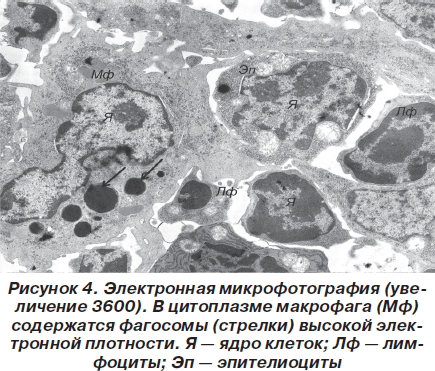
Помимо этих клеток в корковом и мозговом веществе встречались в небольшом количестве лейкоциты, тучные клетки, а также то или иное количество макрофагов, в цитоплазме которых обнаруживаются фагосомы с материалом различной электронно-оптической плотности (рис. 4).
Наконец, обязательным компонентом дольки вилочковой железы являются сосуды, построенные по общему плану, то есть имеющие эндотелиальную выстилку, базальную мембрану и внешнюю соединительнотканную оболочку (рис. 5).
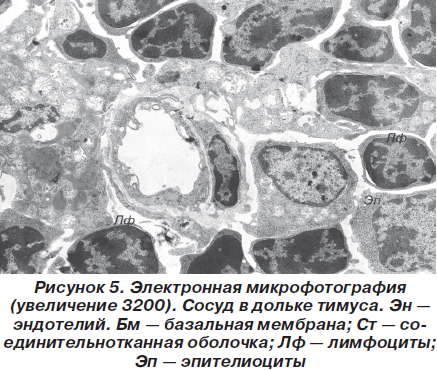
В нормальном состоянии зародышевые центры, характерные для лимфатических узлов и селезенки как сходных лимфоидных органов, в вилочковой железе отсутствуют. Пролиферация лимфоцитов тимуса происходит вне связи с определенными реактивными центрами, что обусловливает достаточно частое присутствие митозов.
Изменения в клетках тимуса животных второй группы при моделированном адъювантном артрите не имеют характерной локализации и стереотипны как в корковом, так и в мозговом веществе.
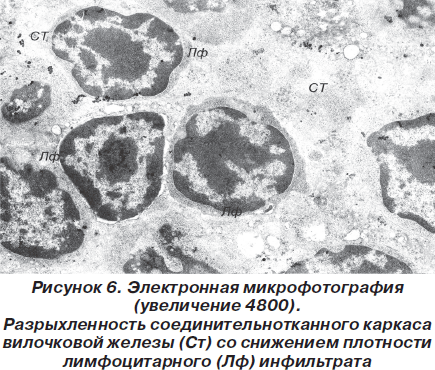
Прежде всего обращает на себя внимание разрыхленность соединительнотканного каркаса вилочковой железы, что может быть расценено как проявления экстрацеллюлярного отека и сопровождается снижением плотности лимфоцитарного инфильтрата в петлях звездчатых эпителиоцитов (рис. 6).
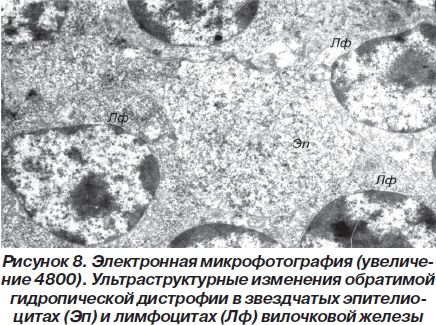
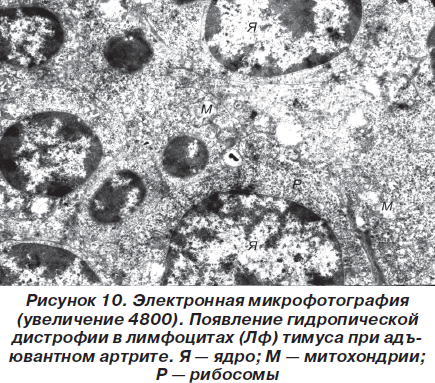
В самих эпителиоцитах имеют место явления, свидетельствующие о гидропической дистрофии. Причем число клеток с такими изменениями по сравнению со здоровыми животными значительно возрастает (рис. 7).

Вместе с тем во многих эпителиоцитах отмечается разрыхление цитозоля с уменьшением оптической плотности цитоплазмы, снижение плотности матрикса митохондрий с просветлением органелл и нарушением упорядоченного расположения в них крист, расширение профилей канальцев цитоплазматической сети, а также снижение уровня содержания хроматина в ядрах.
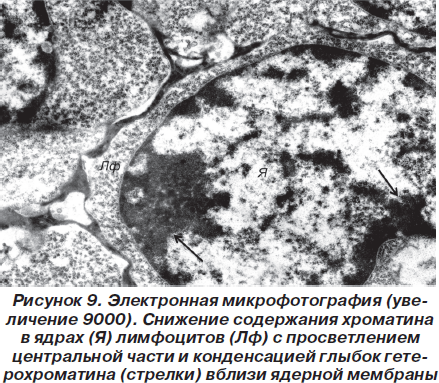
Описанные ультраструктурные изменения расценивались нами как проявления гидропической дистрофии, имеющей, однако, обратимый характер. Аналогичные изменения наблюдались и в лимфоцитах вилочковой железы (рис. 8).
Так, в частности, в ядрах клеток отмечалось резкое снижение содержания хроматина, что приводило к просветлению центральной части ядер и конденсации небольших количеств гетерохроматина вблизи ядерной мембраны (рис. 9).
Изменения отечного характера, описанные в отношении внутриклеточных органелл звездчатых эпителиоцитов, имели место и в лимфоцитах (рис. 10).
Выводы
1. Для воспроизведения ревматоидного артрита в эксперименте оптимальной моделью являются лабораторные чистопородные крысы линии Wistar.
2. Полученные при электронно-микроскопическом исследовании результаты свидетельствуют о развитии в клеточных элементах вилочковой железы при воспроизведенном адъювантном артрите обратимых изменений по типу гидропической дистрофии.
3 На основании полученных результатов можно полагать, что данные изменения при указанной патологии оказывают негативное влияние на иммунный статус организма, что требует соответствующей медикаментозной коррекции.
1. Детская кардиоревматология / Приходько В.С., Гончарь М.А., Лысиков Я.Е., Рига Е.А., Хаин М.А. — К.: Здоров’я, 2005. — С. 390-409.
2. Анисимова В.П. Роль морфофункциональных перестроек тимуса в обменно-эндокринных нарушениях организма // Рос. вестник перинатологии и педиатрии. — 1994. — Т. 39, № 1. — С. 35.
3. Ундрицов М.Н., Розен В.Б., Чернин Л.С. // Вопросы ревматологии. — 1964. — № 1. — С. 7.
4. Кейтель В., Лопатенок А. Вопросы ревматологии. — 1970. — № 3. — С. 24.
5. Руководство по иммунофармакологии: Пер. с англ. / Под ред. М.М. Дейла, Дж.К. Формена. — М.: Медицина,1998. — С. 83-86, 233, 288.
6. Allison A.S., Byars N.E. An adjuvant formulation that selectively elicits the formation of antibodies of protective isotypes and of cell-mediated immunity // J. Immunol. Methods. — 1986. — 95. — 157-168.
7. Науково-практичні рекомендації з утримання лабораторних тварин та роботи з ними / Ю.М. Кожемякін, О.С. Хромов, М.А. Филоненко, Г.А. Сайфетдінова. — Київ: Авіценна, 2002. — 156 с.
8. Западнюк В.И., Западнюк И.П., Захария Е.А. Лабораторные животные. — К.: Высшая школа,1985. — 385 с.
