Журнал «Здоровье ребенка» 1 (28) 2011
Вернуться к номеру
Рівень ендотоксину кишкового походження в сироватці крові при бактеріальних ангінах, скарлатині і гнійних менінгітах у дітей
Авторы: Римаренко Н.В. Кримський державний медичний університет ім. С.І. Георгієвського
Рубрики: Педиатрия/Неонатология
Версия для печати
У роботі подані результати дослідження рівня ендотоксину грамнегативної флори кишечника в сироватці крові 112 дітей, хворих на бактеріальні ангіни, скарлатину і гнійні менінгіти. Виявлено розвиток ендотоксинемії кишкового походження, що залежить від тяжкості інфекційного процесу і періоду хвороби.
Ендотоксин грамнегативної мікрофлори, бактеріальна ангіна, скарлатина, гнійний менінгіт, інфекційний токсикоз, діти.
Традиційно провідним фактором інфекційного токсикозу при бактеріальних ангінах, скарлатині і частині гнійних менінгітів уважаються грампозитивні мікроорганізми та їхні токсини. Тейхоєві й ліпотейхоєві кислоти — основні компоненти клітинної стінки грампозитивних бактерій разом із пептидогліканами мають потужну цитокініндукуючу активність [1]. Однак при цьому залишається поза увагою, що в порожнині кишечника в нормі перебуває велика кількість грамнегативних мікроорганізмів, зовнішня мембрана яких містить ендотоксин (ЕТ). Доведено, що цей ендотоксин здатний проникати з кишечника в системний кровотік, при цьому характер його впливу на організм чітко залежить від дози [2]. Присутність у крові малих доз ЕТ (0–1 МЕО/мл) вважається фізіологічною, необхідною для підтримки імунної системи в тонусі, тоді як підвищене проникнення кишкового ЕТ у системний кровотік призводить до розвитку ряду патофізіологічних реакцій, аж до розвитку ДВС-синдрому і септичного шоку [2–4]. Дослідженнями М.В. Мєшкова та співавт. доведено, що ЕТ грамнегативної мікрофлори кишечника є не тільки облігатним чинником патогенезу ДВС-синдрому в дітей з інфекційною (ургентною абдомінальною) хірургічною патологією, а й причиною розвитку післяопераційних ускладнень [7, 8]. Були обстежені 62 дитини віком від 3 місяців до 14 років, із них в одної третини хворих (19) діагностовані ургентні запальні захворювання органів черевної порожнини (гангренозний апендицит, перфоративний дивертикул Меккеля, непрохідність шлунково-кишкового тракту) з наступним розвитком у 10 пацієнтів ускладнення у вигляді обмеженого або поширеного перитоніту. Більшу частину обстежених (43) склали хворі, які надійшли для планового хірургічного лікування (пахової або пупкової грижі, водянки оболонок яєчка і сім’яного канатика, крипторхізму, варикоцеле), і у 13 із них розвинулися післяопераційні ускладнення у вигляді макрогематурії, підвищеної кровоточивості м’яких тканин, тривалого виходу із постнаркозної депресії, яка супроводжувалась гіпертермією і блювотою.
Установлено, що при надходженні в стаціонар рівень ЕТ в сироватці крові у хворих з екстреною патологією перевищував його вміст у здорових дітей у 20 разів, складаючи 3,8 ± 1,0 МEО/мл (р < 0,001), підвищувався одразу ж після операції до 4,4 ± 0,9 МEО/мл (р < 0,001) і знижувався в період з 3-ї до 5-ї доби після операції до 2,3 ± 0,3 МEО/мл (р < 0,001). Однак у групі хворих із ускладненнями, що розвинулися на 3-тю — 5-ту добу після операції, визначався максимально високий рівень ендотоксину (12,7 ± 4,2 МЕО/мл) у цей період. Високий рівень ендотоксинемії супроводжувався як лабораторними (прогресуюча гіпокоагуляція), так і клінічними ознаками ДВС-синдрому, а саме: підвищеною кровоточивістю тканин, кровотечами із місць ін’єкцій, геморагічним характером виділення по дренажах, утворенням ерозій і/або виразок на слизових шлунково-кишкового тракту і кровотечею із них, а також симптомами розвитку поліорганної недостатності.
При дослідженні ексудату, отриманого після дренування вогнища запалення, у 83 % випадків висіювались грамнегативні мікроорганізми, але у 17 % хворих збудником був золотавий стафілокок. На думку авторів, на виникнення ендотоксинемії у хворих цієї групи впливала не тільки присутність у крові ЕТ інфекційного агента, відповідального за розвиток ускладнення, а й порушення кишкового бар’єра в результаті абдомінального запального процесу, що створювало умови для підвищеного проникнення ЕТ із кишечника.
У хворих, які надійшли для планового лікування, рівень ЕТ, визначений за 30 хвилин до початку операції, був збільшений в 7 разів і досягав у середньому 1,4 ± ± 0,2 МEО/мл (р < 0,001) проти 0,19 ± 0,03 МEО/мл у здорових дітей. Разом із тим у хворих, у яких в майбутньому розвинулись ускладнення, концентрація ЕТ збільшувалась у 12 разів і становила 2,4 ± 0,03 МEО/мл (р < 0,001). Підвищення концентрації ЕТ у сироватці крові в цих хворих у передопераційному періоді автори пов’язують із підвищеним проникненням ЕТ із кишечника, зумовленим розвитком передопераційного стресу.
Результати досліджень Laurance L. Lequier свідчать про участь ЕТ у розвитку гемодинамічних розладів у дітей, прооперованих із приводу вроджених вад серця [7]. Установлено, що у 12 із 29 дітей (середній вік яких становив 59 днів, а вага — 4 кг) рівень ЕТ у сироватці крові підвищувався вже у передопераційному періоді і наростав після операції. Високий рівень ендотоксинемії у всіх цих хворих супроводжувався розвитком тяжких гемодинамічних розладів у післяопераційному періоді, а летальність становила 25 %. У той же час у інших 17 пацієнтів, у яких у передопераційному періоді ЕТ в сироватці крові не визначався, а підвищувався тільки після операції, вираженість гемодинамічних розладів була меншою, а летальних наслідків не було взагалі. Проведені при цьому бактеріологічні дослідження повністю виключили розвиток інфекції у всіх обстежених хворих, тому присутність ЕТ у сироватці крові була пов’язана тільки з підвищеним його проникненням із кишечника.
Очевидно, що при розвитку інфекційного захворювання будь-якої етіології, особливо у тяжкій формі, створюються умови для підвищеного проникнення ЕТ з кишечника в системний кровотік за рахунок порушення функції захисних протиінфекційних бар’єрів. Неспроможність захисних бар’єрів виражається в порушенні колонізаційної резистентності нормальної мікрофлори людини за рахунок антибіотикотерапії, а також порушення кишкового пасажу, мікроциркуляторних порушень у брижових судинах і підвищенні проникності слизової кишечника, порушенні дезінтоксикаційної функції печінки в умовах перебігу основного інфекційного захворювання [1, 8]. Результатом підвищеного проникнення ЕТ з кишечника в системний кровотік у гострому періоді поточного інфекційного захворювання може бути збільшення тяжкості й тривалості хвороби.
Таким чином, метою нашого дослідження стало визначення рівня ЕТ кишкового походження в сироватці крові дітей з бактеріальними ангінами, скарлатиною і гнійними менінгітами залежно від періоду та тяжкості захворювання.
Матеріали і методи
Під спостереженням знахлдилися 112 хворих віком від 2 до 6 років, які перебували на лікуванні в КРУ «Дитяча інфекційна клінічна лікарня» м. Сімферополя за період з 2005 по 2008 р.
Усі обстежені діти були розподілені на 5 груп. У 1-шу групу ввійшли 34 хворих з бактеріальною ангіною середнього ступеня тяжкості, у 2-гу групу — 29 дітей з ангіною у тяжкій формі, 3-ю групу склали 15 хворих із середньотяжкою формою скарлатини, в 4-ту групу ввійшли 12 хворих з тяжкою формою скарлатини, причому тяжкість була обумовлена розвитком бактеріальних ускладнень (синуситу, лімфаденіту, отиту, паратонзиліту) і метаболічних розладів, і 22 хворих із гнійним менінгітом (стафілококової або стрептококової етіології) склали 5-ту групу. Матеріалом дослідження служила периферична кров, яка забиралася у гострому періоді (при надходженні в стаціонар і на 3-тю добу перебування) та перед випискою зі стаціонару.
Групу порівняння склали 25 здорових дітей віком від 2 до 6 років.
Визначення кількісного вмісту ендотоксину в сироватці крові хворих проводилось за допомогою ЛАЛ-тесту.
Первісно ЛАЛ-тест був розроблений для контролю готових лікарських засобів і виробів медичного призначення на присутність у них бактеріальних ендотоксинів. Однак після проведених наукових досліджень з використання ЛАЛ-реактиву для визначення ЕТ у плазмі і сироватці крові людини фірма-виробник опублікувала процедуру хромогенного методу для кількісного визначення вмісту ЕТ у сироватці крові [9], який широко використовується аж до сьогодні [10–14]. Оскільки виявлення ЕТ у сироватці або плазмі крові з використанням ЛАЛ-тесту ускладнено інгібуванням або підсиленням результату, зумовленими впливом компонентів крові і рН середовища, було запропоновано попереднє розведення сироватки (1 : 10) з наступним нагріванням до 75 °С упродовж 10 хвилин, що запобігало негативним ефектам [9]. На результати дослідження також може вплинути контамінація лабораторного посуду і реактивів мікроорганізмами. Тому дослідження проводиться в строго асептичних умовах, з використанням посуду й реактивів, вільних від ЕТ. Хромогенна модифікація LAL-тесту характеризується високою чутливістю (0,015–0,012 EU/мл).
Дослідження грунтується на хромогенному аналізі по кінцевій точці, у якому після змішування ЛАЛ-реактиву Endosafe Endochrome з випробуваним зразком проводився вимір жовтого забарвлення, що розвивається в реакційній суміші. Біологічний принцип методу полягає в тому, що ендотоксини грамнегативних бактерій призводять до активації проферменту (каскаду ферментів, які є сериновими протеазами), який міститься в лізаті амебоцитів limulus (ЛАЛ-реактив Endosafe Endochrome). Активний згортаючий фермент розрізає коагулоген, що призводить до помутніння реакційної суміші. У присутності хромогенного субстрату (S-2423) згортальний фермент відрізає від субстрату хромофор, р-нітроанілін. Вивільнений р-нітроанілін надає розчину жовтого забарвлення. За допомогою спектрофотометра при довжині хвилі 405–410 нм нами вимірювалася інтенсивність забарвлення, що була прямо пропорційна вмісту ендотоксину в зразку. Концентрацію ендотоксину в зразку визначали за каліброваною кривою.
Для здійснення дослідження нами використовувався ЛАЛ-реактив Endosafe Endochrome (виробник Charles River Endosafe, a Division of Charles River Laboratories, Inc., США). Контрольний стандарт ендотоксину Endosafe, виготовлений з Е.coli, штам О55:В5. Результат виражався в міжнародних ендотоксинових одиницях (МЕО/мл). Згідно з отриманими нами даними, у 25 здорових дітей із групи порівняння вільний ендотоксин у сироватці крові не визначався.
Результати досліджень та їх обговорення
Як видно з табл. 1, у хворих усіх груп у гострому періоді захворювання (при надходженні до стаціонару) визначався рівень ЕТ у сироватці крові, який перевищував фізіологічний. При цьому у хворих із середньою тяжкістю хвороби (1-ша і 3-тя групи) рівень ендотоксину становив 2,59 ± 0,21 МЕО/мл і 2,32 ± 0,31 МЕО/мл, а у хворих із тяжкою формою (2-га і 4-та групи) — 6,23 ± ± 0,79 МЕО/мл і 6,02 ± 0,50 МЕО/мл, тобто був збільшений у хворих із тяжкою формою в 2,0 і 2,5 раза відповідно (р2 < 0,001). Найвищий рівень ендотоксину при надходженні був зафіксований у хворих із гнійним менінгітом — 12,94 ± 0,58 МЕО/мл.
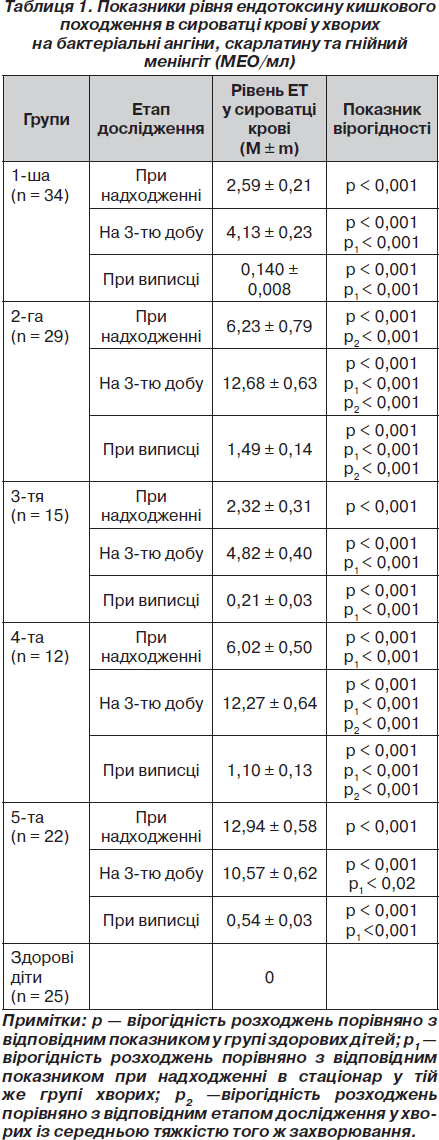
Оскільки у всіх хворих захворювання були викликані грампозитивною флорою, що підтверджено бактеріологічно (Str.pyogenes, Str.pneumoniae, Str.viridans, S.aureus), виявлений у системному кровотоку ЕТ міг бути тільки кишкового (ендогенного) походження.
При дослідженні крові на 3-й день від моменту надходження рівень ендотоксину в крові зростав у більшості хворих (61 %) і був найбільшим у хворих із тяжкими бактеріальними ангінами (12,68 ± 0,63 МЕО/мл). Так, рівень ЕТ зростав у 1-й групі в 1,6 раза, в 2, 3 і 4-й групах — у 2 рази порівняно з показниками при надходженні (р1 < 0,05). При цьому зберігалася пряма залежність від тяжкості захворювання. Так, рівень ЕТ у хворих із тяжкими формами (2-га і 4-та гр.) був відповідно в 3,0 і в 2,5 раза вищим, ніж у хворих із середньою тяжкістю (1-ша і 2-га гр.) цих захворювань (р2 < 0,001). Наростання рівня ЕТ у сироватці крові в гострому періоді на тлі лікування основного захворювання, очевидно, пов’язане з тим, що комплекс стандартної терапії бактеріальних ангін і скарлатини не передбачає впливу на ЕТ кишкового походження і не впливає на попередження розвитку ендотоксинемії.
У групі хворих із гнійним менінгітом на 3-тю добу від моменту надходження рівень ендотоксину був вірогідно меншим, ніж при надходженні, залишаючись, однак, на стабільно високому рівні (10,57 ± 0,62 МЕО/мл, р1 < 0,02). Можливо, це було пов’язане із застосуванням хворим цієї групи внутрішньовенного імуноглобуліну (що містить антитіла до грамнегативних мікроорганізмів) у перші 1–3 дні перебування в стаціонарі.
Рівень ендотоксину при виписці у всіх випадках був вірогідно нижчим, ніж при надходженні (р1 < 0,001), однак у хворих із тяжкою формою ангін і скарлатини він вірогідно перевищував показник у хворих із середньою тяжкістю (р2 < 0,001) і був вищим за фізіологічний рівень, який становить 0–1 МЕО/мл.
Дані, отримані в наших дослідженнях, узгоджуються з результатами досліджень зарубіжних учених. Так, John C. Marshall і співавтори обстежили 74 хворих, що надійшли до відділення інтенсивної терапії з пневмонією, бактеріємією, інтраабдомінальним абсцесом і сепсисом, яких розподілили на 2 групи залежно від належності збудника до грамнегативної або грампозитивної флори [4]. Підвищений рівень ЕТ у сироватці крові визначався у хворих обох груп, однак у пацієнтів із грамнегативною інфекцією він був вірогідно вищим (р < 0,05). Системна ендотоксинемія, виявлена у хворих із грампозитивною інфекцією (основним збудником був S.aureus), на думку авторів, була пов’язана з підвищеним проникненням ендотоксину із кишечника. Крім того, ті хворі, рівень ЕТ у яких був менше 50 пг/мл, швидше виходили із критичного стану порівняно з пацієнтами, у яких рівень ендотоксину на момент надходження до стаціонару був понад 50 пг/мл, тобто концентрація ЕТ впливала на тривалість токсикозу у хворих.
Таким чином, одержані нами дані свідчать про розвиток ендотоксинемії, пов’язаної з підвищеним проникненням ЕТ з кишечника в системний кровотік у хворих з ангінами, скарлатиною і гнійними менінгітами. Рівень ЕТ у сироватці крові був вірогідно вищимв гострому періоді хвороби у хворих із тяжкими формами. Отже, розвиток ендотоксинемії кишкового походження, будучи додатковим токсичним чинником в умовах перебігу основного захворювання, може впливати як на ступінь тяжкості основного захворювання, так і на тривалість токсикозу.
Однак, як відмічають багато авторів, не зовсім коректно розглядати та оцінювати рівень ендотоксинемії при різних захворюваннях у відриві від стану антиендотоксинового імунітету [7, 8, 10, 15]. Оскільки саме динамічна рівновага або дисонанс цих двох систем зумовлює розвиток патологічних реакцій, характерних для ЕТ. Вивченню стану антиендотоксинового імунітету при бактеріальних ангінах, скарлатині і гнійних менінгітах у дітей будуть присвячені наші подальші дослідження.
Висновки
1. Установлено, що на тлі перебігу бактеріальних ангін, скарлатини та гнійних менінгітів, викликаних грампозитивними мікроорганізмами, розвивається ендотоксинемія кишкового походження з підвищенням рівня ЕТ у сироватці крові в 2–12 разів залежно від тяжкості захворювання й періоду хвороби.
2. Розвиток ендотоксинемії кишкового походження у хворих з інфекційними захворюваннями із позакишковою локалізацією запального процесу може поглиблювати ступінь тяжкості основного захворювання і тривалість токсикозу.
3. Різні строки максимального наростання рівня ЕТ у сироватці крові у хворих на бактеріальні ангіни, скарлатину і гнійні менінгіти свідчать про те, що комплекс стандартної терапії ангін і скарлатини ніяк не впливав на рівень ендотоксинемії кишкового походження, на відміну від хворих на гнійні менінгіти, у лікуванні яких використовувався імуноглобулін для внутрішньовенного введення, який містив антитіла до грамнегативної флори, що сприяло більш швидкому зв’язуванню ЕТ.
1. Исаков Ю.Ф., Белобородова Н.В. Cепсис у детей. — М., 2001. — 369 с.
2. Яковлев М.Ю. Элементы эндотоксиновой теории физиологии и патологии человека // Физиология человека. — 2003. — Т. 29, № 4. — С. 154-165.
3. Sauer M., Tiede K., Fuchs D. et al. Procalcitonin, C-reactive protein, and endotoxin after bone marrow transplantation: identification of children at high risk of morbidity and mortality from sepsis //Bone Marrow Transplantation. — 2003. — Vol. 31. — P. 1137-1142.
4. Marshall J.C., Walker P.M., Foster D.M. et al. Measurement of endotoxin activity in critically ill patients using whole blood neutrophil dependent chemiluminescence // Crit. Care. — 2002. — Vol. 6, № 4. — P. 342-348.
5. Эндотоксиновая агрессия в развитии нарушений гемостаза у детей с хирургической патологией инфекционного и неинфекционного генеза / М.В. Мешков, И.А. Аниховская, Р.А. Уразаев, М.Ю. Яковлев // Хирургия. — 2006. — № 3. — С. 32-37.
6. Эндотоксиновая агрессия как причина послеоперационных осложнений в детской хирургии (новые перспективы профилактики) / М.В. Мешков, Ю.К. Гатауллин, В.Б. Иванов, М.Ю. Яковлев. — М.: ЗАО «Московские учебники — СиДиПресс», 2007. — 159 с.
7. Lequier L.L., Nikaidoh H., Leonard S.R. et al. Preoperative and Postoperative Endotoxemia in Children With Congenital Heart Disease // Chest. — 2000. — Vol. 117, №. 6. — P. 1706-1712.
8. Хавкин А.И. Микрофлора пищеварительного тракта. — М.: Фонд социальной педиатрии, 2006. — 416 с.
9. Roslansky Р.F. Serum testing using chromogenic and Gel-Clot methods // LAL APDATE. — 1990. — Vol. 8, № 4. — P. 1-4.
10. Бондаренко В.М., Лиходед В.Г., Яковлев М.Ю. Определение эндотоксина грамотрицательных бактерий в крови человека // Микробиология. — 2002. — № 2. — С. 83-89.
11. Cohen J. The detection and interpretation of endotoxaemia // Intensive Care Med. — 2000. — Vol. 26, № 1. — P. 51-56.
12. Егорова Е.Н., Горшкова М.А., Кузьмина М.А. и др. Применение хромогенного LAL-теста по конечной точке для определения уровня эндотоксинемии // Клиническая лабораторная диагностика. — 2008. — № 9. — С. 27.
13. Hurley J.C. Does gram-negative bacteraemia occur without endotoxaemia? A meta-analysis using hierarchical summary ROC curves // Eur. J. Clin. Microbiol. Infect Dis. — 2010. — Vol. 29, № 2. — P. 207-215.
14. Остаева Л.Н. Комплексная терапия гестоза с применением энтеросорбентов: Автореф. дис... канд. мед. наук: спец. 14.00.01 «Акушерство и гинекология». — М., 2009. — 20 с.
15. Opal S. M. The clinical relevance of endotoxin in human sepsis: a critical analysis // Innate Immunity. — 2002. — Vol. 1, № 8. — P. 473-476.
