Журнал «Боль. Суставы. Позвоночник» 1 (01) 2011
Вернуться к номеру
Мінеральна щільність кісткової тканини та рентгеноморфометричні індекси аксіального скелета у хворих на глюкокортикоїд-індукований остеопороз
Авторы: Поворознюк В.В., Карасевська Т.А., Дзерович Н.І., ДУ «Інститут геронтології НАМН України», Український науково-медичний центр проблем остеопорозу, м. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати

На сьогоднішній день з усіх відомих фармакологічних засобів глюкокортикоїди (ГК) залишаються препаратами з найсильнішою протизапальною активністю. Незважаючи на значні досягнення в лікуванні ревматичних, нефрологічних, гематологічних захворювань та патології бронхолегеневої системи, розробку та впровадження в практику нових хворобомодифікуючих агентів, існують клінічні ситуації, коли альтернативи призначенню ГК немає. Тривале застосування ГК призводить до розвитку цілого ряду побічних ефектів, серед яких остеопороз (ОП) та остеопоротичні переломи посідають провідне місце.
Вплив глюкокортикоїдів на кісткову тканину
Глюкокортикоїд-індукований остеопороз (ГКІ ОП) виникає в результаті збільшення спричиненої остеокластами резорбції кісткової тканини (КТ) та зниження формування КТ остеобластами. Відбувається активація процесів ремоделювання КТ, що зумовлює зростання швидкості резорбції без компенсаторного утворення кісткового матриксу і, як наслідок цього, швидку втрату кісткової речовини.
Глюкокортикоїди знижують формування КТ, пригнічуючи остеобластогенез і збільшуючи апоптоз остеобластів. Крім того, вони викликають загибель ізольованих сегментів КТ (остеонекроз), що, ймовірно, пов’язане із збільшенням апоптозу остеоцитів [56].
При тривалому застосуванні ГК кількість остеобластів продовжує зменшуватися, змінюється диференціювання стромальних клітин у бік продукції адипоцитів, а не остеобластів. Також відомо, що ГК змінюють функціональні характеристики остеобластів, безпосередньо пригнічуючи їх активність і, таким чином, синтез кісткового матриксу.
На початку лікування ГК резорбція КТ збільшується. Було встановлено глюкокортикоїд-індуковану експресію RANKL-ліганда, з чим і пов’язують збільшення тривалості життя остеокластів. Експериментальні дослідження також показали, що під впливом ГК подовжується життя остеокластів і пригнічується їх апоптоз. Крім того, вплив ГК на КТ при тривалому їх використанні можна пояснити зниженням кількості нових остеобластів і попередників остеокластів, а також підвищеним апоптозом зрілих остеобластів і остеоцитів та порушенням балансу між цими процесами. Глюкокортикоїди дозозалежно зменшують абсорбцію кальцію в кишечнику, збільшують секрецію паратгормона та підвищують реабсорбцію кальцію нирками. Серед основних причин виникнення ГКІ ОП також слід відмітити порушення метаболізму вітаміну D. Катаболічний вплив ГК на метаболізм м’язів значно збільшує ризик падінь, а отже, й остеопоротичних переломів.
Проте не в усіх пацієнтів при прийомі ГК спостерігаються подібні зміни. Особливості впливу ГК на кісткову тканину можуть бути обумовлені спадковим чинником, видом ГК-рецептора, індивідуальними фармакокінетичними відмінностями. Наприклад, встановлено, що активність 11b-гидроксистероїд дегідрогенази, яка перетворює неактивний кортизон в активний кортизол, збільшена в людей літнього віку, чим можна пояснити чутливість цих пацієнтів до впливу ГК.
Реакцію КТ на ГК можна передбачити за допомогою рівня маркерів ремоделювання КТ, тому деякі автори вважають, що таким чином можна ідентифікувати людей з найвищим ризиком розвитку ГКІ ОП.
Втрата кісткової маси при лікуванні ГК має двофазний характер: найшвидша вона в перший місяць відразу після початку терапії і протягом року досягає 6–12 %, надалі сповільнюється та складає приблизно 3 % на рік, проте все одно перевищує у два-три рази фізіологічний рівень. Ризик виникнення переломів також драматично зростає протягом перших 3 місяців від початку лікування ГК.
Необхідно зазначити, що зміни КТ при ГКІ ОП та, відповідно, ризик виникнення переломів є відносно оборотним процесом після припинення терапії ГК. Доведено, що через рік закінчення прийому ГК ризик переломів зменшується та відповідає ризику переломів у пацієнтів, які ГК не приймали.
Більшість дослідників вважає, що пороговою дозою щодо розвитку побічних ефектів з боку КТ є 7,5 мг преднізолону на день. Проте доведено, що нижчі дози й навіть інгаляційні ГК також можуть їх викликати. У дітей, які використовували в лікуванні низькі дози інгаляційних ГК, спостерігалась затримка зросту [49]. У дорослих, які застосовували високі дози інгаляційних ГК, спостерігалося зниження щільності КТ, яке залежало від дози ГК. Встановлено, що кумулятивна доза інгаляційних ГК у хворих із бронхіальною астмою негативно корелює зі щільністю КТ [89]. Біохімічні маркери формування та резорбції КТ також були значно знижені під впливом інгаляційних ГК, навіть при короткотривалому лікуванні.
Прийом ГК через день або використання пульс-терапії меншою мірою пригнічує функціонування осі гіпоталамус — гіпофіз — надниркові залози, але повністю небажані скелетні побічні ефекти таким чином не усуваються.
Тому з метою зменшення частоти побічних ефектів у клінічній практиці необхідно використовувати найнижчу ефективну дозу як системних, так і інгаляційних ГК.
Хоча не в усіх пацієнтів, що приймають ГК, розвивається ГКІ ОП і не в усіх пацієнтів з ГКІ ОП є переломи, втрата кісткової маси залишається найбільш передбаченим, найчастішим і потенційно найтяжчим ускладненням лікування ГК. Захисні заходи щодо КТ повинні бути оцінені в усіх пацієнтів, які отримують ГК, та у тих, кому таке лікування планується.
Дані щодо впливу віку, статі чи основного захворювання на стан КТ при використанні ГК та їх ускладнення є суперечливими та потребують подальшого вивчення. Існують дані, що в людей літнього віку з ревматичними захворюваннями порівняно з молодими пацієнтами вертебральні переломи при використанні ГК зустрічаються частіше. У роботі I. Tatsuno et al., 2009, проводився аналіз частоти переломів тіл хребців протягом 20 років у пацієнтів різного віку з колагенозами залежно від наявності терапії ГК. Так, у пацієнтів, які отримували лікування високими дозами ГК (і 20 мг за еквівалентом по преднізолону), частота виникнення симптоматичних вертебральних переломів становила 23,9 % проти 2,6 % пацієнтів, які не приймали ГК. При оцінці вікових особливостей виникнення переломів тіл хребців при використанні ГК встановлено, що коефіцієнт ризику переломів вірогідно вищий у пацієнтів віком понад 60 років порівняно з молодшими групами. Відмічено 26-разове збільшення коефіцієнта ризику в групі 60–68 років порівняно з групою 18–31 рік. У групі пацієнтів із переломами тіл хребців тривалість лікування до перелому негативно асоціювалась з віком.
Ризик переломів значно зростає при призначенні ГК пацієнтам, які страждають ревматичними захворюваннями або захворюваннями дихальних шляхів. У недавно проведеному мета-аналізі було встановлено збільшення відносного ризику остеопоротичних переломів при прийомі ГК (без розподілу пацієнтів за основним захворюванням) у жінок (1,42) та чоловіків (2,2) [37]. Проте складно відокремити вплив на кісткову тканину чинників основного захворювання від безпосереднього впливу ГК. Хоча в багатьох дослідженнях доведено, що вплив ГК на кісткову тканину зростає при контрольованих показниках активності основного захворювання. Важливим є те, що прийом ГК у дозі < 7,5 мг за еквівалентом по преднізолону вірогідно асоціюється з підвищеним ризиком деформацій тіл хребців. Встановлено, що при застосуванні ГК протягом навіть 1 місяця значно зростає ризик переломів [37, 84].
Відомо, що у хворих на ревматоїдний артрит показники мінеральної щільності кісткової тканини (МЩКТ) вірогідно нижчі та ризик виникнення низькоенергетичних переломів збільшений ще до початку призначення ГК, що пов’язано з особливостями перебігу даного захворювання. При призначенні ГК при ревматичних захворюваннях втрата МЩКТ залежить від статі пацієнта. З цією метою було проведено порівняння факторів ризику остеопорозу в жінок у пре- та постменопаузальному періоді та чоловіків, які страждають від ревматоїдного артриту. Групи пацієнтів за кумулятивною дозою ГК, тривалістю основного захворювання були стандартизовані. Індекс маси тіла вірогідно був меншим у жінок в пременопаузальному періоді порівняно з жінками в пост- менопаузі та чоловіками. В усій групі пацієнтів частка остеопорозу на рівні поперекового відділу хребта при визначенні за допомогою рентгенівської абсорбціометрії становила 32,9 %, остеопенії — 43,4 %; на рівні шийки стегнової кістки ці показники становили 38,1 та 41,7 % відповідно. У групі пацієнтів, які отримували ГК, частка остеопорозу склала 49,1 % та остеопенії — 38 %; в групі пацієнтів, які не отримували ГК, — 43,5 та 44,5 % відповідно. При оцінці порушень структурно-функціонального стану кісткової тканини залежно від статі було встановлено, що частка остеопорозу в жінок у постменопаузальному періоді (55,7 %) та чоловіків (50,5 %) була вірогідно вищою порівняно з показниками жінок у пременопаузі (18 %; р < 0,001). Нормальні показники МЩКТ вірогідно частіше виявлялися в жінок у пременопаузальному періоді (37 %; р < 0,001) порівняно з жінками в постменопаузі (7 %) та чоловіками (8,4 %). Частота остеопенії в обстежуваних групах вірогідно не відрізнялась. При розподілі пацієнтів залежно від дози ГК на чотири групи (без ГК, ГК у дозі до 5 мг, 5–20 мг та вище 20 мг) частота остеопорозу в жінок у постменопаузальному періоді була вірогідно вищою (р = 0,005) порівняно з жінками в пременопаузальному періоді та чоловіками. Крім того, в результаті дослідження були визначені різні фактори ризику щодо втрати кісткової тканини в пацієнтів, які страждають від ревматоїдного артриту, залежно від статі: у жінок у пременопаузальному періоді та чоловіків — низький індекс маси тіла, висока кумулятивна доза ГК, тривалість основного захворювання; у жінок у постменопаузальному періоді — вік, низький індекс маси тіла, тривалість основного захворювання, висока кумулятивна доза ГК [57].
Глюкокортикоїд-індукована втрата КТ більшою мірою визначається в ділянках скелета, які мають трабекулярну будову, а саме в тілах хребців. Досить частим першим клінічним проявом остеопорозу є різкий біль та обмеження функції хребта, причиною яких є вертебральні переломи. За даними R. de Nijs et al. (2001) частота вертебральних деформацій (25 %) і вертебральних переломів (8 %), що клінічно виявляються, у пацієнтів з ревматичними захворюваннями, які приймають ГК, є вищою порівняно з пацієнтами, які ГК не лікуються (13 і 1,5 % відповідно).
Крім того, у недавно опублікованому дослідженні також були встановлені вірогідні відмінності щодо наявності деформацій тіл хребців при ревматоїдному артриті (36 % (62/172)). У жінок, які страждають від ревматоїдного артриту, при наявності деформацій тіл хребців спостерігаються вірогідно менша маса тіла, МЩКТ та Т-показник на рівні шийки стегнової кістки порівняно з жінками з ревматоїдним артритом і відсутністю деформацій тіл хребців. Покроковим регресійним аналізом встановлений зв’язок між низькою масою тіла, Т-показником на рівні шийки стегнової кістки, тривалістю захворювання, рівнем С-реактивного білка та показником шкали Шарпа [50].
Відповідно до даних більшості досліджень, вплив ГК є дозозалежним. Показана кореляція між кумулятивною дозою ГК і зниженням МЩКТ, а також між добовою дозою ГК і ризиком переломів [79–81]. До цього часу дискутується питання щодо впливу низьких доз ГК на стан КТ. Проте рандомізовані клінічні дослідження чітко вказують на достовірне зниження показників МЩКТ на рівні поперекового відділу хребта в пацієнтів, які приймають преднізолон у добовій дозі 7,5 мг протягом 20 тижнів, на 8,2 % та протягом 12 тижнів — на 2,0 %. Доведено, що використання ГК є чинником ризику переломів незалежно від показника МЩКТ. У пацієнтів, які приймають ГК, виникають якісні зміни КТ, порушення її архітектоніки, просторової орієнтації трабекул. Гістоморфометричними дослідженнями доведено, що втрата КТ у результаті терапії ГК відбувається переважно за рахунок потоншення трабекул і, меншою мірою, у результаті перфорації та їх роз’єднання, як при ідіопатичному остеопорозі. Чітко доведено, що при однакових показниках МЩКТ ризик переломів при ГКІ ОП у декілька разів вищий, ніж при постменопаузальному остеопорозі.
У дослідженні Sh. Kumagai et al. (2005) оцінювали фактори, що б могли вплинути на виникнення переломів у пацієнтів, які приймають високі дози ГК (0,5 мг/кг і більше тривалістю понад 1 місяця) у зв’язку з аутоімунними захворюваннями. Значення МЩКТ для виникнення переломів у жінок постменопаузального періоду виявилось нижчим (МЩКТ = 0,787 г/см2, Т-показник = = –2,1 SD) порівняно з жінками у пременопаузі (МЩКТ = 0,843 г/см2, Т-показник = –1,7 SD). Крім того, вертебральні переломи частіше зустрічались у жінок, які мали високий рівень загального холестерину (> 280 мг/дл), порівняно з тими, у кого рівень загального холестерину був у межах норми (< 220 мг/дл). Також жінки з нормальним рівнем загального холестерину мали вірогідно вищий показник МЩКТ. На підставі того, що у пременопаузальних жінок з нормальним рівнем МЩКТ переломи тіл хребців зустрічаються частіше, а також того, що існує зв’язок між гіперліпідемією та переломами, автори роблять припущення, що вплив ГК є мультифакторним процесом з можливим залученням обміну ліпідів [40].
Діагностика
Переломи тіл хребців частіше виникають спонтанно або як результат мінімальної травми внаслідок рухових навантажень на хребет, таких як нахили вперед, підйом предметів та ін. [14, 15]. Вертебральні переломи можуть проявлятися субклінічно, а також викликати майже нестерпний гострий біль упродовж багатьох тижнів або навіть місяців, особливо у хворих з декількома переломами в анамнезі [68]. Локалізація й тяжкість перелому тіла хребця визначає характер і рівень болю [48]. Множинні переломи тіл хребців найчастіше проявляються хронічним болем чи дискомфортом. Іноді пацієнти такому прояву дають назву «втома спини». Біль у кістках, що спостерігається під час перелому, звичайно гострий та може минути за 6–8 тижнів. Міалгії, ентезити та дискомфорт, пов’язаний з деформацією хребта й зменшенням зросту, можуть стати хронічними, що виснажує пацієнта у фізичному та психологічному відношенні, значною мірою через їхню постійність. Вірогідними маркерами переломів тіл хребців є зниження зросту більше 3 сантиметрів, наявність кіфозу або показники МЩКТ. Крім того, хронічний біль, пов’язаний з остеопорозом, — часто основна причина значних психологічних і соціальних наслідків для пацієнтів. Переломи тіл хребців погіршують функціональну активність пацієнта. Пацієнти з вертебральними переломами зазнають труднощів у виконанні простих рухів, таких як нахили, ходьба, вдягання, перенесення речей, вкладання у ліжко та підйом з нього, готування їжі, умивання, користування туалетом і підйом на один поверх [45]. У зв’язку з тим, що чіткі клінічні ознаки та симптоми деформації тіла хребця не визначені або відсутні, більша частка (до 75 %) переломів тіл хребців, які можуть бути рентгенологічно підтверджені, залишається невиявленою у загальній популяції [14]. Однак при наявності деформацій тіл хребців значно ускладнюється перебіг захворювання та збільшується летальність, отже, необхідно уважніше діагностувати вертебральні переломи, усвідомлювати діагностичну значимість проведення рентгенографічного обстеження у боковій проекції.
Проведення рентгенографії має бути скринуючим методом обстеження щодо виявлення переломів тіл хребців при появі болю в нижній частині спини або його загостренні в пацієнтів, які отримують ГК.
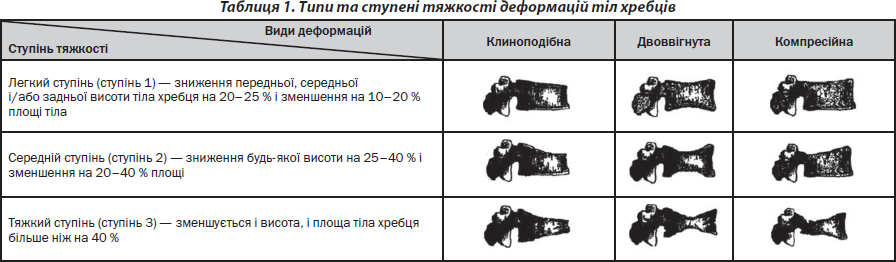
Для підтвердження вертебрального перелому на рентгенограмі повинні чітко візуалізуватись контури тіла хребця, це дасть змогу визначити втрату висоти або дефект в корковому шарі. При візуальній оцінці контурів тіл хребців вертебральні переломи підрозділяють на клиноподібні, двоввігнуті або компресійні. При клиноподібній деформації зменшується у розмірі передня або задня частина тіла хребця, при двоввігнутій деформації — центральна частина й при компресійній — руйнується все тіло хребця.
Клиноподібні деформації найбільш часто зустрічаються та переважно виявляються у середньогрудному відділі хребта та у перехідній зоні (грудний в поперековий відділ хребта) як у чоловіків, так і у жінок [35]. Компресійні деформації також більш часто зустрічаються в середньогрудному відділі хребта й в ділянці переходу грудного в поперековий відділ. На відміну від інших типів деформацій, двоввігнуті деформації однаково часто зустрічаються в тілах хребців як поперекового відділу хребта, так і в інших відділах.
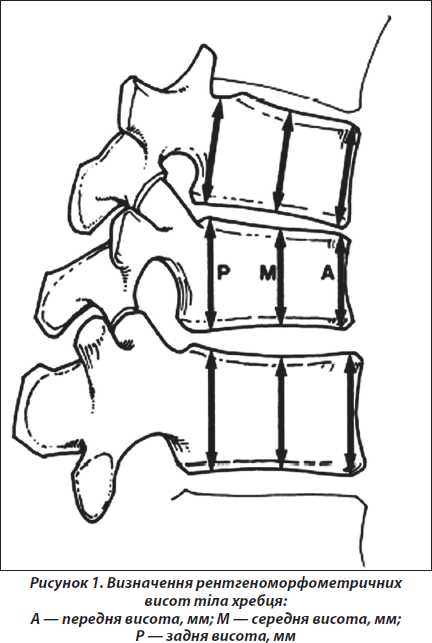
Лікар при оцінці рентгенограм може не робити прямих вимірів висоти тіл хребців або може порівняти виміряне відношення висот. Однак напівкількісне дослідження є суб’єктивною оцінкою. Для кількісної оцінки контуру тіла хребця проводять морфометричний аналіз. Цей тип досліджень використовується насамперед у клінічних дослідженнях і включає порівняння передньої, задньої і середньої висоти для визначення типу перелому та ступеня тяжкості (рис. 1).
Розроблено декілька кількісних та напівкількісних методик, розраховані індекси щодо виявлення деформацій тіл хребців з використанням рентгеноморфометричного методу: індекси Barnett — Nordin (1960), Рохліна (1974), остеопоротичний індекс Є.П. Подрушняка (1987) [2–4], методи Мeunier (1972), Dambacher (1982), Kleerekoper (1984), Melton (1989), Felsenberg (1990), Raymakers (1990) та ін. [4]. Використання зазначених методик потребує часу та педантичного підходу до підрахунку показників. Крім того, існують певні їх переваги та недоліки застосування. Так, у дослідженні, метою якого було порівняння напівкількісного методу Kleerekoper та кількісних методик Мeunier, Melton та Raymakers у визначенні деформацій тіл хребців у пацієнтів з ревматоїдним артритом залежно від вживання ГК, встановлені вірогідні відмінності щодо частоти деформацій тіл хребців. Клінічно виявлені деформації тіл хребців були зареєстровані в 13 % пацієнтів із ревматоїдним артритом, які приймали ГК, порівняно з пацієнтами з ревматоїдним артритом, що не приймали ГК (2 %). За методом Kleerekoper зазначені частки деформації тіл хребців становили 58 і 25 % відповідно (відносний ризик 2,31; 95% довірчий інтервал (ДІ): 1,36–3,90). Вірогідно значимих відмінностей у пацієнтів з ревматоїдним артритом залежно від вживання ГК за методиками Мeunier, Melton та Raymakers не встановлено. Усі типи деформацій тіл хребців (клиноподібні, двоввігнуті та компресійні) зустрічались однаково часто в обох групах пацієнтів. Також не було виявлено відмінностей у пацієнтів з ревматоїдним артритом щодо типу деформацій тіл хребців залежно від вживання ГК [46].
При рентгеноморфометричному аналізі визначають різний ступінь деформацій тіл хребців: легкий, помірний та тяжкий. Останнім часом найбільш часто використовується з метою морфометричного аналізу класифікація H.K. Genant (табл. 1), згідно з якою розрізняють три ступені деформацій тіл хребців [22–25].
Перелом тіл хребців можна також діагностувати при зменшенні одного зі співвідношень висот тіл хребців (А/Р, А/М) для будь-якого хребця на три стандартних відхилення — середній показник, отриманий Melton L.J. [53]. Таким чином, морфометрія хребців з її детальними вимірами хоч і не завжди широко використовується в клінічній практиці через обмеження часу, але може застосовуватись у клінічних дослідженнях.
Золотим стандартом діагностики остеопорозу та визначення МЩКТ на рівні поперекового відділу хребта, стегнової кістки та кісток передпліччя є двохенергетична рентгенівська абсорбціометрія (ДРА). В останні роки з’явилась можливість проводити діагностику деформацій тіл хребців при ДРА — рентгеноморфометричний аналіз тіл хребців у боковій проекції (латеральна рентгенівська абсорбціометрія). Даний метод дає додаткову можливість оцінити ризик нового перелому на підставі не тільки показників МЩКТ аксіального скелета [83]. У дослідженні H.K. Genant et al. при порівнянні діагностичної цінності у виявленні деформацій тіл хребців рентгенографічного методу і ДРА було встановлено, що декілька деформацій тіл хребців легкого ступеня можуть залишатись недіагностованими при проведенні рентгеноморфометричного аналізу за допомогою латеральної рентгенівської абсорбціометрії. Проте низьке променеве навантаження, відносно мала кількість часу, необхідного для проведення морфометричної оцінки тіл хребців, і в той же час визначення МЩКТ та моніторинг показників роблять ДРА методом вибору в діагностиці вертебральних деформацій [22–25].
Виявлення пацієнтів з переломами тіл хребців є важливим у зв’язку з тим, що в даних пацієнтів зростає ризик виникнення нових переломів будь-якої ділянки скелета. У пацієнта з одним переломом у 2–3 рази більше ймовірність появи нового низькоенергетичного перелому. При наявності двох або більше переломів в анамнезі у 9 разів збільшується ризик перелому в подальшому незалежно від показників МЩКТ [61]. Крім того, встановлено, що ступінь тяжкості перелому тіла хребця є більшим предиктором появи нових переломів тіл хребців, ніж показники МЩКТ.
Проте МЩКТ є одним з основних параметрів оцінки ефективності антирезорбтивної терапії в клінічних дослідженнях. З урахуванням того, що глюкокортикоїд-індукована втрата КТ може відбуватися достатньо швидко, визначення МЩКТ рекомендується проводити через 6 місяців після початку терапії ГК і далі щорічно.
Лікування
Кожен пацієнт, який отримує лікування ГК, а також всі пацієнти, кому лікування ГК планується, повинні бути оцінені з метою виявлення загальних факторів ризику остеопорозу та їх усунення, серед яких: вживання алкоголю, куріння, недостатня фізична активність, низьке споживання кальцію з їжею. Крім того, фактори ризику переломів і падінь, наприклад, ортостатична гіпотензія, лікування снодійними препаратами, повинні бути виявлені та по можливості усунені. Будь-які інші причини вторинного остеопорозу, наприклад гіпогонадизм, гіперпаратиреоз або тиреотоксикоз, можуть підсилити негативний вплив ГК на КТ та збільшити швидкість втрати кісткової маси після початку лікування ГК.
Глюкокортикоїд-індукована втрата КТ повинна бути попереджена, а виявлена потребує лікування.
Кальцій та вітамін D
Лікування ГК призводить до зниження абсорбції кальцію в кишечнику та збільшення виведення його з сечею, що обумовлює вторинне збільшення рівня паратгормона. Відновлення балансу кальцію та при цьому профілактика вторинного гіперпаратиреозу використовувалися як емпірична терапія остеопорозу різної етіології протягом декількох десятиліть.
У мета-аналізі щодо впливу препаратів кальцію та вітаміну D було показано ефективність активних метаболітів вітаміну D у збереженні КТ і зменшенні ризику вертебральних переломів [67]. Проте існують проспективні рандомізовані дослідження, у яких використання тільки препаратів кальцію та/або вітаміну D з метою профілактики глюкокортикоїд-індукованої втрати кісткової маси та зменшення ризику переломів не було ефективним. За відсутності протипоказань їх необхідно розглядати як обов’язкове доповнення до дієти та до будь-якої фармакотерапії ГКІ ОП.
Таким чином, препарати кальцію та вітаміну D в дозі 800 МО/день чи активні метаболіти вітаміну D (альфакальцидол 1 мкг/день чи кальцитріол 0,5 мкг/день) необхідно призначати всім пацієнтам, які приймають ГК, для відновлення нормального балансу кальцію. Доведено, що така комбінація препаратів підтримує кісткову масу в пацієнтів, які тривало приймають ГК у дозі від низької до середньої та мають нормальний рівень статевих гормонів. Проте відсутні дані щодо ефективної профілактики переломів з використанням препаратів кальцію та активних метаболітів вітаміну D.
Бісфосфонати
На сьогоднішній день для лікування захворювань КТ існує сім сполук бісфосфонатів (БФ): етидронат, клодронат, памідронат, алендронат, ібандронат, ризендронат, золедронат. Головна дія БФ на скелет полягає в уповільненні мінералізації кістки та хряща, а також інгібуванні остеокластами резорбції КТ. У культурі тканини БФ уповільнюють нормальну та стимульовану резорбцію КТ, запобігають остеолізису, що викликається багатьма чинниками, зокрема паратиреоїдним гормоном, кальцитріолом, простагландинами тощо. Зв’язуючись із гідроксилапатитом, БФ накопичуються під активними остеокластами в ділянках резорбції кістки, що знижує здатність остеокластів до резорбції КТ (втрата щіткової облямівки, руйнування цитоскелета, нездатність остеокластів до пересування або скріплення з КТ). БФ можуть також викликати апоптоз остеокластів, що також пояснює їх антирезорбтивну активність. Окрім прямого впливу на остеокласти, БФ також можуть «захищати» остеоцити та остеобласти від апоптозу, який викликають ГК.
Антирезорбтивні препарати є ефективними в лікуванні ГКІ ОП, попереджують втрату кісткової маси, помірно збільшують її на рівні поперекового відділу хребта та утримують на рівні шийки стегнової кістки.
БФ ефективні як для попередження, так і для лікування глюкокортикоїд-індукованої втрати кісткової маси. Встановлено, що БФ також знижують частоту вертебральних переломів у жінок у постменопаузі з ГКІ ОП. Лікування БФ рекомендується з метою втрати кісткової тканини для чоловіків та жінок у постменопаузальному періоді, які розпочинають лікування ГК в дозі більше 5 мг/день за еквівалентом по преднізолону, а також для чоловіків та жінок у постменопаузальному періоді, які тривало лікуються ГК та мають показники МЩКТ поперекового відділу хребта та/або стегнової кістки нижчі за нормальні.
Таким чином, відповідно до більшості досліджень БФ є препаратами першої лінії з метою профілактики [5–8, 26, 66] ГКІ ОП, ефективними в збереженні кісткової маси та/або в профілактиці переломів у пацієнтів, які використовують різні дози ГК і мають різну тривалість лікування.
Небагато даних щодо профілактики та лікування втрати кісткової маси в жінок у пременопаузальному періоді, проте такі жінки також втрачають кісткову масу при тривалому лікуванні ГК, тому профілактичне призначення антирезорбтивних препаратів необхідне.
Кальцитонін
Кальцитонін пригнічує резорбцію КТ за допомогою специфічних рецепторів, розташованих на остеокластах. У багатьох дослідженнях показано, що кальцитонін запобігає зниженню МЩКТ на рівні хребта, але не шийки стегнової кістки протягом першого року терапії ГК. Оскільки його ефективність для профілактики переломів при ГКІ ОП остаточно не встановлена, препаратами вибору для лікування та профілактики ГКІ ОП повинні бути БФ. Кальцитонін слід рекомендувати пацієнтам, у яких застосування БФ протипоказане, або при наявності гострого болю в ділянці вертебральних переломів.
Інші лікарські засоби
На сьогоднішній день недостатньо даних щодо ефективності анаболічних агентів (у тому числі препаратів паратгормона) та комбінованого лікування в пацієнтів, які отримують ГК, тому необхідні подальші дослідження щодо доцільності використання даних схем з метою профілактики виникнення ускладнень від терапії ГК.
Таким чином, для відновлення нормального балансу кальцію всім пацієнтам, які приймають ГК, неодмінним є призначення препаратів кальцію та вітаміну D. Препаратами вибору в профілактиці та лікуванні ГКІ ОП серед антирезорбтивних засобів є бісфосфонати. Прийом препаратів необхідно продовжувати так довго, як пацієнт лікується ГК.
Клінічний випадок
Хвора Р., 22 роки, зріст 160 см, маса тіла 70 кг.
Скарги на постійні болі в хребті, довгих трубчастих кістках скелета, загальну слабкість, стомлюваність. Хворіє чотири роки, коли після перенесеної ангіни через три тижні розвинувся набряк лиця, нижньої частини тулуба. Після комплексного обстеження встановлено діагноз «гострий гломерулонефрит», з приводу якого протягом першого року приймала високі дози глюкокортикоїдів. Через рік з’явилися постійні болі в спині, що стали причиною звернення в Український науково-медичний центр проблем остеопорозу. Операцій, переломів в анамнезі не було. На момент звернення пацієнтка продовжує прийом метипреду в дозі 8 мг на добу.
З історії хвороби.
На бічних рентгенограмах грудного і поперекового відділів хребта визначається виражений остеопороз з компресією тіл грудних і поперекових хребців. Кальцій крові — 2,4 ммоль/л, ШОЕ — 10 мм/год.
За результатами обстеження методом двохенергетичної рентгенівської абсорбціометрії встановлено зниження показників мінеральної щільності КТ у всіх відділах скелета:
— поперековий відділ хребта: ВМD 0,810 г/см2, Т-показник –3,1, Z-показник –1,5;
— стегнова кістка: ВМD 0,821 г/см2, Т-показник –1,5, Z-показник –0,2;
— середня третина передпліччя: ВМD 0,759 г/см2, Т-показник –1,4, Z-показник 0,3;
— весь скелет: ВМD 1,006 г/см2, Т-показник –1,5, Z-показник –0,2.
За даними рентгеноморфометричного аналізу встановлено наявність деформацій тіл хребців Th10, Th11, Th12, L1, L2, L3 (рис. 2).
Діагноз: глюкокортикоїд-індукований остеопороз з множинними деформаціями тіл хребців з обмеженням функції та іритативно-больовим синдромом на тлі хронічного гломерулонефриту.
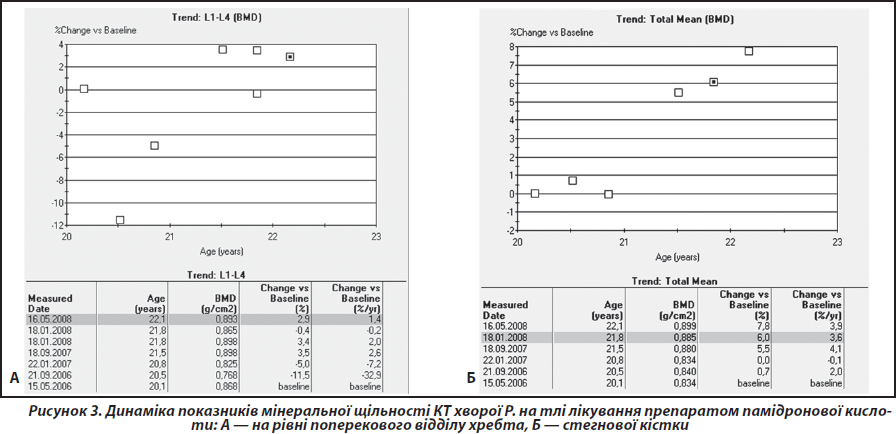
Лікування проведено шляхом внутрішньовенного краплинного введення памідронової кислоти (препарат паміред у дозі 30 мг, кратністю двічі, з інтервалом 3–4 дні (сумарна доза за один курс 60 мг)). Курс лікування повторено протягом року чотири рази. За результатами контрольних досліджень встановлено збільшення показників мінеральної щільності КТ у всьому скелеті, на рівні поперекового відділу хребта та стегнової кістки (рис. 3).
1. Поворознюк В.В., Нейко Є.М., Головач І.Ю. Глюкокортикоїд-індукований остеопороз — К.: ТМК, 2000. — 206 с.
2. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку: Вибр. лекції, огляди, ст. — К., 2004. — Т. 2. — 519 с.
3. Поворознюк В.В., Быстрицкая М.А., Орлик Т.В., Дзерович Н.И., Карасевская Т.А., Вайда В.М., Балацкая Н.И. Памидроновая кислота в лечении заболеваний костной ткани / Под ред. профессора Поворознюка В.В. — 2-е изд., пересмотр. и доп. — К.: Украинский научно-медицинский центр проблем остеопороза. — К., 2010. — 220 с.
4. Орлик Т.В. Оцінка структурно-функціонального стану кісткової тканини хребта за рентгенморфометричними показниками в людей різного віку та статі: Дис… канд. мед. наук: 14.01.21. — К., 2006. — 200 c.
5. Adachi J.D., Roux C., Pitt P.I. et al. A pooled data analysis on the use of intermittent cyclical etidronate therapy for the prevention and treatment of corticosteroid induced bone loss // J. Rheumatol. — 2000. — Vol. 27, № 10. — Р. 2424-2431.
6. Adachi J.D., Saag K.G., Delmas P.D. et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial // Arthritis Rheum. — 2001. — 44 (1). — P. 202-211.
7. Adachi J.D., Saag K.G., Delmas P.D. et al. Two-year effects of alendronate on bone mineral density and vertebral fracture in patients receiving glucocorticoids: a randomized, double-blind, placebo-controlled extension trial //Arthritis Rheum. — 2001. — 44. — P. 202-211.
8. Boutsen Y., Jamart J. , Esselinckx W., Devogelaer J. P. Primary prevention of glucocorticoid-induced osteoporosis with intravenous pamidronate and calcium: a prospective controlled 1-year study comparing a single infusion, an infusion given once every 3 months, and calcium alone // J. Bone Miner. Res. — 2001. — 16 (1). — P. 104-112.
9. Briggs A.M., Greig A.M., Wark J.D. The vertebral fracture cascade in osteoporosis: a review of aetiopathogenesis // Osteoporos Int. — 2007. — 18 (5). — P. 575-584.
10. Browner W.S. Predicting fracture risk: tougher than it looks // Bone. — 2007. — 4 (8). — Р. 226-230.
11. Campbell I.A., Douglas J.G., Francis R.M. et al. Five year study of etidronate and/or calcium as prevention and treatment for osteoporosis and fractures in patients with asthma receiving long term oral and/or inhaled glucocorticoids // Thorax. — 2004. — 59 (9). — Р. 761-768.
12. Compston J. US and UK guidelines for glucocorticoid-induced osteoporosis: similarities and differences // Curr. Rheumatol. Rep. — 2004. — 6 (1). — P. 66-69.
13. Cook D.J., Guyatt G.H., Adachi J.D. et al. Quality of life issues in women with vertebral fractures due to osteoporosis // Arth. Rheum. — 1993. — 36. — Р. 750-756.
14. Cooper C., Atkinson E.J., O’Fallon W.M. et al. Incidence of clinically diagnosed vertebral fractures: A population based study in Rochester, Minnesota 1985–1989 // J. Bone Min. Res. — 1992. — 7. — Р. 221-227.
15. Cooper C., Atkinson E.J., Jacobsen S.J. et al. Population-based study of survival after osteoporotic fractures // Am. J. Epidemiol. — 1993. — 137. — Р. 1001-1005.
16. Cranney A., Welch V., Adachi J.D. et al. Calcitonin for the treatment and prevention of corticosteroid-induced osteoporosis // Cochrane Database Syst. Rev. — 2000. — 2. — Art. No.: CD001983.
17. De Nijs R.N., Jacobs J.W., Lems W.F. et al. Alendronate or alfacalcidol in glucocorticoid-induced osteoporosis // N. Engl. J. Med. — 2006. — 355 (7). — P. 675-684.
18. Devogelaer J.P., Adler R.A., Recknor C. et al. Baseline glucocorticoid dose and bone mineral density response with teriparatide or alendronate therapy in patients with glucocorticoid-induced osteoporosis // J. Rheumatol. — 2010. — 37 (1). — P. 141-148.
19. Donnell P., Hugh P.E., O’Mahoney D. Vertebral osteoporosis and trabecular bone quality // Ann. Biomed. Eng. — 2007. — 35 (2). — P. 170-189.
20. Ettinger B., Black D. M., Nevitt M. C. et al. Contribution of vertebral deformities to chronic back pain and disability // J. Bone Miner. Res. — 1992. — 7. — P. 449-456.
21. Ettinger B., Chidambaran P., Pressman A. Prevalence and determinants of osteoporosis drug prescription among patients with high exposure to glucocorticoid drugs // Am. J. Manag. Care. — 2001. — 7 (6). — P. 597-605.
22. Genant H.K., Binkley N.C., Drezner M.K. Dual-energy lateral vertebral assessment for identification of spine fractures: comparison with standard X-ray imaging // Dept. of Radiology, University of California San Francisco, San Francisco CA and University of Wisconsin, 2002. — P. 2.
23. Genant H.K., Jergas M. Assessment of prevalent and incident vertebral fractures in osteoporosis research // Osteoporos. Int. — 2003. — 14. — Р. 43-55.
24. Genant H.K., Li J., Wu C.Y., Sheperd J.A. Vertebral fractures in osteoporosis — a new method for clinical assessment // J. Clin. Densitometry. — 2000. — 3. — 281-290.
25. Genant H.K., Wu C.Y., van Kuijk C. et al. Vertebral fracture assessment using a semiquantititive technique // J. Bone Miner. Res. — 1993. — 8. — P. 1137-1148.
26. Geusens P.P., de Nijs R.N., Lems W. F. et al. Prevention of glucocorticoid osteoporosis: a consensus document of the Dutch Society for Rheumatology // Ann. Rheum. Dis. — 2004. — 63 (3). — Р. 324-325.
27. Gold D.T. The clinical impact of vertebral fractures: Quality of life in women with osteoporosis // Bone. — 1996. — 18. — P. 185-189.
28. Gudbjornsson B., Juliusson U.I., Gudjonsson F.V. Prevalence of long term steroid treatment and the frequency of decision making to prevent steroid induced osteoporosis in daily clinical practice // Ann. Rheum. Dis. — 2002. — 61 (1). — P. 32-36.
29. Homik J., Cranney A., Shea B. et al. Bisphosphonates for steroid induced osteoporosis // Cochrane Database Syst. Rev. — 2000. — 2. — Art. No.: CD001347.
30. Homik J., Suarez-Almazor M.E. , Shea B. et al. Calcium and vitamin D for corticosteroid-induced osteoporosis // Cochrane Database Syst. Rev. — 2000. — 2. — Art. No.: CD000952.
31. Hooyman J.R., Melton L.J., Nelson A.M. et al. Fractures after rheumatoid arthritis. A population-based study // Arthritis Rheum. — 1984. — 27 (12). — Р. 1353-1361.
32. Huang C., Ross P.D., Yates A.J. et al. Prediction of fracture risk by radiographic absorptiometry and quantitative ultrasound: A prospective study // Calcif. Tissue. Int. — 1998. — 63. — P. 380-384.
33. Hubbard R.B., Smith C.J., Smeeth L. et al. Inhaled corticosteroids and hip fracture: a population-based case-control study // Am. J. Respir. Crit. Care Med. — 2002. — 166 (12), pt. 1. — Р. 1563-1566.
34. Ismail A.A., Cockerill W., Cooper C. Prevalent vertebral deformity predicts incident hip though not distal forearm fracture: results from the European Prospective Osteoporosis Study // Osteoporos Int. — 2001. — 12 (2). — P. 85-90.
35. Ismail A.A., Cooper C., Felsenberg D. et al. Number and type of vertebral deformities: Epidemiological characteristics and relation to back pain and heiqht loss // Osteoporos Int. — 1999. — 9. — P. 206-213.
36. Israel E., Banerjee T.R., Fitzmaurice G.M. et al. Effects of inhaled glucocorticoids on bone density in premenopausal women // N. Engl. J. Med. — 2001. — 345 (13). — Р. 941-947.
37. Kanis J.A., Johansson H., Oden A. et al. A meta-analysis of prior corticosteroid use and fracture risk // J. Bone Miner. Res. — 2004. — 19 (6). — P. 893-899.
38. Kanis J.A. Diagnosis of osteoporosis // Osteoporos Int. — 7. — P. 108-116.
39. Kanis J.A. Diagnosis of osteoporosis and assessment of fracture risk // Lancet. — 2002. — 359. — P. 1929-1936.
40. Kumagai S., Kawano S., Atsumi T. et al. Vertebral fracture and bone mineral density in women receiving high dose glucocorticoids for treatment of autoimmune diseases // J. Rheumatol. — 2005. — 32 (5). — P. 863-9.
41. Lambrinoudaki I., Chan D. T., Lau C. S. et al. Effect of calcitriol on bone mineral density in premenopausal Chinese women taking chronic steroid therapy. A randomized, double blind, placebo controlled study // J. Rheumatol. — 2000. — 27 (7). — P. 1759-1765.
42. Lane N.E. Does alendronate improve bone mineral density in patients with RA treated with glucocorticoids? // Nat. Clin. Pract. Rheumatol. — 2006. — 2 (8). — P. 412-413.
43. Lane N.E., Sanchez S., Modin G.W. et al. Bone mass continues to increase at the hip after parathyroid hormone treatment is discontinued in glucocorticoid-induced osteoporosis: results of a randomized controlled clinical trial // J. Bone Miner. Res. — 2000. — 15 (5). — P. 944-951.
44. Legrand E., Chappard D., Pascaretti C. et al. Bone mineral density and vertebral fractures in men // Osteoporos Int. — 1999. — 10 (4). — P. 265-270.
45. Leidig G., Minne H. W., Sauer P. et al. A study of complaints and their relation to vertebral destruction in patients with osteoporosis // Bone Miner. — 1990. — 8. — P. 217-219.
46. Lems W.F., Jahangier Z.N., Raymakers J.A. Methods to score vertebral deformities in patients with rheumatoid arthritis // British Journal of Rheumatology — 1997. — 36. — P. 220-224.
47. Lewiecki E.M. Review of guidelines for bone mineral density testing and treatment of osteoporosis // Curr. Osteoporos. Rep. — 2005. — 3 (3). — P. 75-83.
48. Lindsay R., Silverman S.L., Cooper C. et al. Risk of new vertebral fracture in the year following a fracture // JAMA. — 2001. — 285. — P. 320-323.
49. Lips P., Cooper C., Agnusdei D. et al. Quality of life in patients with vertebral fractures: validation of the quality of life questionnaire of the European Foundation for Osteoporosis (QUALEFFO) // Osteoporos Int. — 1999. — 10. — P. 150-160.
50. Maghraoui A.E., Rezqi A., Mounach A. et al. Prevalence and risk factors of vertebral fractures in women with rheumatoid arthritis using vertebral fracture assessment // Rheumatology. — 2001. — 40 (12). — Р. 1375-1383.
51. Melton L.J., Lane A.W., Cooper C. et al. Prevalence and incidence of vertebral deformities // Osteoporos Int. — 1993. — 3. — P. 113-119.
52. Melton L.J., Cooper C. Magnitude and impact of osteoporosis and fractures // Osteoporosis. — 2nd edition. — New York: Academic Press, 2001. — 1. — P. 557-567.
53. Melton L.J., Riggs B.L. Osteoporosis: Etiology, diagnosis, and management. — New York: Haven Press, 1988. — P. 133-153.
54. Nampei A., Hashimoto J. Clinical features of fracture with glucocorticoid induced osteoporosis and rheumatoid arthritis: [article in Japanese] // Clin. Calcium. — 2006. — 16 (11). — P. 1866-1870.
55. Neil B.E.D., Krueger E.R., Gangnon E. et al. Lateral vertebral assessment: a valuable technique to detect clinically significant vertebral fractures // Osteoporos. Int. — 2005. — 16. — P. 1513-1518.
56. O’Brien C.A., Jia D., Plotkin L.I. et al. Glucocorticoids Act Directly on Osteoblasts and Osteocytes to Induce Their Apoptosis and Reduce Bone Formation and Strength // Endocrinology. — 2004. — 145 (4). — P. 1835-1841
57. Oelzner P. et al. The 2005 ISCD Official Positions Significance of risk factors for osteoporosis is dependent on gender and menopause in rheumatoid arthritis // Rheumatol Int. — 2008. — 28 (1143). — P. 1150.
58. Orstavik R.E., Haugeberg G., Mowinckel P. et al. Vertebral deformities in rheumatoid arthritis: a comparison with population-based controls // Arch. Intern. Med. — 2004. — 164 (4). — P. 420-425.
59. Orstavik R.E., Haugeberg G., Uhlig T. et al. Quantitative ultrasound and bone mineral density: discriminatory ability in patients with rheumatoid arthritis and controls with and without vertebral deformities // Ann. Rheum. Dis. — 2004. — 63 (8). — Р. 945-951.
60. Parser J.L., Pieper C.F., Branch L.G. Spinal deformity and mobility self-confidence among women with osteoporosis and vertebral fractures et al. // Aging. Gin. Exp. Res. — 1999. — 11. — P. 235-245.
61. Pearson D., Horton B., Green D.J. et al. Vertebral morphometry by DXA: a comparison of supine lateral and decubitus lateral // Journal of Clinical Densitometry. — 2006. — 9 (3). — P. 295-301.
62. Persson L.O., Karlsson J., Bengtsson C. The Swedish SF-36 Health Survey II. Evaluation of clinical validity: results from population studies of elderly and women in Gothenborg // J. Clin. Epidemiol. — 1998. — 51 (11). — P. 1095-1103.
63. Povoroznyuk V.V., Dzerovich N.I., Karasevskaya T.A. Bone mineral density in Ukrainian women of different age // Ann. N. Y. Acad. Sci. — 2007. — Vol. 1119. — Р. 243-252.
64. Ranganathan P. Genetics of bone loss in rheumatoid arthritis — role of vitamin D receptor polymorphisms // Rheumatology (Oxford). — 2009. — 48 (4). — Р. 342-346.
65. Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis: 2001 update. American College of Rheumatology Ad Hoc Committee on Glucocorticoid-Induced Osteoporosis // Arthritis Rheum. — 2001. — 44 (7). — P. 1496-1503.
66. Reid D.M., Hughes R.A., Laan R.F. et al. Efficacy and safety of daily risedronate in the treatment of corticosteroid-induced osteoporosis in men and women: a randomized trial. European Corticosteroid-Induced Osteoporosis Treatment Study // J. Bone Miner. Res. — 2000. — 15 (6). — P. 1006-1013.
67. Richy F., Ethgen O., Bruyere O., Reginster J. Y. Efficacy of alphacalcidol and calcitriol in primary and corticosteroid-induced osteoporosis: a meta-analysis of their effects on bone mineral density and fracture rate // Osteoporos. Int. — 2004. — 15 (4). — Р. 301-310.
68. Ross P.D. Clinical consequences of vertebral fractures // Am. J. Med. — 1997. — 103 (2A). — P. 30-43.
69. Ruf K.M., Johnson N.K., Clifford T., Smith K.M. Risk factors, prevention, and treatment of corticosteroid-induced osteoporosis in adults // Orthopedics. — 2008. — 31 (8). — P. 768-772.
70. Ruyssen-Witrand A., Gossec L., Kolta S. et al. Vertebral dimensions as risk factor of vertebral fracture in osteoporotic patients: a systematic literature review // Osteoporos Int. — 2007. — 18 (9). — P. 1271-1278.
71. Sambrook P.N., Hughes D.R., Nelson A.E. et al. Osteocyte viability with glucocorticoid treatment: relation to histomorphometry // Ann Rheum Dis. — 2003. — 62. — P. 215-1217.
72. Sambrook P.N., Diamond T., Ferris L. et al. Corticosteroid induced osteoporosis. Guidelines for treatment // Aust. Fam. Physician. — 2001. — 30 (8). — P. 793-796.
73. Sambrook P., Nguyen T. Vertebral osteoporosis in rheumatoid arthritis patients: effect of low dose prednisone therapy // Br. J. Rheumatol. — 1992. — 31. — P. 573-574.
74. Sinigaglia L., Nervetti A., Mela Q. et al. A multicenter cross sectional study on bone mineral density in rheumatoid arthritis. Italian Study Group on Bone Mass in Rheumatoid Arthritis // J. Rheumatol. — 2000. — 27 (11). — Р. 2582-2589.
75. Solomon D.H., Kuntz K.M. Should postmenopausal women with rheumatoid arthritis who are starting corticosteroid treatment be screened for osteoporosis? A cost-effectiveness analysis // Arthritis Rheum. — 2000. — 43 (9). — Р. 1967-1975.
76. Staa T.P., Leufkens H.G.M, Cooper C. Does a fracture at one site predict later fractures at other sites? A British cohort study // Osteopoms Int. — 2002. — 13. — P. 624-629.
77. Tatsuno I., Sugiyama T., Suzuki S. et al. Age Dependence of Early Symptomatic Vertebral Fracture with High-Dose Glucocorticoid Treatment for Collagen Vascular Diseases // The Journal of Clinical Endocrinology & Metabolism. — 2009. — 94 (5). — P. 1671-1677.
78. Ton F.N., Gunawardene S.C., Lee H., Neer R.M. Effects of low-dose prednisone on bone metabolism // J. Bone Miner. Res. — 2005. — 20 (3). — Р. 464-470.
79. Van Staa T.P., Geusens P., Pols H.A. et al. A simple score for estimating the long-term risk of fracture in patients using oral glucocorticoids // QJM. — 2005. — 98 (3). — Р. 191-198.
80. Van Staa T.P., Laan R.F., Barton I.P. et al. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy // Arthritis Rheum. — 2003. — 48 (11). — Р. 3224-3229.
81. Van Staa T.P., Laan R.F., Barton I.P. et al. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy // Arthritis. Rheum. — 2003. — 48. — P. 3224-3229.
82. Van Staa T.P., Leufkens H.G., Abenhaim L. et al. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses // Rheumatology (Oxford). — 2000. — 39. — P. 1383-1389.
83. Vokes T.J., Dixon L.B., Favus M.J. Utility of lateral vertebral assessment (LVA) in detecting vertebral fractures // ISCD: Departments of Medicine and Radiology, University of Chicago, Chicago, Illinois, 2002. — P. 2.
84. Vokes T., Bachman D., Baim S. et al. Vertebral Fracture Assessment: The 2005 ISCD Official Positions // J Clin Densitom. — 2006. — 9. — Р. 37-46.
85. Wallach S., Cohen S., Reid D.M. et al. Effects of risedronate treatment on bone density and vertebral fracture in patients on corticosteroid therapy // Calcif. Tissue Int. — 2000. — 67 (4). — P. 277-285.
86. Walsh L.J., Lewis S.A., Wong C.A. et al. The impact of oral corticosteroid use on bone mineral density and vertebral fracture // Am. J. Respir. Crit. Care Med. — 2002. — 166 (5). — Р. 691-695.
87. Walsh L.J., Lewis S.A., Wong C.A. et al. The impact of oral corticosteroid use on bone mineral density and vertebral fracture // Am. J. Respir. Crit. Care. Med. — 2002. — 166. — P. 691-695.
88. Wolinsky-Friedland M. Drug-induced metabolic bone disease // Endocrinol Metab Clin North Am. — 1995. — 24. — P. 395-420.
89. Wong C.A., Walsh L.J., Smith C.J. et al. Inhaled corticosteroid use and bone-mineral density in patients with asthma // Lancet. — 2000. — 355 (9213). — Р. 1399-1403.
90. Wong C.A., Walsh L.J., Smith C.J. et al. Inhaled corticosteroid use and bone-mineral density in patients with asthma // Lancet. — 2000. — 355. — P. 1399-1403.