Газета «Новости медицины и фармации» Антимикробная терапия (343) 2010 (тематический номер)
Вернуться к номеру
Выбор антибактериальной терапии хирургического сепсиса с учетом региональных особенностей роста резистентности его основных возбудителей
Авторы: А.Н. Нестеренко, Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Антибактериальная терапия (АБТ) — основополагающий этиотропный компонент интенсивной терапии (ИТ) тяжелой хирургической инфекции (ХИ) с высоким уровнем летальности (42–60 %) при развитии хирургического сепсиса (ХС), демонстрирующего в современных условиях клинический патоморфоз [1–3, 7–9]. И хотя вклад антибактериальных препаратов (АБП) в снижение летальности больных тяжелой ХИ не превышает 20 %, назначение неадекватной стартовой АБТ приводит к достоверному повышению смертности в 1,5–3 раза [3–5, 12, 13]. Резистентность возбудителя повышает вероятность назначения неадекватной эмпирической АБТ, приводит к увеличению осложнений, сроков, стоимости лечения, риска летального исхода [2, 4, 15].
Эволюционно закономерный рост вирулентности микроорганизмов с селекцией устойчивых к АБП штаммов на фоне ослабления иммунной защиты пациентов объясняет неудовлетворительные результаты лечения тяжелых инфекций, ХС и возводит актуальную проблему в ранг вопросов, представляющих угрозу национальной безопасности.
Цель работы — обоснование выбора рациональной антибактериальной терапии хирургического сепсиса.
Материал и методы
Выполнен эпидемиологический анализ данных микробиологического мониторинга аэробов — возбудителей нозокомиальных инфекций (НИ) с выявлением доминирующих возбудителей тяжелой ХИ и региональных особенностей формирования антибиотикорезистентности возбудителей ХС в многопрофильном 1100-коечном Донецком областном территориальном клиническом медицинском объединении (ДОКТМО) за период 2003–2007 гг. с компьютерной обработкой результатов 5773 микробиологических исследований крови, мочи, отделяемого ран, дренажей по программе EASMM (Expert analytical system of microbiological monitoring) фирмы RANBAXY [3, 8, 9]. Проведен анализ лечения 87 больных (17–73 лет, мужчин — 47, женщин — 40) хирургическим сепсисом вследствие перитонита (28), гнойников брюшной полости (21), забрюшинной флегмоны (8), гнилостного парапроктита (13), флегмоны мягких тканей (17). Диагностика, интенсивная терапия ХС — по рекомендациям SSC [13, 14]. Протокол лечения: хирургическая санация; антибиотики; антисептики; противогрибковые; волемическая, инотропная, респираторная, метаболическая, нутритивная, иммунотропная поддержка; детоксикация. Экстракорпоральную антибактериальную терапию (ЭКАБТ) выполняли 52 пациентам (в т.ч. 29 — по авторской методике), инфузии озонированного 0,9% NaCl (NaClO3) — 49 пациентам [3, 8–11].
Результаты и обсуждение
Спектры возбудителей ХИ значительно отличались как по годам, так и по профилю отделений (табл. 1). Так, во II хирургическом отделении (II ХО), где преобладали пациенты с мезенхимальной ХИ (флегмоны мягких тканей, диабетические флегмоны, гангрены) за исключением 2003 г. грамположительная флора либо равнялась (2004–2005 гг.) доле грамотрицательной, либо превалировала (2006–2007 гг.). В проктологическом — III хирургическом отделении (III ХО) преобладали пациенты с абдоминальной и мезенхимальной гнилостной ХИ со значительным превалированием (за исключением 2004 г.) грамотрицательной флоры.
В 2003–2007 гг. отмечена тенденция к превалированию грамотрицательной флоры по отделениям хирургического профиля (ОХП) при равных/почти равных долях грамотрицательной и грамположительной флоры в целом по всем подразделениям (ВП) ДОКТМО (табл. 1).
В 2003–2007 гг. в ОХП, во ВП среди наиболее актуальных возбудителей НИ, в том числе тяжелой ХИ и ХС, стабильно лидировало грамотрицательное семейство Enterobacteriaceae с безусловным доминированием в III ХО. На 2-е место по высеваемости в ДОКТМО вышел грамположительный род Enterococcus; 3–4-е места делят грамположительный род Staphylococcus, высевавшийся чаще во II ХО, и грамотрицательный P.aeruginosa, сопоставимо часто встречающиеся в ОХП наряду со Staphylococcus (табл. 1).
Уменьшение выделения с 2005 года грибов Candida по сравнению с 2003–2004 гг. можно связать со сформировавшейся в ДОКТМО высокой микологической настороженностью — своевременной профилактикой и лечением кандидоза.
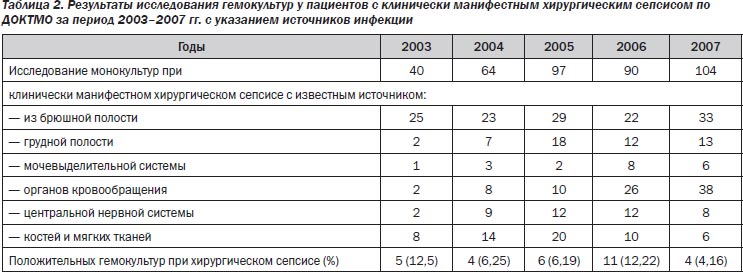
За период 2003–2007 гг. исследовано 1733 гемокультуры, в том числе 395 — у пациентов с клинически манифестным хирургическим сепсисом. Количество положительных гемокультур колебалось в пределах от 4,16 до 12,5 % (табл. 2).
За 2003–2007 гг. в целом по ДОКТМО, и особенно по II–III ХО, всем ОХП отмечен существенный рост резистентности патогенов к АБП, что свидетельствует о селекции полирезистентных штаммов возбудителей НИ, ХИ, ХС (табл. 1).
Стабильно высокая микробицидная активность карбапенема меронема — убедительный довод в пользу его эмпирического использования с целью адекватной стартовой АБТ. Неожиданное возрастание в 2003 г. чувствительности патогенов ВП к гентамицину можно объяснить отказом от его применения в ДОКТМО в предыдущие годы, а последовавшие в 2004–2007 годах стремительное падение его эффективности — аргумент в пользу разработки рациональных схем плановой ротации антибиотиков в отделениях хирургического профиля как перспективного механизма контроля антибиотикорезистентности.
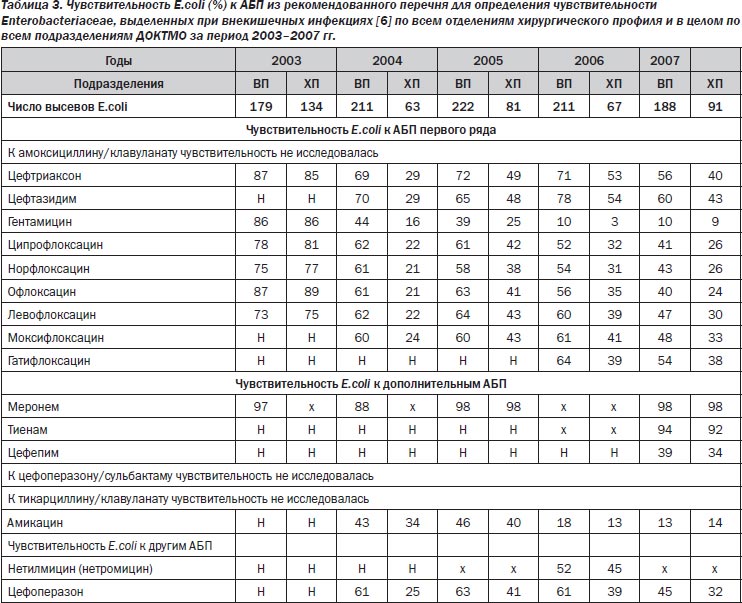
Наиболее часто выделяемый в 2003–2007 гг. из клинических материалов II ХО, отделения проктологии, всех ОХП, всего ДОКТМО грамотрицательный патоген E.coli (семейство Enterobacteriaceae) демонстрировал стабильно высокую чувствительность к меронему при четкой тенденции к снижению эффективности цефалоспоринов II–III, фторхинолонов II–IV, аминогликозидов II–III (табл. 3).
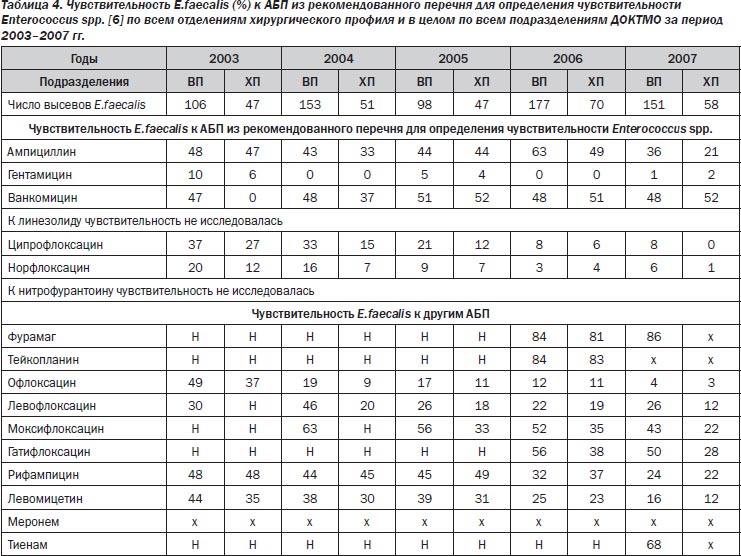
В последние годы во II–III ХО, ОХП и всех подразделениях ДОКТМО отмечена тенденция к увеличению частоты выделения, в том числе из раневого отделяемого, энтерококков, в частности E.faecalis, который демонстрирует значительную резистентность к АБП (табл. 4).
Наиболее эффективными в 2006–2007 гг. были фурамаг, тейкопланин. Чувствительность в 2003–2007 гг. к ванкомицину не превышала 52 % при стабильном падении чувствительности ко всем фторхинолонам. Чаще всего в проктологии, ОХП E.faecalis выделялся из раневого отделяемого в ассоциации с Enterobacteriaceae, Pseudomonas, Candida.
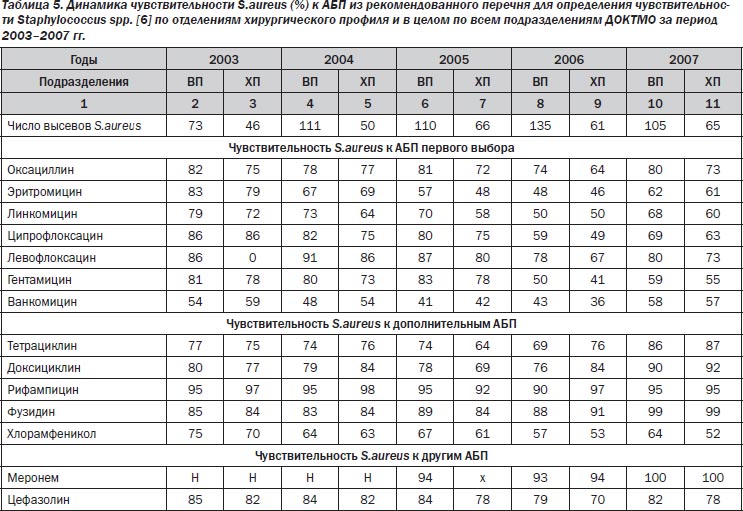
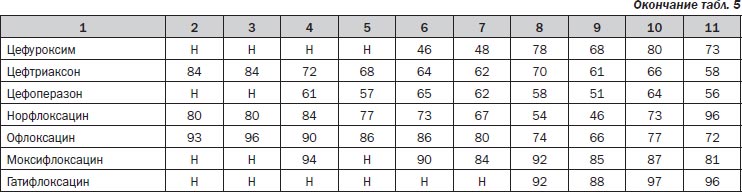
Следующий по частоте выделения в ДОКТМО патоген — грамположительный Staphylococcus aureus — остается одним из наиболее актуальных возбудителей мезенхимальной ХИ. В 2003–2007 гг. Staphylococcus aureus демонстрировал высокую чувствительность к большинству АБП. Количество его оксациллин-резистентных штаммов колебалась в пределах 18–26 % (табл. 5).
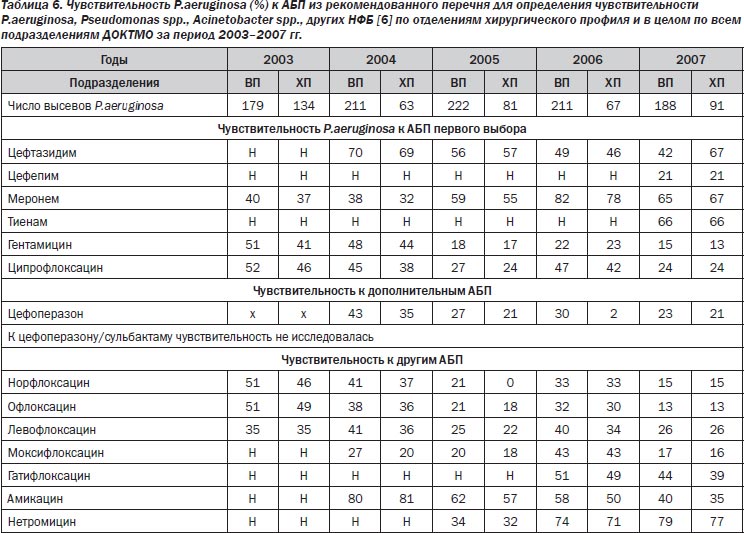
Наиболее эффективными в отношении следующего по частоте выделения в 2003–2007 годах по II–III ХО, ОХП и в целом по ДОКТМО патогена P.aeruginosa были амикацин, цефтазидим, нетромицин. Меронем по отношению к P.aeruginosa демонстрирует стабильный уровень активности на протяжении последних лет, что подтверждает факт низкого потенциала для развития резистентности к данному препарату у P.aeruginosa. Отмечена четкая тенденция к уменьшению эффективности амикацина, гентамицина, фторхинолонов, цефоперазона, низкая активность цефепима (табл. 6).
В условиях участившихся случаев полирезистентности доминирующих патогенов — возбудителей ХС — E.coli, E.faecalis, S.aureus, P.aeruginosa — при неэффективности традиционной АБТ предпочтение отдавали экономически выгодной методике направленного транспорта и создания высокой концентрации АБП в очаге ХИ — ЭКАБТ с использованием меронема, коломицина, цефоперазона/сульбактама, тейкопланина (таргоцида), в том числе по авторской методике при тяжелой септической анемии с использованием в качестве «клеток-контейнеров» АБП отмытых эритроцитов и эритроцитарной массы. При подозрении на анаэробный компонент применяли инфузии NaClO3 и «большую» аутогемоозонотерапию, рассчитывая в том числе на бактерицидный, фунгицидный, вирицидный, детоксицирующий эффекты озона; проводили заместительную иммунотерапию человеческим иммуноглобулином для в/м (в/в) введения, рекомбинантным интерфероном-α2b — лаферобионом [3, 7–11]. Показанием к эмпирической противогрибковой терапии считали кандидурию, дисбактериоз. Использовали флуконазол по ступенчатой схеме.
Таким образом, выявленные путем микробиологического мониторинга региональные особенности динамики этиологической структуры и формирования антибактериальной резистентности возбудителей ХИ во II–III ХО, всех ОХП, в целом в ДОКТМО, приобретенный опыт ИТ хирургического сепсиса позволили обосновать выбор антибактериальной терапии хирургического сепсиса.
Заключение
Эпидемиологический анализ данных мониторинга госпитальной флоры в конкретном хирургическом отделении, регионе позволяет: выделить наиболее вероятных этиологических агентов тяжелой ХИ, ХС; определить уровень приобретенной антибиотикорезистентности; выбрать оптимальный препарат для адекватной стартовой эмпирической и целенаправленной этиотропной терапии тяжелой ХИ, ХС; проводить согласно микробиологической ситуации плановую ротацию антибиотиков в хирургических стационарах.
Для стартовой антибактериальной терапии тяжелой хирургической инфекции и хирургического сепсиса оптимальной следует считать эмпирическую антибактериальную терапию карбапенемами.
Повышение эффективности антибактериальной терапии больных тяжелой ХИ, хирургического сепсиса может быть достигнуто путем включения в комплекс ИТ экстракорпоральной антибактериальной терапии в сочетании с заместительной иммунотерапией препаратами внутривенных и внутримышечных иммуноглобулинов, рекомбинантных интерферонов; инфузий озонированного физиологического раствора, ранней противогрибковой терапией.
1. Абаев Ю.К. Современные особенности хирургической инфекции // Вестн. хир. — 2005. — Т. 164, № 3. — С. 107-111.
2. Гончаров В.Б., Руднов В.А., Черкасов Г.В. и др. Результаты внедрения концепции инфекционной безопасности в ОРИТ нейрохирургического профиля // Журн. интенс. тер. — 2007. — № 4 // Available from: http://www.icj.ru/2007-04-02.html.
3. Гюльмамедов Ф.І., Нестеренко О.М., Гюльмамедов П.Ф. та ін. Сучасні можливості підвищення ефективності лікування хірургічного сепсису // Шпитальна хірургія. — 2005. — № 4. — С. 28-31.
4. Козлов Р.С., Стецюк О.У., Андреева И.В. Современные тенденции антибиотикорезистентности возбудителей нозокомиальных инфекций в ОРИТ России: что нас ждет дальше? // Журн. интенс. тер. — 2007. — № 4 // Available from: http://www.icj.ru/2007-04-01.html
5. Кондратенко П.Г., Соболев В.В. Хирургическая инфекция. Практическое руководство. — Донецк, 2007. — 512 с.
6. Наказ МОЗ України від 5 квітня 2007 р. № 167 «Про затвердження методичних вказівок «Визначення чутливості мікроорганізмів до антибактеріальних препаратів». — 4 с.
7. Нестеренко А.Н. Клинико-морфологический анализ танатогенеза хирургического сепсиса // Патологія. — 2005. — Т. 2, № 2. — С. 53-55.
8. Нестеренко А.Н. Принципы противомикробной защиты в интенсивной терапии тяжелой хирургической инфекции // Біль, знебол. і інтенс. тер. — 2006. — № 1(д). — С. 56-60.
9. Нестеренко А.Н. Обоснование тактики антибактериальной терапии хирургического сепсиса в колопроктологии с учетом этиологической специфики и роста антибиотикорезистентности патогенов // Материали II з’їзду колопроктологів України з міжнародною участю (1–2 листопада 2006 року). — К.: Медицина, 2006. — С. 484-491.
10. Пат. UA 15121 A 61 K 31/00. Спосіб лікування тяжкого сепсису, ускладненого анемією: Деклараційний патент на корисну модель UA 15121 A 61 K 31/00. Нестеренко О.М. (Україна). — № заявки; Заявл. 98.12.2005; Опубл. 15.06.2006. Бюл. № 6.
11. Целенаправленная иммунокоррекция в интенсивной терапии критических состояний в хирургии: Метод. рек. МЗ Украины / Черний В.И., Нестеренко А.Н., Гюльмамедов Ф.И., Гюльмамедов П.Ф. — 2-е изд., перераб. и дополн. — Донецк, 2004. — 42 с.
12. Яковлев С.В. Современные проблемы антибактериальной терапии госпитальных инфекций: «горячие точки» резистентности // Укр. журн. екстрем. мед. ім. Г.О. Можаєва. — 2005. — Т. 6, № 1. — С. 30-37.
13. Dellinger R.Rh., Carlet J.M., Mazur H. et al. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock // Crit. Care Med. — 2004. — Vol. 32, № 3. — P. 858- 873.
14. Levy M.M., Marshall J.C., Fink M.P. et al. 2001 SCCM/ESICM/ ACCP/ ATC/ SIS International Sepsis Definitions Conference // Crit. Care Med. — 2003. — Vol. 31, № 4. — P. 1250-1256.
15. WHO Global Strategy for Containment of Antimicrobial Resistance / World Health Organization, 2001 // Available from: http://www.who.int/emc/amrpdfs/WHO-Global-Strategy-English.pdf.