Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Значение антагонистов рецепторов ангиотензина-2 в лечении больных с сердечной недостаточностью Результаты исследования HEAAL: Effects of High-dose Versus Low-dose Losartan on Clinical Outcomes in Patients with Heart Failure
Авторы: А.Е. Березин, д.м.н., Запорожский государственный медицинский университет
Версия для печати
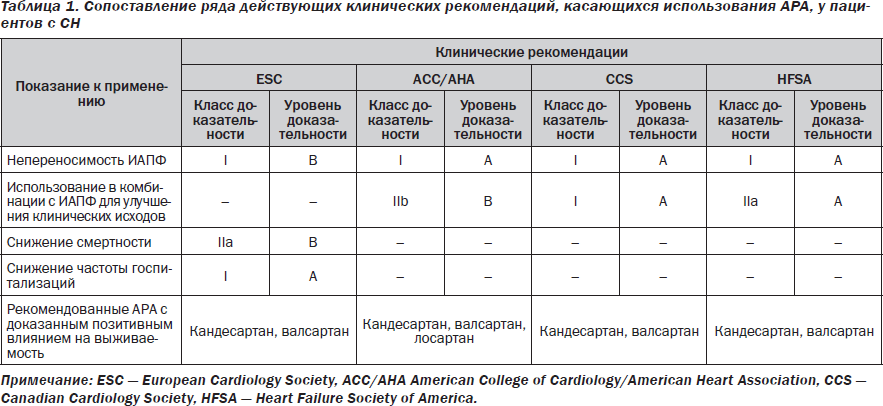
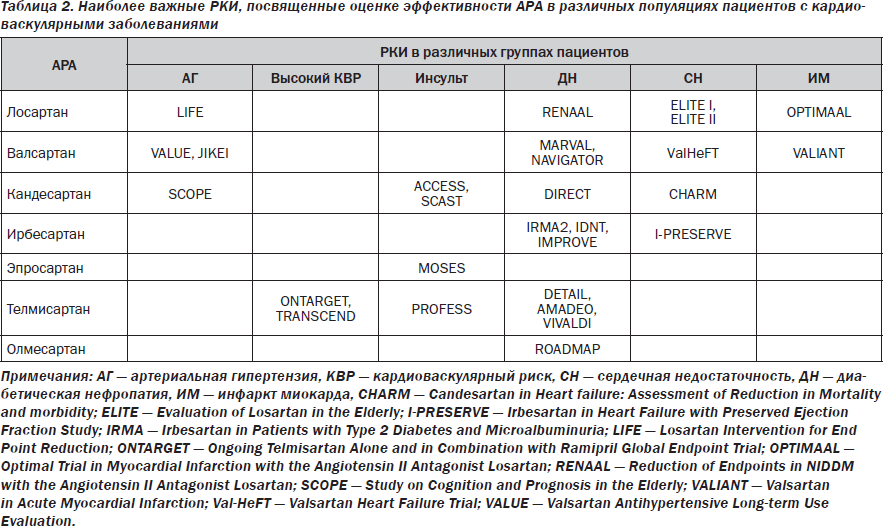
На протяжении последнего десятилетия роль антагонистов рецепторов ангиотензина-2 (АРА) в лечении пациентов с сердечной недостаточностью (СН) неоднократно подвергалась весьма значительным и иногда полярным изменениям. Казалось, что эра ингибиторов АПФ (ИАПФ), начавшаяся с середины 80-х годов прошлого столетия, не оставила шансов АРА для доминирования в программах профилактики и лечения СН. Несмотря на доказанный сопоставимый с ИАПФ терапевтический антигипертензивный потенциал и высокую безопасность, АРА оказались менее эффективными в улучшении клинических исходов и модуляции кардиоваскулярного риска в когортах больных как с асимптомной, так и с манифестной СН [2, 16]. В связи с этим далеко не все клинические рекомендации допускают использование АРА по тем же показаниям, что и ИАПФ. Так, только рекомендации ECS в наименьшей мере ограничивают область применения АРА у пациентов с СН, сохраняя за ними возможность использования с целью улучшения выживаемости и редукции частоты повторных госпитализаций, связанных с прогрессированием СН (табл. 1). Кроме того, список рекомендованных АРА по показанию СН лимитирован в основном валсартаном, кандесартаном и лосартаном. Это связано с ограничением объема доказательства позитивного влияния АРА в отношении твердых клинических конечных точек. Фактически большинство рандомизированных клинических исследований (РКИ), в которых в качестве основной стратегии лечения выступали АРА, были посвящены диабетической нефропатии, превенции инсульта и артериальной гипертензии (табл. 2). Лишь в немногих проектах проводилось сопоставление эффективности и безопасности АРА по сравнению с плацебо или другой стратегией лечения у пациентов с документированной СН, причем чаще всего с редуцированной фракцией выброса (ФВ) левого желудочка (ЛЖ). В связи с этим любые новые данные, касающиеся расширения диапазона терапевтического потенциала АРА в этой группе пациентов, представляют значительный интерес.
В ранних исследованиях АРА в средних терапевтических дозах уступали ИАПФ по способности повышать вероятность выживания пациентов и приводить к редукции величины кардиоваскулярной смертности.
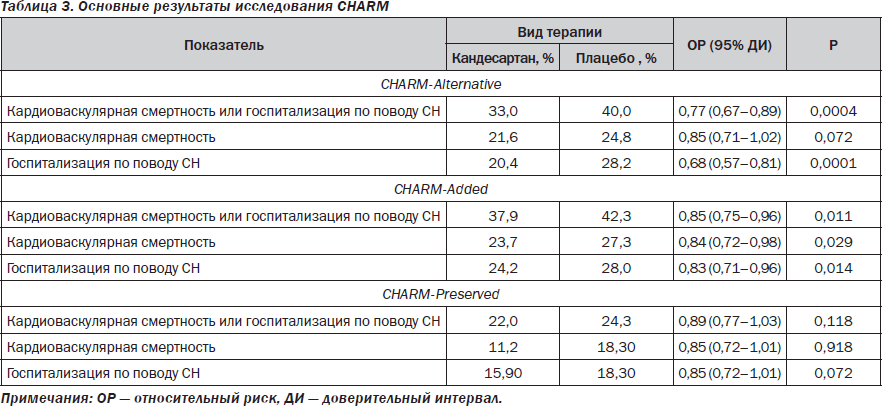
Так, завершившаяся программа CHARM (табл. 3) убедительно продемонстрировала, что АРА кандесартан в качестве альтернативы ИАПФ (ветвь CHARM-Alternative) или добавленный как компонент стратегии лечения (ветвь CHARM-Added) у пациентов с манифестной СН независимо от возраста, пола, длительности заболевания, наличия сахарного диабета, величины фракции выброса левого желудочка, сопутствующего применения бета-адреноблокаторов не оказывает влияния на твердые конечные точки: общую (ОР = 0,88; 95% ДИ = 0,79–0,98, Р = 0,018) и кардиоваскулярную (ОР = 0,84; 95% ДИ = 0,75–0,95; Р = 0,005) смертность [3, 15].
Вместе с тем использование АРА благоприятно отражалось только на частоте возникновения вторичных конечных точек исследования: повторных госпитализациях вследствие прогрессирования СН (Р < 0,0001), а также ряде комбинированных показателей, включающих в себя кардиоваскулярную смерть, инсульт, инфаркт миокарда (ИМ), потребность в проведении реваскуляризационных процедур (Р < 0,0001). Кроме того, в когорте пациентов с сохраненной ФВ кандесартан способствовал редукции относительного риска возникновения новых случаев сахарного диабета (ОР = 0,60; 95% ДИ = 0,41–0,86; Р = 0,005), а также предотвращал увеличение потребности в повторных случаях госпитализации вследствие прогрессирования СН (Р = 0,051) [15]. Аналогичный результат был получен и при сопоставлении эффективности валсартана и каптоприла в исследовании VALIANT. Сюрпризом явилось некоторое повышение частоты встречаемости инфаркта миокарда в группе пациентов, получавших валсартан. С другой стороны, в популяционном исследовании UMPIRE частота манифестации инфаркта миокарда в группе пациентов, леченных валсартаном, была даже ниже, чем у больных, получавших ИАПФ (ОР = 0,89 (95% доверительный интервал = 0,76–1,04)) [19]. Кроме того, в контролированном рандомизированном исследовании VALUE (Valsartan Antihypertensive Long-term Use Evaluation), формально не посвященном изучению эффективности АРА в когорте пациентов с СН и основанном на привлечении 15 300 больных АГ старше 50 лет с одним и более фактором риска возникновения кардиоваскулярных событий, валсартан продемонстрировал реальные преимущества перед амлодипином только по способности редуцировать новые случаи сахарного диабета и СН. Частота возникновения кардиоваскулярной смертности в обеих группах пациентов существенно не различалась [6]. Только в исследовании Val-HeFT удалось продемонстрировать благоприятное влияние АРА валсартана в отношении первичной клинической твердой конечной точки (комбинированный показатель общей смертности + госпитализации вследствие прогрессирования СН + внезапная смерть с успешной реанимацией + потребность в интенсивной инфузионной терапии на протяжении более 4 часов, связанной с прогрессированием СН) по сравнению с плацебо, тогда как применение комбинации АРА и ИАПФ не сопровождалось существенным регрессированием кардиоваскулярной смертности [10].
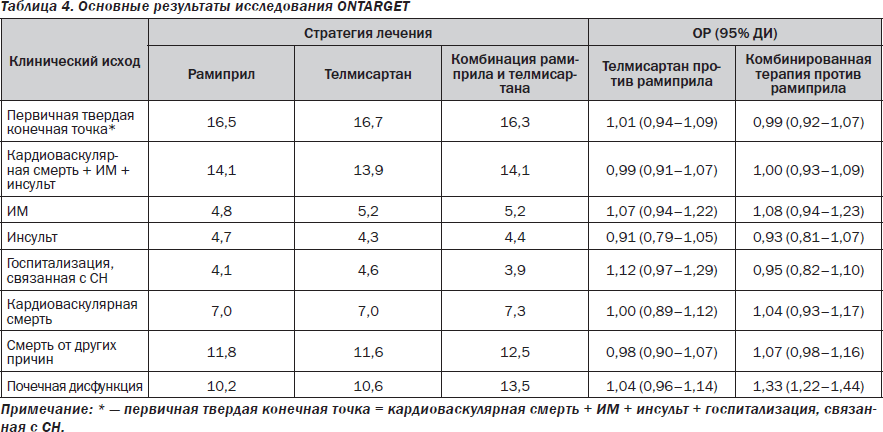
Поскольку предполагалось, что достижение более полной блокады ренин-ангиотензиновой системы позволит повысить эффективность лечения и снизить вероятность наступления неблагоприятных клинических исходов в когорте лиц с документированной СН, то в качестве эффективных стратегий предлагалось использовать комбинацию различных нейрогуморальных блокаторов, причем желательно в максимально переносимых дозах. Вместе с тем, если использование ИАПФ в ранжированных дозах способствовало улучшению выживаемости пациентов [1, 4, 12–14, 18], то для АРА этот эффект установлен не был [8]. Более того, после того как использование ИАПФ, бета-адреноблокаторов и антагонистов рецепторов альдостерона вошло в стандарты лечения больных с СН, АРА стали рассматриваться как «еще один из нейрогуморальных блокаторов», не оказывающих существенного влияния на частоту возникновения твердых конечных точек, но в значительной мере повышающих стоимость лечения. Если до завершения исследования ONTARGET еще и существовали какие-либо иллюзии, касающиеся возможности достижения более высокой эффективности в отношении редукции кардиоваскулярного риска при применении комбинированной терапии ИАПФ + АРА, основанные на гипотетическом преимуществе глубокой блокады РАС, то после опубликования результатов этого исследования сама идея «двойной» блокады стала подвергаться ревизии [17]. Подобная точка зрения была основана не только на отсутствии доказательств преимуществ применения комбинации двух блокаторов РАС перед монотерапией каждым из них, но и на свидетельствах существенного ухудшения переносимости комбинации АРА и ИАПФ (табл. 4).
Оказалось, что в когорте пациентов, в лечении которых использовались ИАПФ и АРА, прогрессивно возрастал риск терминальной почечной дисфункции. Для больных с СН этот вывод фактически означал, что возможный риск подобного назначения может преобладать над пользой. В связи с этим реальным показанием к применению АРА фактически остались все клинические ситуации, непосредственно связанные с плохой переносимостью ИАПФ или желанием пациента принимать первые. Формальное основание для внедрения АРА в стратегию лечения СН, связанное с дополнительной редукцией риска повторных госпитализаций, нивелировалось возрастающими экономическими затратами для проведения подобной терапии.
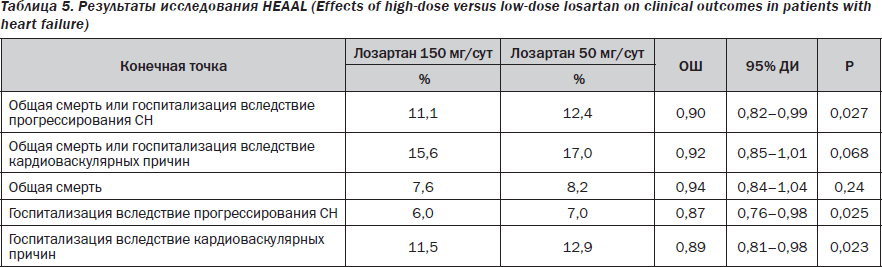
В связи с этим появление в ноябрьском (2009 года) номере журнала Lancet доказательств существования дозозависимого влияния АРА лосартана на выживаемость в когорте пациентов с СН, продемонстрированных в ходе проведения рандомизированного клинического испытания HEAAL (Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure), было воспринято с энтузиазмом [7]. В испытании приняли участие 1927 больных со II–IV ФК СН (ФВ менее 40 %), интолерантных к ИАПФ, которые были распределены в две группы в зависимости от использованной суточной дозы лосартана: 150 мг/сут или 50 мг/сут. Кроме того, 72 % в обеих группах наблюдения получали бета-адреноблокаторы, 38 % — антагонисты рецепторов альдостерона, 32 % — антиагреганты, 11 % — блокаторы кальциевых каналов, 42 % — сердечные гликозиды, 76 % — диуретики и 39 % — статины [7, 9].
Исследователи установили, что на протяжении 4,7 года наблюдения за пациентами лосартан в относительно высокой суточной дозе (150 мг/сут) имел достоверные преимущества перед использованием в более низкой дозе (50 мг/сут) по способности редуцировать первичную твердую комбинированную конечную точку «смерть от всех причин или госпитализация в связи с прогрессированием СН» (ОШ = 0,90, 95% ДИ = 0,82–0,99; p = 0,027) (табл. 5). Причем при раздельном анализе частоты встречаемости двух первичных конечных точек достоверные различия между группами больных сохранялись только для показателя «потребность в госпитализации» (ОР = 0,94, 95% ДИ = 0,84–1,04; p = 0,24 и ОР = 0,87 95% ДИ = 0,76–0,98; p = 0,025 соответственно). Важно, что такие негативные побочные эффекты, как почечная дисфункция (n = 454 против n = 317), артериальная гипотензия (n = 203 против n = 145), гиперкалиемия (n = 195 против n = 131) фактически сопоставимо регистрировались в обеих группах пациентов и не оказывали влияния на частоту отказов от лечения. Исследователи пришли к заключению о существовании у АРА лосартана дозозависимого влияния на выживаемость пациентов с манифестной СН и редуцированной ФВ ЛЖ при условии, что препарат не был добавлен к ИАПФ [7].
Необходимо отметить, что фактически в этом испытании большинство пациентов получали как минимум двойную нейрогуморальную блокаду с использованием АРА и бета-адреноблокатора. Причем исследователи отметили, что частота применения последних в РКИ HEAAL (72 %) была одна из самых высоких среди испытаний подобного рода. Так, в РКИ ELITE II подобный показатель составил 22 % [16], в РКИ Val-HeFT — 38 % [10], а в CHARM-Alternative и CHARM-Added по 55 % [3] соответственно. В связи с этим после получения результатов РКИ HEAAL совершенно не ясно, какая комбинация все же предпочтительнее: ИАПФ + бета-адреноблокаторы или АРА + бета-адреноблокаторы. Кроме того, остается дискутабельным принципиальный вопрос о сопоставимости рекомендованных доз ИАПФ и высоких доз АРА, о которых не упоминается в действующем консенсуальном соглашении по лечению пациентов с СН. С другой стороны, в преддверии завершения исследований, посвященных изучению эффективности прямых ингибиторов ренина (ПИР) у больных с дисфункцией ЛЖ: ATMOSPHERE (Aliskiren Trial to Minimise OutcomeS in Patients with HEart FailurE), ASTRONAUT (Aliskiren Trial on Acute Heart Failure Outcomes) [11] возникает больше вопросов, чем ответов. Если указанные РКИ будут благоприятны для ПИР, как это повлияет на возможность их применения в комбинации с бета-адреноблокаторами, ИАПФ или АРА и потребует ли это пересмотра действующих клинических рекомендаций?
Фактически можно констатировать, что недавно опубликованные результаты РКИ HEAAL существенным образом не повлияют на представления об оптимальном лечении пациентов с манифестной СН и редуцированной ФВ ЛЖ. Исключение будут составлять только те пациенты, которые по каким-либо причинам не смогут принимать ИАПФ, для которых АРА и так резервированы как препараты второй линии. Вероятно, необходимы дополнительные исследования в этом направлении для решения вопроса не столько об оптимальной комбинации лекарственных средств, сколько о сопоставимости использованных дозировок рекомендованных нейрогуморальных блокаторов, оказывающих благоприятное влияние на выживаемость пациентов с СН.
1. Brunner-La Rocca H.P., Weilenmann D., Kiowski W., Maly F.E., Candinas R., Follath F. Within-patient comparison of effects of different dosages of enalapril on functional capacity and neurohormone levels in patients with chronic heart failure // Am. Heart J. — 1999 — 138. — 654-662.
2. Dickstein K., Kjekshus J. and the OPTIMAAL Steering Committee for the OPTIMAAL Study Group. Effects of losartan and captopril on mortality and morbidity in high-risk patients after acute myocardial infarction: the OPTIMAAL randomised trial // Lancet. — 2002. — 360. — 752-760.
3. Granger C.B., McMurray J.J., Yusuf S. et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial // Lancet. — 2003. — 326. — 772-776.
4. Gullestad L., Aukrust P., Ueland T. et al. Effect of high- versus low-dose angiotensin converting enzyme inhibition on cytokine levels in chronic heart failure // J. Am. Coll Cardiol. — 1999. — 34. — 2061-2067.
5. Hunt S.A., Abraham W.T., Chin M.H., Feldman A.M., Francis G.S., Ganiats T.G. et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure): developed in collaboration with the American College of Chest Physicians and the International Society for Heart and Lung Transplantation: endorsed by the Heart Rhythm Society // Circulation. — 2005. — 112. — e154-e235.
6. Julius S., Kjeldsen S.E., Weber M., Brunner H.R., Ekman S., Hansson L., Hua T., Laragh J., McInnes G.T., Mitchell L., Plat F., Schork A., Smith B., Zanchetti A. VALUE trial group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial // Lancet. — 2004. — 363. — 2022-2031.
7. Konstam M.A., Neaton J.D., Dickstein K. et al, for the HEAAL Investigators. Effects of high-dose versus low-dose losartan on clinical outcomes in patients with heart failure (HEAAL study): a randomised, double-blind trial // Lancet. — 2009. — Рublished online Nov 17. DOI:10.1016/S0140-6736(09) 61913-9.
8. Konstam M.A., Neaton J.D., Poole-Wilson P.A. et al. Comparison of losartan and captopril on heart failure-related outcomes and symptoms from the losartan heart failure survival study (ELITE II) // Am. Heart J. — 2005. — 150. — 123-131.
9. Konstam M.A., Poole-Wilson P.A., Dickstein K. et al. Design of the Heart failure Endpoint evaluation of AII-Antagonist Losartan (HEAAL) study in patients intolerant to ACE-inhibitor // Eur. J. Heart Fail. — 2008. — 10. — 899-906.
10. Krum H., Carson P., Farsang C. et al. Effect of valsartan added to background ACE inhibitor therapy in patients with heart failure: results from Val-HeFT // Eur. J. Heart Fail. — 2004. — 6. — 937-945.
11. Krum Н. Role of renin in heart failure and therapeutic potential of direct renin inhibition // Renin report. Issue 12 September 2008.
12. Nanas J.N., Alexopoulos G., Anastasiou-Nana M.I. et al., for the High Enalapril Dose Study Group. Outcome of patients with congestive heart failure treated with standard versus high doses of enalapril: a multicenter study // J. Am. Coll. Cardiol. — 2000. — 36. — 2090-2095.
13. Pacher R., Stanek B., Globits S. et al. Effects of two different enalapril dosages on clinical, haemodynamic and neurohumoral response of patients with severe congestive heart failure // Eur. Heart J. — 1996. — 17. — 1223-1232.
14. Packer M., Poole-Wilson P.A., Armstrong P.W. et al. Оn behalf of the ATLAS Study Group. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure // Circulation. — 1999. — 100. — 2312-2318.
15. Pfeffer M.A., Swedberg K., Granger C.B. et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme // Lancet. — 2003. — 362. — 759-766.
16. Pitt B., Poole-Wilson P.A., Segal R. et al., on behalf of the ELITE II investigators. Effect of losartan compared with captopril on mortality in patients with symptomatic heart failure: randomised trial — the Losartan Heart Failure Survival Study ELITE II // Lancet. — 2000. — 355. — 1582-1587.
17. Teo K., Yusuf S., Sleight P., Anderson C., Mookadam F., Ramos B. et al. Rationale, design, and baseline characteristics of 2 large, simple, randomized trials evaluating telmisartan, ramipril, and their combination in high-risk patients: the Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial/Telmisartan Randomized Assessment Study in ACE Intolerant Subjects with Cardiovascular Disease (ONTARGET/TRANSCEND) trials // Am. Heart J. — 2004. — 148. — 52-61.
18. The NETWORK Investigators. Clinical outcome with enalapril in symptomatic chronic heart failure; a dose comparison // Eur. Heart J. — 1998. — 19. — 481-489.
19. Verma S., Mamdani M.M., Al-Omran M. et al. Angiotensin receptor blockers vs angiotensin converting enzyme inhibitors and acute coronary syndrome outcomes in elderly patients: a population-based cohort study (UMPIRE study results) // J. Am. Soc. Hypertens. — 2007. — 1. — 286-294.