Газета «Новости медицины и фармации» Неврология (339) 2010 (тематический номер)
Вернуться к номеру
нейропатическая боль: взгляд невролога
Авторы: О.Г. Морозова, А.А. Ярошевский, Кафедра рефлексотерапии, ХМАПО
Версия для печати
Топ-топ — лошадка моя.
Вижу себя на картине —
В просторе летних лугов.
Басё
Важнейшей причиной обращения пациентов за медицинской помощью является боль. Она сопутствует большинству заболеваний и патологических состояний.
К сожалению, сегодня еще существует стереотипное представление о боли как о симптоме какой-либо болезни. Такое отношение справедливо только к острой боли, которая возникает при травме, воспалении или ишемии и представляет собой сигнал о повреждении тканей организма. Однако у многих пациентов продолжительность боли превышает ее сигнальную функцию и боль из сигнального фактора превращается в повреждающий, вызывая длительное страдание.
В последние 30–40 лет отмечается неуклонный рост хронических болевых синдромов в общей структуре заболеваемости. Распространение хронической боли в обществе приняло характер эпидемии и составляет, по оценкам разных авторов, от 15 до 70 %. Большая распространенность болевых синдромов оборачивается значительными материальными, социальными и нравственными потерями, негативным образом влияя на качество жизни человека.
Для адекватной борьбы с болью в структуре здравоохранения многих стран значительное место занимают многопрофильные противоболевые клиники и центры, в задачи которых входят оказание специализированной противоболевой помощи пациентам с болевыми синдромами и подготовка специалистов по терапии боли. Например, в США в настоящее время насчитывается около 4000 противоболевых клиник.
Так чем же является боль? Адаптивной реакцией организма, сигналом тревоги или самостоятельным заболеванием? С одной стороны, боль — приспособительная реакция, важнейший защитный механизм, обеспечивающий выживание, обучение и адаптацию живых организмов к изменяющимся условиям внешней среды. Однако интенсивная острая либо хроническая боль сама становится мощным патогенным фактором, приводящим к значительному ухудшению качества жизни пациента.
Международная ассоциация по изучению боли дает ей следующее определение (Merskey, Bogduk, 1994): «Боль — неприятное ощущение и эмоциональное переживание, ассоциированное с имеющимся или потенциальным повреждением тканей, или же состояние, описываемое больным в терминах такого повреждения и определяемое сенсорной информацией, аффективными реакциями и когнитивной деятельностью».
Разновидности боли
Существует несколько классификаций, учитывающих разновидности боли.
По временному признаку различают транзиторную, острую и хроническую боль.
Транзиторная боль возникает в результате активации ноцицептивных рецепторов кожи или других тканей при отсутствии значимого повреждения и существует для защиты человека от угрозы физического повреждения факторами внешней среды.
Острая боль — необходимый приспособительный сигнал, который не только информирует о тканевом повреждении, но и вызывает рефлекторные и поведенческие реакции, позволяющие свести повреждающее воздействие к минимуму. Так, острая боль в суставе предупреждает о развитии воспаления, побуждает ограничить или изменить траекторию движения, чтобы не травмировать поврежденный сустав. Острая боль в спине предупреждает о повреждении опорно- двигательного аппарата, побуждает уменьшить физическую нагрузку и принять позу, облегчающую боль. Таким образом, острая боль и вызванные ею изменения поведения необходимы для скорейшего выздоровления. Длительность острой боли ограничивается временем восстановления поврежденных тканей. Таким образом, транзиторная и острая боль являются важнейшим защитным механизмом, обеспечивающим выживание, обучение и адаптацию живых организмов к изменяющимся условиям внешней среды.
Хроническая боль — сильная, продолжительная, истощающая, причиняющая страдания больному (Атаман А.В., 2000).
Хронической болью, согласно определению Международной ассоциации по изучению боли, является «...боль, которая продолжается сверх нормального периода заживления». Наиболее приемлемым сроком для оценки боли как хронической считается ее продолжительность более 3 месяцев (Merskey H.M., Bogduk N., 1994).
Для хронического болевого синдрома, как правило, характерно отсутствие прямой связи с органической патологией, либо эта связь имеет неясный, неопределенный характер. Боль, однажды возникнув вследствие какого-либо повреждения, приводит к серьезным нарушениям в системе регуляции болевой чувствительности, вызывает психологические расстройства, формирует особую форму болевого поведения, которое будет сохраняться даже при устранении первоначальной пусковой причины боли.
Хроническая боль является патологической болью, приобретшей «надорганный» характер, т.е. самостоятельным хроническим заболеванием. Она не выполняет защитной, обучающей или приспособительной функции, а лишь приносит страдания и снижает качество жизни. Примером такой боли в неврологической практике может быть боль в спине, которая не проходит после восстановления нормальной биомеханики позвоночника и нормальной рентгенологической картины.
Хроническая боль, независимо от первоначально вызвавшей ее причины, является следствием развертывания в периферической и центральной нерв-ной системе в ответ на длительную болевую стимуляцию ряда последовательных изменений, постепенно приобретающих характер типового патологического процесса. Эти изменения состоят из следующих основных этапов (Кукушкин М.Л., Решетняк В.К., 1997; Крыжановский Г.Н., 2002; Borsook D., 1997):
1. Усиление потока болевой импульсации с периферии вследствие повышенного высвобождения тканевых и плазменных алгогенов (гистамин, серотонин, простациклины, лейкотриены, цитокины, брадикинин и др.) и развитие периферической сенситизации, проявляющейся первичной гипералгезией и аллодинией.
2. Возникновение антидромной стимуляции и развитие в месте поражения нейрогенного воспаления с высвобождением нейрогенных алгогенов и нейротрофических факторов (субстанция Р, кальцитонин-ген-родственный пептид, фактор роста нерва и др.), способствующих усилению периферической сенситизации и потока болевых импульсов в центральную нервную систему.
3. Активация NMDA-рецепторов нейронов задних рогов спинного мозга, повышенное высвобождение в синапсах специфических нейромедиаторов и нейромодуляторов (глутамат, ионы кальция, окись азота, субстанция Р, нейрокинин-1, c-fos онкогенный протеин и др.), развитие центральной сенситизации с последующим истощением и гибелью нейронов, развитие зон вторичной гипералгезии.
4. Ослабление и дезинтеграция естественной антиноцицептивной системы, развитие опиатной толерантности.
5. Образование в дорсальных рогах спинного мозга и других отделах центральной нервной системы агрегатов гиперактивных нейронов с ослабленным тормозным контролем — ГПУВ.
6. Формирование патологической алгической системы (ПАС), включающей различные уровни центральной нервной системы и определяющей течение и характер всех компонентов патологической боли: болевой перцепции, страдания и болевого поведения.
Клиническая структура хронического болевого синдрома гетерогенна и часто представляет собой сочетание скелетно-мышечной боли (ноцицептивной), нейропатической боли и боли психологической природы. Болевой синдром в данном случае трансформируется из симптома, отражающего повреждение тканей или структур нервной системы, в самостоятельную форму болезни, патогенез которой включает не только механизмы повышения возбудимости ноцицептивных нейронов, но и формирование особых патологических интеграций в структурах, осуществляющих регуляцию болевой чувствительности и развитие психологических нарушений, искажающих конечное восприятие боли.
Таким образом, хроническую боль определяет не только временной фактор (длительность боли свыше 3 месяцев). Эта боль отрывается от первопричины и становится самостоятельной болезнью, связанной с нарушением деятельности систем, осуществляющих контроль над болевой чувствительностью.
Процесс формирования хронической боли начинается с начала ее возникновения. Чем длительнее и интенсивнее боль в каком-либо участке тела, тем сильнее растормаживается тот отдел нервной системы, который контролирует данный участок. Каждый новый приступ боли облегчает дорогу для следующего болевого пароксизма. Если в начале заболевания боль в спине возникает, к примеру, при подъеме тяжести больше 50 кг, то по мере развития болезни порог снижается до 10, потом до 3 кг, а вскоре обострения боли провоцируются уже просто неловким движением или эмоциональным стрессом.
Среди хронических болевых синдромов наиболее распространены боли в спине, головные боли (хроническая головная боль напряжения), скелетно-мышечные боли (в том числе фибромиалгия), боли у онкологических больных, нейропатические боли.
Для клиницистов наиболее приемлемой является патофизиологическая (патогенетическая) классификация, которая в том числе дает возможность дифференцированно подходить к терапии боли. Потребность в новом взгляде на боль возникла из-за того, что болевые синдромы оказались по-разному чувствительны к разным формам лекарственной терапии. Врачи столкнулись с ситуацией, при которой идентификация и устранение повреждения не сопровождаются исчезновением болевого синдрома. Благодаря наличию этой терапевтической проблемы и возникло деление болевых синдромов на две группы: ноцицептивные и нейропатические.
Оказалось, что боли, которые лечатся нестероидными противовоспалительными препаратами (НПВП) и анальгетиками, — это боли, обусловленные раздражением болевых рецепторов — ноцицепторов, которые расположены на коже, в мышцах, связках и во внутренних органах. Это виды боли, при которых есть повреждение ткани: ожог, травма, воспаление, растяжение.
Но есть вторая категория симптомов, которая не поддается терапии этими средствами. Болевые синдромы этой группы, при которых боли связаны не с раздражением рецепторов, а с поражением нервной системы, назвали нейропатическими.
Таким образом, с точки зрения патогенеза различают ноцицептивную и нейропатическую боль. Ноцицептивная боль возникает при воздействии повреждающего фактора (механического, термического, химического) на болевые рецепторы, в том числе в случае местного воспалительного процесса. Интенсивность болевого ощущения определяется соотношением активности ноцицептивной (болевой) и антиноцицептивной (противоболевой) систем. При этом проводящие пути и отделы центральной нервной системы не вовлекаются в патологический процесс, и по мере уменьшения раздражения рецепторов боль затихает. Ноцицептивная боль чаще бывает острой. Нейропатическая боль возникает при органическом поражении периферической (нервы, корешки, сплетения) или центральной (зад-ние рога и столбы спинного мозга, ствол, таламус, большие полушария головного мозга) нервной системы, при этом болевые ощущения могут возникать вне связи с раздражением рецепторного аппарата.
Патофизиология ноцицептивной боли: повышение возбудимости ноцицепторов — сенситизация. Патофизиологической же основой нейропатической боли является нарушение генерации потенциалов в поврежденном нерве и тормозного контроля возбудимости ноцицептивных нейронов в центральных структурах мозга. Одним из основных механизмов невропатической боли служит повышение возбудимости мембран нервных волокон, что связано с увеличением числа активных натриевых каналов.
Особенности нейропатической боли
Нейропатическая боль имеет свои характерные отличия. Прежде всего это комплекс специфических чувствительных расстройств, которые можно разделить на две группы. С одной стороны, это позитивные симптомы (спонтанная боль, аллодиния, гипералгезия, дизестезии, парестезии), с другой — негативные симптомы (гипестезия, гипалгезия). Для нейропатической боли характерна комбинация сенсорных позитивных и негативных симптомов, которая может меняться у одного и того же больного в течение болезни.
Характерным для нейропатического вида боли является феномен аллодинии. Аллодиния — это появление боли в ответ на стимул, который в нормальных условиях не вызывает боли. В таких случаях больные испытывают сильные боли при малейшем прикосновении, иногда даже при дуновении ветра. Различают температурную (действие температурного стимула) и механическую (действие механического стимула) аллодинию. Механическая аллодиния подразделяется на статическую, которая появляется при давлении на фиксированную точку кожного покрова, и динамическую, возникающую при движущихся стимулах, например при легком раздражении кожи кисточкой или пальцем.
Характерной является гипералгезия — появление выраженного болевого ощущения при нанесении легкого ноцицептивного раздражения (незначительное воздействие на болевые рецепторы). Нанесение повторных ноцицептивных стимулов, особенно высокой интенсивности, может вызвать резкое, взрывчатое болевое ощущение, обычно плохо локализованное, боль при этом может иметь жгучий оттенок, длительно сохраняться после прекращения раздражения (гиперпатия). Аллодиния и гипералгезия могут сочетаться со снижением чувствительности в пораженной области — болевая анестезия. Наряду с изменением чувствительности часто выявляются вегетативные нарушения в соответствующей области — изменение окраски кожных покровов (гиперемия или цианоз), нарушение трофики ткани, потоотделение, отечность. Как правило, у таких больных нарушен сон, имеются депрессивные и тревожные нарушения.
Знание патофизиологических механизмов боли и их связи с возникающими клиническими симптомами важно для дифференцированного назначения терапии. Так, стреляющая пароксизмальная боль (например, при невралгии тройничного нерва) обусловлена эктопическими разрядами, генерируемыми поврежденными нервными волокнами. Возникновение эктопических разрядов связывают с повышенной плотностью каналов для ионов Na+ в поврежденном нерве, и, следовательно, использование блокаторов натриевых каналов (карбамазепин), стабилизирующих возбудимые мембраны, будет оправданным при данной симптоматике.
Причиной возникновения жгучей постоянной боли считают нарушение центрального торможения ноцицептивных нейронов. Данное торможение опосредуется как спинальными, так и супраспинальными механизмами. В спинном мозге контроль за возбудимостью ноцицептивных нейронов осуществляют ГАМК и глицин. Нисходящее супраспинальное торможение реализуется серотонин-, норадреналин- и опиоидергическими нейротрансмиттерными системами. В связи с этим назначение трициклических антидепрессантов, блокирующих обратный захват серотонина и норадреналина, будет эффективно подавлять жгучую постоянную боль. Аналогичный результат отмечается и у габапентина, который увеличивает синтез и концентрацию ГАМК в спинном мозге.
Считается, что такие симптомы, как парестезия и дизестезия, во многом обусловлены эктопическими разрядами в поврежденных нервных волокнах. И, следовательно, назначение мексилетина — блокатора натриевых каналов — будет вполне оправданным.
Механическая аллодиния является частым симптомом у пациентов с нейропатическими болями. Главным механизмом развития аллодинии является нарушение ГАМК- и глицинергического торможения ноцицептивных нейронов в дорсальных рогах спинного мозга с одновременным усилением NMDA опосредованного возбуждения. Поэтому использование препаратов, усиливающих ГАМК-эргическое торможение (габапентин) и подавляющих активность NMDA-рецепторов (кетамин), демонстрирует высокую эффективность при устранении аллодинии.
Вторичная гипералгезия у пациентов с нейропатическими болями (снижение порогов болевой чувствительности вне зоны повреждения) возникает в результате центральной сенситизации ноцицептивных нейронов из-за усиления ноцицептивного афферентного потока, и, следовательно, торможение эктопических разрядов при помощи локального введения местных анестетиков является вполне обоснованным.
Нередко мы наблюдаем диссоциацию между выраженностью боли и степенью поражения нервной системы.
Периферическая нейропатическая боль возникает при полиневропатиях (диабетическая, алкогольная, хроническая воспалительная демиелинизирующая, алиментарно-обусловленная, идиопатическая сенсорная), туннельных невропатиях, травме нерва (фантомная боль), постгерпетических невралгиях, тригеминальных невралгиях, компрессиях корешка (радикулопатиях и радикулоишемиях), комплексном региональном болевом синдроме (сопровождающемся локальной болью с отеком, трофическими нарушениями и остеопорозом). Центральная нейропатическая боль развивается при поражении спинного мозга, ствола мозга, зрительного бугра и коры больших полушарий (компрессионная, сосудистая, ВИЧ-обусловленная миелопатии, опухоль, травма спинного мозга, сирингомиелия, фуникулярный миелоз, рассеянный склероз, постинсультная боль, боль при болезни Паркинсона.
Ноцицептивные боли по своему развитию чаще являются острыми, тогда как нейропатические боли — преимущественно хронические. В определенных случаях имеет место сочетание ноцицептивного и нейропатического компонентов боли (при компрессионных радикулопатиях, онкологических болях, туннельных синдромах).
Обследование пациента с хроническим болевым синдромом
Боль — субъективное явление, поэтому на сегодняшний день не существует унифицированных объективных способов ее диагностики. Тем не менее для оценки многофакторного болевого синдрома используется минимальный объем стандартных диагностических тестов, позволяющих оценить боль и эффективность ее терапевтической коррекции в клинической практике. Исходя из современного определения боли, ее детальная оценка должна базироваться на субъективных ощущениях больного, его аффективных реакциях в ответ на болевой раздражитель, физиологических показателях и «болевом поведении». Важную роль при этом играют тщательный опрос, осмотр пациента и объективное неврологическое и соматическое обследование. При обследовании пациентов с хроническим болевым синдромом обращают особое внимание на такие клинические признаки, как чрезмерное внимание индивидуума к своему соматическому состоянию, подавленное настроение или тревожность. Специфическими характеристиками боли, которые указывают на плохую психологическую переносимость ноцицептивных стимулов, являются следующие: боль не дает человеку возможности выполнять свои повседневные обязанности, но тем не менее не мешает ему спокойно лечь спать; пациент живо и ярко описывает испытываемые болевые ощущения и всем своим поведением демонстрирует, что он болен; испытывает боль постоянно, болевые ощущения при этом не меняются; физическая нагрузка усиливает боль, а повышенное внимание и забота со стороны окружающих смягчают ее.
Таким образом, для оценки выраженности хронического болевого синдрома необходима обьективизация боли и психоэмоционального состояния.
Для унификации описания боли пациентом и объективизации переживаний больного созданы опросники, состоящие из наборов стандартных дескрипторов, общих для всех пациентов. Чаще всего применяется Макгилловский опросник боли (McGill Pain Questionnaire — MPQ), который содержит вербальные характеристики сенсорных, аффективных и моторно-мотивационных компонентов боли, ранжированных по пяти категориям интенсивности. Достоинство опросника заключается в том, что он позволяет дифференцировать органическую природу боли и выявить психологическое состояние пациента. Многочисленные исследования боли, проведенные с помощью опросника, показали, что все показатели в аффективном классе оказались выше у эмоционально лабильных лиц со склонностью к тревожным и депрессивным реакциям, у женщин — выше, чем у мужчин, у больных с хронической болью по сравнению с острой. В силу трудоемкости исследования Макгилловский опросник в нашей стране применяется в основном в научных исследованиях.
Поскольку боль тесно связана с эмоциональным статусом, в ее характеристике и выборе оптимальной терапии играют роль опросники качества жизни и психологические методы, позволяющие оценить выраженность тревожности и депрессии.
В клинической практике чаще могут быть применены шкалы, позволяющие оценить интенсивность и остроту боли, а также определить эффективность проводимого лечения:
1. Простая описательная шкала интенсивности боли (пятизначная):
— нет боли — 0;
— слабая боль (чуть-чуть болит) — 1;
— умеренная (болит) — 2;
— сильная (очень болит) — 3;
— невыносимая (нестерпимая) — 4.
2. Словесная количественная шкала (шкала 10-балльной оценки интенсивности боли) — от отсутствия боли до невыносимой. Пациент называет число, соответствующее боли.
3. Визуальная аналоговая шкала боли — при применении пациент отмечает на линии, насколько сильна его боль от 0 до 10. Шкала может применяться начиная с 6-летнего возраста.
Для определения боли как нейропатической существуют специальные опросники — Опросник DN4, Болевая шкала LANSS.
Опросник DN4 (Didier Bouhassiraa, Nadine Attala et al., Pain 114 (2005) 29–36)
Пожалуйста, заполните этот опросник, отметив галочкой один ответ для каждого пункта в приведенных ниже 4 вопросах.
Собеседование с пациентом
Вопрос 1. Соответствует ли боль, которую испытывает пациент, одному или нескольким из следующих определений?
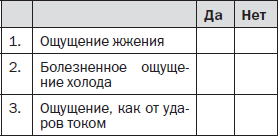
Вопрос 2. Сопровождается ли боль одним или несколькими из следующих симптомов в области ее локализации?
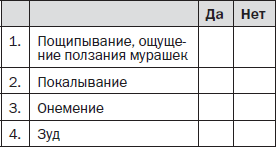
Осмотр пациента
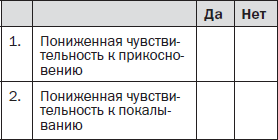
Вопрос 3. Локализована ли боль в той же области, где осмотр выявляет один или оба следующих симптома?
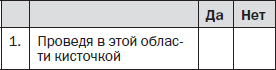
Вопрос 4. Можно ли вызвать или усилить боль в области ее локализации?
Сумма баллов (количество ответов «Да»): __________
Если сумма составляет 4 балла и более, это указывает на то, что боль у пациента является нейропатической или имеется нейропатический компонент боли (при смешанных ноцицептивно-нейропатических болевых синдромах с вероятностью 86 %).
Болевая шкала LANSS (Leeds Assesment of Neuropathic Symptoms and Signs, Bennett M., 2001)
Оценочная шкала невропатических симптомов и признаков
А. Болевой опросник
Вспомните о том, как вы ощущали вашу боль в течение прошедшей недели.
Пожалуйста, скажите, какое из определений наиболее точно описывает вашу боль.
Вопрос 1. Ощущаете ли Вы вашу боль как необычное, неприятное ощущение в вашей коже? Можно ли эти ощущения описать такими прилагательными, как колющие, щиплющие, пронизывающие или проникающие?

Вопрос 2. Выглядит ли цвет кожи в той области, где локализована боль, другим по сравнению с нормальным? Можно ли сказать, что она покрывается пятнами или выглядит покрасневшей или порозовевшей?

Вопрос 3. Изменяется ли чувствительность к прикосновению в той области, где локализована боль? Становится ли неприятно, например, если слегка провести по коже рукой, или болезненно, когда надеваете одежду?

Вопрос 4. Возникает ли ваша боль вдруг, внезапно, без видимой на то причины, даже когда вы в покое? Можно ли описать ее как электрический шок, прыжок или взрыв?

Вопрос 5. Когда вы чувствуете боль, могут ли присутствовать необычные температурные ощущения в этой области? Можно ли их описать как горящие или жгущие?

B. Сенсорное тестирование
Болевая чувствительность может быть протестирована с помощью сравнения болевой зоны с контрлатеральной или соседней неболевой областью на наличие аллодинии или изменений порогов болевой чувствительности при покалывании (PPT).
1. Аллодиния
Проверяется ответ на легкое тактильное прикосновение (хлопок, шерсть) в неболевой и болевой области. Если нормальная чувствительность регистрируется на здоровом участке, а боль или неприятные ощущения обнаружены в болевой зоне, то аллодиния присутствует.

2. Измененный порог болевой чувствительности при покалывании (PPT)
Определяется болевой порог при покалывании с помощью сравнения ответов на укол иголкой, нанесенный мягко на поверхность кожи неболевой, а затем болевой зоны.
Если покалывание ощущается остро на неболевой стороне, а со стороны боли воспринимается по-другому, например отсутствует, или притуплено (повышен PPT), или слишком сильные болевые ощущения (снижен PPT), то болевой порог на покалывание считается измененным.

Суммирование
Для получения итоговой суммы складываются значения параметров сенсорных дескрипторов и тестирования чувствительности.
Итоговая сумма (максимум 24)……..
Если сумма <12, то нейропатические механизмы формирования боли маловероятны.
Если сумма >12, то вероятны нейропатические механизмы формирования боли.
Оценка психологического состояния пациента является необходимым компонентом диагностического комплекса при обследовании больного с хроническим болевым синдромом. Многочисленные клинико-эпидемиологические исследования установили, что существует тесная связь между хронической болью и психоэмоциональными нарушениями. Наиболее распространенными психоэмоциональными проявлениями хронической боли являются клинически выраженные отклонения: тревога, депрессия, апатия, усталость и астения, повышенная возбудимость, бессонница, раздражительность. Данные о распространенности психоэмоциональных нарушений среди пациентов с хронической болью колеблются от 30 до 87 %. Некоторые исследователи считают психоэмоциональные нарушения ведущим фактором в снижении работоспособности у больных с хронической болью и наиболее значимой мотивацией при обращении за медицинской помощью. Для оценки психопатологических коррелятов боли применяются специальные психологические тесты и опросники:
— субъективные тесты (анкеты, опросники или шкалы самооценки, которые заполняются пациентом);
— шкала самооценки личностной и реактивной тревоги Спилбергера;
— госпитальная шкала оценки тревоги и депрессии;
— шкала оценки депрессии Бека.
Инструментальные методы. В научных исследованиях применяют также следующие методы. Альгометрия — метод, который заключается в количественном измерении субъективного отчета о боли при предъявлении болевых стимулов нарастающей интенсивности. Наиболее часто используется при исследовании миофасциальной боли. Электрометрия позволяет произвести количественную оценку порога болевой чувствительности. Заключается в предъявлении одиночных электрических стимулов, с помощью которых устанавливаются пороги болевой чувствительности, определяемые амплитудой минимального электрического стимула.
Конечно же, такое многоплановое исследование различных характеристик боли могут позволить себе лишь специализированные клиники, занимающиеся проблемами боли.
Стратегия лечения нейропатической боли
В связи с разнообразием механизмов возникновения боли лечение каждого пациента должно быть индивидуализировано с учетом заболевания, явившегося причиной боли, а также клинических особенностей самого болевого синдрома. Анализ болевого синдрома с точки зрения его патофизиологических механизмов (ноцицептивная боль, нейропатическая, смешанная) является очень важным прежде всего с точки зрения лечения. Если врач оценивает боль как ноцицептивную, то наилучшими средствами для ее лечения будут простые анальгетики и НПВП. Если боль является нейропатической или имеется нейропатический компонент, то препаратами выбора являются антиконвульсанты (прегабалин, габапентин), антидепрессанты, опиоидные анальгетики и лидокаин. В случае смешанных болевых синдромов возможна комбинированная терапия с выбором средств в зависимости от представленности ноцицептивного и нейропатического компонентов.
В терапии нейропатической боли наиболее эффективным представляется комплексный подход. Сегодня отсутствует достаточное количество доказательных данных о пользе применения консервативных немедикаментозных методов лечения (например, рефлексотерапии — акупунктуры, лазеропунктуры, физиотерапии, физических упражнений, чрескожной электронейростимуляции). Однако клинический опыт показывает их эффективность в комплексной терапии, в связи с чем можно рекомендовать их применение. Кроме того, пациенты с нейропатической болью нуждаются в постоянной психологической поддерж-ке. Рациональная психотерапия в этом случае может играть ключевую роль.
Наиболее признанной в лечении нейропатической боли на сегодняшний день является фармакотерапия.
Согласно рекомендациям Европейской федерации неврологических обществ (EFNS) по терапии некоторых состояний, сопровождающихся нейропатической болью, наиболее признанной в лечении нейропатической боли на сегодняшний день является фармакотерапия.
Европейские рекомендации по терапии постгерпетической невралгии, тригеминальной невралгии, болевых полиневропатий и центральной нейропатической боли:
1. Постгерпетическая невралгия — препараты первого ряда: прегабалин, габапентин, лидокаин местно; препараты второго и третьего рядов: капсаицин, опиоиды, трамадол, вальпроаты.
2. Тригеминальная невралгия — препараты первого ряда: карбамазепин, оскарбазепин; методы второго ряда: хирургическое лечение.
3. Болевые полиневропатии — препараты первого ряда: прегабалин, габапентин, трициклические антидепрессанты; препараты второго и третьего рядов: ламотриджин, опиоиды, трамадол, СИОЗС.
4. Центральная нейропатическая боль — препараты первого ряда: прегабалин, габапентин, трициклические антидепрессанты; препараты второго и третьего рядов: каннабиоиды, ламотриджин, опиоиды.
При постгерпетической невралгии сначала может быть назначено местное лечение лидокаином. Считается, что действие лидокаина основано на блокировании движения натриевых ионов через клеточную мембрану нейронов. Это стабилизирует клеточную мембрану и предотвращает распространение потенциала действия и соответственно уменьшает боль. Следует иметь в виду, что уменьшение боли при местном применении обезболивающих средств не распространяется за пределы площади и продолжительности контакта с пораженной областью тела. Это может быть удобным для пациентов с небольшой зоной распространения боли. Лидокаин 5% в виде пластыря или пластин показан для снятия боли при постгерпетической невралгии (ПГН). Побочные реакции в виде жжения и эритемы могут наблюдаться в месте наклеивания при длительном применении.
При нейропатических болях другого происхождения, а также в случае безуспешности лечения лидокаином рекомендуется начать пероральную монотерапию прегабалином или габапентином, трициклическим антидепрессантом или смешанным ингибитором обратного захвата серотонина и норадреналина. Из перечисленных препаратов наилучшей переносимостью обладают прегабалин и габапентин. Эти препараты характеризуются практически полным отсутствием лекарственных взаимодействий и невысокой частотой развития нежелательных явлений. Оба препарата показали свою эффективность в лечении различных нейропатических болей. В том случае, если первый назначенный препарат оказался малоэффективным или плохо переносился пациентом, следует переключаться на альтернативную монотерапию препаратом первого ряда. Если все препараты первого ряда оказались неэффективными или плохо переносимыми, то рекомендуется начать монотерапию трамадолом или его комбинацией с парацетамолом либо опиоидным анальгетиком. К сожалению, это не всегда возможно, так как назначение опиоидных препаратов ограничено специальными требованиями, предъявляемыми к выписке этих препаратов.
Лечение нейропатической боли — длительный процесс, который требует регулярного контроля за состоянием здоровья пациента и выполнением врачебных назначений. В начале терапии особое внимание следует обращать на правильное титрование дозы препаратов и отслеживать возможность развития лекарственных взаимодействий. Учитывая долгосрочность терапии, следует мониторировать и по возможности предотвращать развитие отдаленных нежелательных явлений (таких, например, как гепато- и гастротоксичность, изменения со стороны системы крови и др.), возникающих на фоне приема некоторых лекарственных средств.
Перед началом терапии следует провести разъяснительную беседу с больным и его родственниками о том, что лечение может быть длительным, и уменьшение боли будет происходить постепенно. При нейропатической боли даже при правильной программе лечения редко удается достичь 100% обезболивания. Таким образом, врач должен определенным образом формировать адекватные ожидания пациента и его близких по поводу лечения. В некоторых работах было показано, что снижение интенсивности боли на 30 % от исходного уровня по ВАШ оценивается самими больными как удовлетворительный результат. Эту цифру следует иметь в виду при оценке эффективности проводимого лечения.
Перед назначением любого нового препарата по поводу лечения нейропатической боли необходим тщательный анализ препаратов, уже принимаемых пациентом, с целью исключения лекарственного взаимодействия. В настоящее время описана потенциальная возможность взаимодействия опиоидных анальгетиков и трициклических антидепрессантов, вызывающих серьезные нежелательные явления при передозировке. В случае применения такой комбинации необходимо тщательно взвешивать пользу и риск данного назначения. Большинство трициклических антидепрессантов, противосудорожных препаратов и опиоидных анальгетиков обладают угнетающим действием на центральную нервную систему. С целью уменьшения выраженности этих и других побочных эффектов в процессе достижения эффективной дозы необходимо использовать постепенное титрование начиная с минимальной (например, 1/4 таблетки амитриптилина, содержащей 25 мг) и заканчивая максимальной переносимой дозой на протяжении нескольких недель. В этом случае врач и пациент должны осознавать, что облегчение боли будет постепенным. Поскольку трициклические антидепрессанты и карбамазепин у некоторых пациентов быстро метаболизируются, требуется мониторинг уровня препарата в плазме крови, прежде чем безопасно осуществлять дальнейшее повышение дозы в случае отсутствия обезболивающего эффекта от минимальной дозы.
Резюмируя сказанное выше о фармакотерапии нейропатической боли, следует особо подчеркнуть, что, несмотря на определенную эффективность препаратов вышеупомянутых разных лекарственных групп, нейропатическая боль не включена в число показаний к применению большинства из них. Исключениями являются следующие: габапентин и прегабалин зарегистрированы для лечения периферической и центральной нейропатической боли, карбамазепин — для лечения только тригеминальной невралгии.
