Газета «Новости медицины и фармации» 18(341) 2010
Вернуться к номеру
Практический опыт комплексного лечения больных экскреторно-токсическим бесплодием
Авторы: И.И. Горпинченко, Ю.Н. Гурженко, П.М. Клименко, В.В. Спиридоненко, ГУ «Институт урологии НАМН Украины», г. Киев, Крымский государственный медицинский университет им. С.Г. Георгиевского, г. Симферополь, Луганский государственный медицинский университет
Версия для печати
Одним из осложнений воспалительного процесса в органах мужской половой сферы является экскреторно-токсическое бесплодие (ЭТБ). В урологической практике наиболее распространенным диагнозом воспалительного процесса в органах мужской половой сферы является «хронический простатит» (ХП) [5, 8–12]. Однако необходимо отметить, что такой диагноз не всегда соответствует действительности. Само по себе понятие «хронический простатит» условное и представляет собой собирательную категорию: сюда необходимо отнести и хронический уретрит, везикулит, колликулит, то есть это полиорганное заболевание с соответствующим хроническим течением и осложнениями, среди которых и необходимо отметить ЭТБ.
Об актуальности проблемы в Украине свидетельствуют факты: смертность населения преобладает над рождаемостью, население Украины сокращается, по данным официальной статистики, приблизительно на 8000 человек в день, а в настоящее время количество зарегистрированного населения Украины составляет менее 45 млн 750 тыс. человек. В этих условиях профилактика и лечение нарушений репродуктивного здоровья приобретают особую социальную ценность, хотя от достижений медицинской науки этот показатель зависит всего на 7–10 %, остальные 90 % — это социальные, экологические, миграционные и другие факторы.
Вследствие хронического воспалительного процесса в предстательной железе, семенных пузырьках, мочеиспускательном канале снижается секреторная и ферментативная активность [3, 9–11]. Изменяется архитектоника предстательной железы, что приводит к нарушению дренажа, возникают застойные очаги, в которых длительное время развивается патогенная микрофлора, вызывая явления патоспермии [9–11], обусловленные влиянием токсинов бактерий и слизи, изменением pH эякулята в основную сторону, изменением в гипоталамо-гипофизарно-гонадной оси, изменением метаболизма тестостерона в предстательной железе, нарушением продукции гонадотропинов как основных стимуляторов сперматогенеза у мужчин, аутоиммунизацией, снижением уровня лимонной кислоты и фруктозы, нарушением ферментного и изоферментного спектра эякулята. Это и есть этапы этиопатогенеза ЭТБ при хроническом простатите.
Их обилием обусловлена и сравнительно низкая эффективность лечения заболевания, и необходимость поиска новых средств, улучшающих качество эякулята у мужчин [11].
Во избежание полипрагмазии в выборе схем лечения ЭТБ важным представляется поиск комплексных медикаментов, которые бы влияли на несколько звеньев этиологии и патогенеза ЭТБ [10, 11].
Методика лечения ЭТБ при хроническом воспалительном процессе в мужских половых органах должна, по возможности, включать три этапа:
1-й этап — 1–2 курса комплексного противовоспалительного лечения (этиотропная терапия; иммунокорригирующая терапия; препараты, улучшающие дезинтоксикационную функцию печени; энзимотерапия (трипсин, химотрипсин, лидаза, вобензим и др.); биологические стимуляторы; физиотерапия).
2-й этап — стимуляция спрематогенеза, улучшение качества сперматозоидов (витаминотерапия; незаменимые аминокислоты; биостимуляторы; гормонредуцированная терапия). Подбираются стимулирующие препараты, улучшающие общее количество и подвижность сперматозоидов. Минимальная продолжительность такого курса — 2,5 мес., что обусловлено длительностью цикла сперматогенеза. Именно за такой срок происходит созревание сперматозоидов от клеток-предшественников до полноценных зрелых форм. Нередко для восстановления показателей спермограммы и наступления беременности требуется гораздо больше времени (до полугода и более). В этом случае с целью активации сперматогенеза (в зависимости от степени выраженности нарушений) подбирается стимулирующая терапия.
3-й этап — санаторно-курортное лечение.
В настоящее время инфекционный процесс в половых органах мужчин практически никогда не бывает вызван одной патогенной инфекцией. Это микст-инфекция, включающая в себя бактериальную, трихомонадную, хламидийную, уреаплазменную, микоплазменную и другие составляющие. Поэтому существует необходимость в комплексных препаратах, имеющих очень широкую антимикробную активность. В последнее время появилось немало комбинированных антибактериальных препаратов, сочетающих в одной таблетке фторхинолоны (ФХ) (норфлоксацин, ципрофлоксацин, офлоксацин, гатифлоксацин) с представителем группы 5-нитроимидазолов (тинидазол, орнидазол).
Один из таких препаратов — Стиллат, который содержит два сбалансированных ингредиента: гатифлоксацин 200 мг и орнидазол 500 мг.
Для лечения хронических воспалительных заболеваний мужских половых органов широко применяют следующие группы антибактериальных препаратов: макролиды, ФХ и тетрациклины.
Золотым стандартом лечения бактериальной инфекции мужских половых органов является группа ФХ благодаря высокой частоте использования в лечебной практике и существенной роли в терапии инфекционных процессов.
Антибактериальные средства хинолонового ряда наиболее активны в отношении большинства грамотрицательных и в меньшей степени — грамположительных возбудителей.
ФХ не имеют аналогов в природной среде, что обеспечивает их высокую активность относительно полирезистентных штаммов микроорганизмов. В литературе не описаны случаи формирования резистентности микроорганизмов после длительного применения ФХ.
Механизм действия ФХ заключается в ингибировании ДНК-гиразы, приводящем к блокированию репликации ДНК и синтеза белка микроорганизма, что обеспечивает быстрое бактерицидное действие. Резистентность к ФХ возникает очень редко, лишь вследствие хромосомных мутаций бактерий. Не наблюдается резистентности, обусловленной плазмидами, энзиматической инактивации этих препаратов бактериями. Для ФХ не характерны перекрестные реакции с другими классами антибактериальных средств. ФХ III и IV поколений в отличие от ФХ II поколения блокируют еще одну «мишень» в оболочке бактерий — топоизомеразу IV типа. Доказано, что именно этот фермент блокируется преимущественно у грамположительных бактерий, тогда как ДНК-гираза преимущественно блокируется у грамотрицательных бактерий. ДНК-гираза и топоизомераза-4 относятся ко 2-му типу топоизомераз, причем ДНК-гираза состоит из двух субъединиц: Gyr A и Gyr B, которые кодируются gyr А и gyr В генами. Субъединица Gyr A обусловливает соединение и разъединение цепей ДНК, а Gyr B поддерживает активность АТФ-азы бактериальной клетки.
Основные стадии бактерицидного действия ФХ можно представить в такой последовательности: проникновение в клетку через внешнюю мембрану; ингибирование фермента ДНК-гиразы (топоизомеразы II типа), формирование комплекса препарата с комплексом ДНК + ДНК-гираза (субъединица А). Возможно ингибирование фермента топоизомеразы IV типа (фермент менее чувствителен к ФХ, чем ДНК-гираза); нарушение биосинтеза ДНК; индукция белка SOS-ответа, нарушение процесса деления клетки; глубокие структурные изменения в клеточной стенке, цитоплазме и нуклеоиде; гибель клетки (бактерицидный эффект).
Множество весьма полезных свойств ФХ позволяет им занять ведущие позиции в арсенале современных антибактериальных средств: уникальный для антимикробных средств механизм действия — ингибирование фермента бактериальной клетки — ДНК-гиразы; высокая степень антибактериальной активности; широкий спектр антимикробного действия, включающий грамотрицательные и грамположительные аэробные бактерии (некоторые препараты ФХ активны также относительно анаэробов), микобактерии, хламидии, микоплазмы; невысокая частота резистентности к ним микроорганизмов; высокая биодоступность при приеме внутрь; хорошее проникновение в ткани и клетки макроорганизма, где создаются концентрации, близкие к сывороточным или даже их превышающие; длительный период полувыведения и наличие постантибиотического эффекта, что определяет удобное дозирование — 1–2 раза в сутки; возможность сочетанного применения с другими группами антибактериальных средств (β-лактамазами, аминогликозидами, макролидами, гликопептидами, линкозамидами, нитроимидазолами); доказанная в контролируемых клинических исследованиях высокая эффективность во время лечения инфекций практически любой локализации (верхних и нижних дыхательных путей, мочевыделительной системы, кожи и мягких тканей, костей и суставов, печени и желчевыводящих путей, пищеварительного тракта, интраабдоминальной, гинекологической, глазной, центральной нервной системы, инфекций, передаваемых половым путем); возможность применения для эмпирической терапии, в том числе монотерапии, в случае тяжелых инфекций в стационаре; удовлетворительная переносимость препаратов, невысокая частота побочных эффектов.
Спектр действия препаратов ФХ весьма широк. Наибольшую эффективность ФХ проявляют к грамотрицательным бактериям, прежде всего Enterobacteriaceae. Высокую чувствительность к ФХ имеют гоно- и менингококки, а также прочие грамотрицательные возбудители — Campylobacter jejuni, M.сatarrhalis, Legionella, H.influenzae, в том числе штаммы, продуцирующие β-лактамазы. Наибольшую активность относительно грамотрицательных возбудителей имеют ципрофлоксацин и офлоксацин. Синегнойная палочка умеренно чувствительна к ФХ, наиболее чувствительна к ципрофлоксацину. Активность препаратов II поколения по сравнению с III и IV относительно грамположительной флоры, прежде всего пневмококков, проявляется в меньшей степени. ФХ III и IV поколения имеют высокую антипневмококковую активность, в связи с чем иногда их называют респираторными ФХ. Некоторые препараты IV поколения (тровафлоксацин, моксифлоксацин, клинафлоксацин) активны относительно анаэробов, в частности Clostridium spp., Bacteroides spp. и метициллинрезистентных штаммов стафилококков. Это дает возможность применять их в случаях смешанных инфекций для монотерапии. Прочие ФХ, не имеющие антианаэробной активности, во время лечения больных со смешанной аэробно-анаэробной инфекцией (абдоминальной, гинекологической) необходимо сочетать с антианаэробными препаратами, в частности с линкозамидами или нитроимидазолами.
ФХ проявляют активность в отношении хламидий и микоплазм, а также при воспалительных процессах, вызванных U.urealyticum.
Представителем последнего, IV поколения ФХ является препарат гатифлоксацин.
Фармакокинетика. Гатифлоксацин хорошо всасывается в организме из пищеварительного тракта (биодоступность при пероральном приеме составляет почти 100 %). В плазме, целевых тканях и биологических жидкостях достигается более высокая концентрация препарата, чем в плазме крови. Гатифлоксацин имеет продолжительный период полувыведения, что дает возможность принимать препарат один раз в сутки.
Абсолютная биодоступность перорального гатифлоксацина — 96 %. Среднее значение максимальной концентрации в сыворотке или плазме составляет 3,4–4,5 мг/л при рекомендованной дозе перорального приема 400 мг и является линейно корреляционным с дозой препарата 100–800 мг для перорального приема. Стабильная концентрация гатифлоксацина в плазме или сыворотке достигается после трех дней применения препарата. Средняя продолжительность полувыведения 6,8–9,3 ч. Как и другие ФХ, гатифлоксацин имеет, очевидно, высокий объем проницаемости (1,6–1,7 л/кг) и низкий уровень образования белковых соединений в сыворотке (20 %).
Гатифлоксацин хорошо проникает в биологические жидкости и ткани организма. Среднее соотношение пенетрации (соотношения концентрации препарата в тканях или биологических жидкостях по отношению к концентрации в плазме или сыворотке) ≥ 0,99–2,01 отмечают в репродуктивной системе (эндометрий, portio vaginals, шейка матки, простатическая жидкость, сперма). Концентрация гатифлоксацина в моче также является довольно высокой (675 мг/л после одноразового перорального приема 400 мг). Гатифлоксацин проходит минимальный уровень метаболизма и первично выводится почками.
Преимущества гатифлоксацинов
1. Уникальный механизм действия: нарушение процесса биосинтеза белка вследствие воздействия на два фермента — топоизомеразы ІІ и IV.
2. Высокая активность в отношении штаммов бактерий, устойчивых к гентамицину, карбенициллину, цефазолину, продуцирующих β-лактамазы.
3. Высокая активность в отношении синегнойной палочки и ацинетобактера.
4. Высокая биодоступность — 96 %.
5. Быстрое проникновение в органы и ткани организма и создание в них концентраций выше сывороточной.
6. Связывание с белками плазмы менее 20 %.
7. Длительный период полувыведения (до 14 ч).
8. Отсутствие взаимодействия с цитохромами печени: практическое отсутствие метаболизма и побочных эффектов.
Второй ингредиент препарата Стиллат — орнидазол. Орнидазол является противомикробным средством для лечения инфекций, вызванных трихомонадами, гарднереллами, амебами, лямблиями и анаэробными бактериями [2, 6, 7], которые довольно часто сопровождают хронические воспалительные заболевания половых органов у мужчин и женщин.
Фармакокинетика. Препарат всасывается быстро, биодоступность составляет 90 %, пик концентрации в плазме достигается через 3 ч. Около 13 % орнидазола связывается с белками плазмы. Орнидазол имеет высокую проницаемость: он хорошо проникает в спинномозговую жидкость, другие биологические жидкости и ткани организма, в том числе и в организм трихомонады, гарднереллы, амебы и т.д. Концентрация препарата в плазме поддерживается на оптимальном для различных схем лечения уровне: 6–36 мг/л [6].
Биотрансформация орнидазола происходит главным образом в печени с образованием 2-оксиметилового и α-оксиметилового метаболитов, которые менее активны, чем неизмененный препарат. При этом орнидазол не взаимодействует с цитохромом Р450, что обусловливает его минимальную токсичность и позволяет комбинировать орнидазол с другими антибактериальными препаратами, не опасаясь их взаимодействия. Период полувыведения составляет около 13 ч. После приема однократной дозы 85 % ее выводится в течение первых 5 дней в виде метаболитов, а около 4 % выводится в неизмененном виде с мочой [6].
Показаниями к применению орнидазола являются мочеполовые инфекции у женщин и мужчин, вызванные Trichomonas vaginalis, Gardnerella vaginalis, а также инфекции, вызванные анаэробными бактериями [2, 4, 6, 8, 17]. Обязательным является параллельное лечение полового партнера [1, 4, 15].
Противопоказанием к применению является повышенная чувствительность к препарату или другим производным нитроимидазола в анамнезе. Из побочных явлений могут отмечаться головокружения и головная боль, расстройства пищеварительного тракта, изредка сенсорная или смешанная периферическая невропатия и расстройства ЦНС в виде дрожания, ригидности мышц, нарушения координации, судорог, нарушения сознания. В отличие от других производных нитроимидазола орнидазол не ингибирует альдегиддегидрогеназу и поэтому не является несовместимым с алкоголем.
Материалы и методы
В отделении сексопатологии и андрологии ГУ «Институт урологии НАМН Украины» (г. Киев), на кафедрах урологии Крымского государственного медицинского университета им. С.Г. Георгиевского, Луганского государственного медицинского университета проведена работа по изучению эффективности использования препарата Стиллат и его влияния на качество показателей спермограммы у 137 пациентов при ЭТБ, обусловленном хроническими воспалительными заболеваниями мужских половых органов, которые вызваны микст-инфекцией с наличием трихомоноза или гарднереллеза.
Дизайн исследования. Под наблюдением находились 137 мужчин с хроническими воспалительными заболеваниями половых органов, вызванными микст-инфекцией с наличием трихомоноза или гарднереллеза.
Задачи исследования: изучить эффективность исследуемого препарата для лечения мужчин с хроническими воспалительными заболеваниями половых органов, вызванными микст-инфекцией с наличием трихомоноза или гарднереллеза; оценить степень удовлетворенности лечением пациентов; изучить переносимость и возможные побочные эффекты исследуемого препарата.
Критерии включения пациентов в исследование:
— мужчины в возрасте 18–55 лет;
— наличие признаков хронических воспалительных заболеваний половых органов;
— информированное письменное согласие пациента на участие в исследовании;
— способность пациента к адекватному сотрудничеству во время исследования.
Критерии исключения пациентов из исследования:
— индивидуальная гиперчувствительность к компонентам препарата;
— необходимость в назначении нерекомендуемых методов лечения; любые клинически значимые отклонения лабораторных показателей, требующие дополнительного обследования и интерпретации данных;
— заболевания или состояния, которые, по мнению исследователя, могут повышать риск для пациента либо оказывать какое-либо влияние на задачи исследования;
— отказ пациента от участия в исследовании;
— возникновение тяжелых побочных явлений, требующих отмены препарата;
— невыполнение режима приема препарата;
— одновременное участие в другом клиническом испытании.
Для изучения клинической эффективности препарата Стиллат были обследованы в динамике 137 пациентов с хроническими воспалительными заболеваниями мужских половых органов, осложненными ЭТБ, в возрасте от 24 до 38 лет (средний возраст пациентов — 31,5 ± 1,7 года) и с продолжительностью заболевания от 1 до 9 лет.
В соответствии с клинической симптоматикой, результатами инструментальной и лабораторной диагностики у пациентов были диагностированы заболевания, представленные на рис. 1.
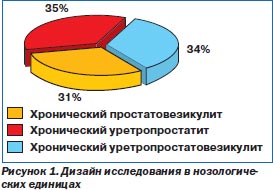
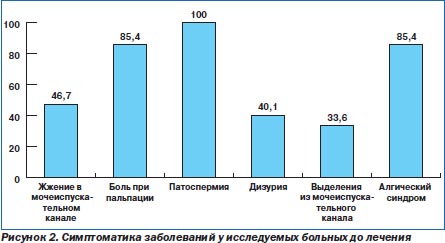
Клиническая картина заболеваний у пациентов отличалась особым разнообразием. Дизурические явления беспокоили 55 больных (40,1 %), болевые ощущения различной локализации — 117 (85,4 %) мужчин, слизистые выделения из мочеиспускательного канала — 46 (33,6 %) пациентов, ощущение жжения или зуда — 64 (46,7 %) больных, гиперемия губок мочеиспускательного канала — 28 (20,4 %), а патоспермия наблюдалась у 137 (100 %) больных. Боль при ректальной пальпации предстательной железы отмечалась у 93 (67,9 %) пациентов. Клиническая картина заболеваний у пациентов представлена на рис. 2.
Препарат Стиллат принимали по 1 таблетке 2 раза в день на протяжении 10 дней в комплексном лечении хронического воспалительного процесса в половых органах пациентов. В начале и после лечения оценивали общее состояние больных, анализы секрета предстательной железы, спермограмму, бактериологическое исследование. С целью коррекции иммунного статуса и улучшения проникновения антибиотика в зону воспаления назначали иммуномодуляторы (иммуномакс, протефлазид, нуклеинат), индукторы интерферона (кагоцел, циклоферон), системную энзимотерапию (вобензим), пациенты также получали симптоматическое лечение, физиотерапию (лазеротерапию, магнитотерапию), противогрибковые препараты, витамины. Не назначали антибактериальные, антипротозойные и противовирусные препараты, а также препараты, обладающие антиметаболическим и иммунодепрессивным действием.
Оценка эффективности. При лечении обязательно назначали и контролировали лечение половых партнеров мужчин с обязательным выполнением правил полового поведения во время лечения и до окончательного контрольного исследования. Использовали следующие методы: бактериоскопический, метод прямой иммунофлюоресценции, полимеразную цепную реакцию (ПЦР).
Эффективность методики оценивали через 30 дней после окончания лечения по следующим критериям: динамика клинической симптоматики, частота рецидивов, микробиологические критерии.
Высокая эффективность соответствовала полной нормализации клинических и контрольных лабораторных показателей с сохранением их до 3 мес. Удовлетворительная эффективность — нормализация части показателей и положительная динамика остальных показателей до 30-го дня лечения. Сохранение части нормальных показателей до 3 мес.
Низкая эффективность — отсутствие достоверных положительных изменений до 30-го дня лечения.
Оценка переносимости. Переносимость оценивали на основании субъективных симптомов, которые предъявляли пациенты, и объективных данных по пятибалльной системе (очень хорошая, хорошая, удовлетворительная, неудовлетворительная, крайне неудовлетворительная).
Этические и правовые аспекты исследования. Все пациенты были проинформированы о характере клинических испытаний, о препарате Стиллат, о возможных рисках, побочных явлениях, связанных с использованием препарата. Все больные дали информированное согласие на проведение исследования. Вся документация, касающаяся пациентов, была строго конфиденциальной.
Данные клинических и лабораторных испытаний статистически обработаны методом вариационной статистики с учетом критерия Стьюдента и представлены в виде таблиц. Для оценки достоверности полученных результатов был принят уровень значимости р < 0,05.
Результаты исследования и их обсуждение
При комплексном лечении с использованием препарата Стиллат клиническая картина заболевания модифицировалась довольно быстро. Снижение интенсивности алгического синдрома больные отмечали уже через 3–5 дней. У пациентов с хроническим уретропростатитом довольно быстро исчезли выделения из мочеиспускательного канала, ощущения зуда, жжения и гиперемия губок мочеиспускательного канала (в течение 3 дней — у 27 (58,7 %) из 46 пациентов; через 6 дней — у 41 (89,1 %) из 46 пациентов).
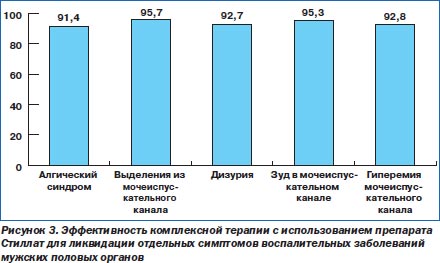
Следует отметить, что в конце лечения алгический синдром ликвидирован в результате терапии у 107 (91,4 %) из 117 больных. Боль при пальпации предстательной железы ликвидирована у 87 из 93 (93,5 %) пациентов. Явления дизурии до лечения беспокоили 55, а после лечения — 4. Эффективность лечения по данному показателю составила 92,7 %. Выделения из мочеиспускательного канала ликвидированы у 44 из 46 (95,7 %) пациентов. Из 64 мужчин, у которых до лечения наблюдались жжение и зуд в мочеиспускательном канале, эти симптомы исчезли у 61 (95,3 %) больного, а гиперемия наружного отверстия мочеиспускательного канала исчезла у 26 (92,8 %) из 28 больных. Обобщая изложенное выше, можно сделать вывод, что клиническая эффективность курса лечения составила 91,4–95,7 %. На рис. 3 приведена динамика эффективности комплексной терапии с использованием Стиллата для ликвидации отдельных симптомов воспалительных заболеваний мужских половых органов.
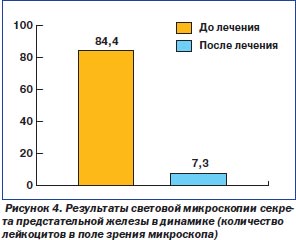
Кроме того, нами проанализированы результаты световой микроскопии секрета предстательной железы до и после лечения для изучения динамики воспалительного процесса в предстательной железе. До лечения в поле зрения микроскопа у больных с ХП и уретропростатитом обнаруживали 84,4 ± 12,7 лейкоцитов, а после курса противовоспалительной терапии с использованием Стиллата — 7,3 ± 1,2. То есть практически этот показатель достоверно доведен до нормы (рис. 4).
122 (89,0 %) больным из 137 было проведено ультразвуковое исследование предстательной железы и семенных пузырьков в динамике. Продольный и поперечный размеры предстательной железы модифицированы после лечения: продольный размер уменьшился с 4,5 ± 0,2 до 4,3 ± ± 0,2 см, а поперечный — с 4,6 ± 0,3 до 4,5 ± 0,2, что не является достоверным, несмотря на тенденцию к уменьшению размеров предстательной железы после лечения. Размеры семенных пузырьков также уменьшились недостоверно: до лечения — 3,5 ± 0,3, а после — 3,4 ± 0,3 см.
У больных хроническим простатовезикулитом и уретропростатитом было проведено бактериологическое исследование секрета предстательной железы. Данные приведены в табл. 1.
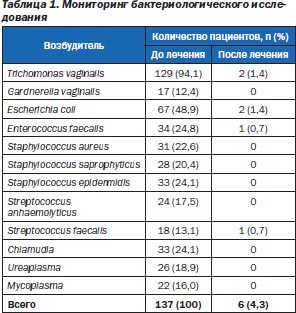
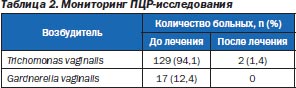
При динамическом исследовании методом ПЦР выявлены следующие виды специфических возбудителей в динамике наблюдения (табл. 2).
Данные табл. 2 свидетельствуют о высокой общей терапевтической эффективности исследуемого препарата относительно одноклеточных специфических возбудителей (95,7 %).
Для изучения репродуктивной функции мужчин при воспалительных заболеваниях мужских половых органов нами проведено контрольное исследование эякулята до лечения и через 3 мес. после окончания терапии у всех 137 больных.
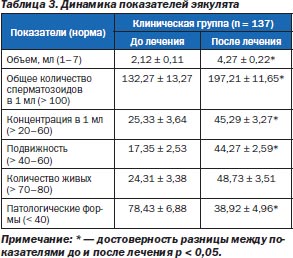
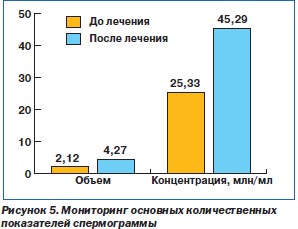
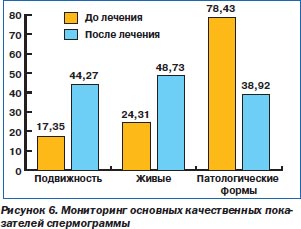
Исследование показало улучшение основных показателей спермограммы. Достоверно увеличился объем эякулята, концентрация сперматозоидов. Их общее количество, подвижность, количество живых сперматозоидов увеличились недостоверно, хотя некоторая тенденция к достоверности проявляется. Достоверно и существенно уменьшилось количество лейкоцитов, а на количество патологических форм сперматозоидов курс лечения также повлиял положительно, но недостоверно. В целом необходимо отметить, что курс комплексной терапии с использованием препарата Стиллат оказал положительное влияние на сперматогенез, что проиллюстрировано в табл. 3 и на рис. 5, 6.
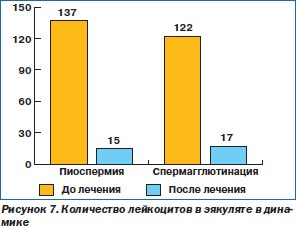
Исследуя показатель пиоспермии в динамике, мы выявили ее исчезновение в клинической группе у 122 (89,1 %) из 137 больных, спермагглютинация исчезла у 105 (86,0 %) из 122 больных (рис. 7).
Необходимо также отметить довольно хорошую переносимость препарата больными и минимальное количество побочных явлений. При исследовании переносимости препарата Стиллат больными в течение всего курса лечения только у 11 из 137 пациентов (8,0 %) отмечались незначительные побочные явления в виде тошноты и головной боли. Побочные явления не требовали отмены препарата.
Выводы
1. Использование препарата Стиллат в комплексном лечении хронических воспалительных заболеваний урогенитальной сферы, вызванных микст-инфекцией, у мужчин является высокоэффективным. Клиническая эффективность составила 91,4–95,7 %, а бактериологическая — 95,7 %.
2. Препарат Стиллат отличается хорошей переносимостью и небольшим количеством побочных эффектов (8,0 %) за счет его низкой токсичности и минимального межлекарственного взаимодействия.
3. Полученные результаты позволяют рекомендовать использование препарата Стиллат в комплексном лечении хронических воспалительных заболеваний урогенитальной сферы, вызванных микст-инфекцией, у мужчин.
1. Адаскевич В.П. Инфекции, передаваемые половым путем: Руководство для врачей. — М.: Медицинская книга, 1999. — 416 с.
2. Иванов О.Л., Ломоносов К.М., Алленов С.Н., Изюмова И.М. Опыт лечения острого трихомонадного уретрита // Российский журнал кожных и венерических болезней. — 1999. — № 3. — С. 57.
3. Ильин И.И. Негонококковые уретриты у мужчин. — 2-е изд., перераб. и доп. — М.: Медицина, 1993. — 256 с.
4. Ильин И.И. Негонококковые уретриты у мужчин. — М.: Медицина, 1991. — 228 с.
5. Кан Д.В., Сегал А.С., Кузьменко А.Н. Диагностика и лечение хронического неспецифического простатита: Метод. рекомендации. — М., 1980.
6. Клименко Б.В. Трихомониаз. — М.: Медицина, 1987. — 158 с.
7. Кривошеев Б.Н., Ермаков М.Н., Криницына Ю.М. Тиберал в терапии урогенитального трихомоноза // Вести дерматол. венерол. — 1997. — № 1. — С. 63-65.
8. Мавров И.И., Бухарович В.Г., Глухенький Б.Т. и др. Контактные инфекции, передающиеся половым путем / Пoд ред. И.И. Маврова. — К.: Здоров’я, 1989. — 230 с.
9. Проскура О.В. Неспецифические простатиты и везикулиты: Руководство по клинической урологии / Под ред. А.Я. Пытеля. — М., 1970. — С. 193-208.
10. Сексологія і андрологія / Під ред. акад. О.Ф. Возіанова та проф. І.І. Горпинченка. — К.: Здоров’я, 1996.
11. Скрипкин Ю.К., Шарапова Г.Я., Селисский Г.Д. Болезни, передающиеся при половых контактах. — М.: Медицина, 1985. — 284 с.
12. Тиктинский О.Л. Воспалительные неспецифические заболевания мочеполовых органов. — Л., 1984.
13. Lubasch A., Keller I., Borner K., Koep- pe P., Lode H. Comparative pharmacokinetics of ciprofloxacin, gatifloxacin, grepafloxacin, levofloxacin, trovafloxacin and moxifloxacin after single oral administration in healthy volunteers // Antimicrob Agents Chemother. — 2000. — 44. — 2600-3.
14. Vanuffel P., Cocito C. Mechanism of action of streptogramins and macrolides // Drugs. — 1996. — 51 (Suppl. 1). — 20-30.
15. Saultz J.W., Toffler W.L. Trichornonas infections in men // Am. Fam. Physician. — 1989. — V. 39. — P. 177-180.
16. Kulda J., Vojtechovska M., Tachezy J. et al. Metronidazole resistance of Trichornonas vaginalis as a cause of treatment failure in trichomoniasis. A case report // Br. J. Vener. Dis. — 1982. — V. 58. — P. 394-399.
17. Van Laarhoven P.H. Trichornonas vaginalis, a pathogen of prostatitis // Arch. Chir. Neerl. — 1967. — V. 19. — P. 263-273.
