Газета «Новости медицины и фармации» 16(336) 2010
Вернуться к номеру
Современные рекомендации по профилактике и лечению тромбоэмболических осложнений в акушерстве
Авторы: Е.Н. Клигуненко, д.м.н., профессор, Днепропетровская государственная медицинская академия
Версия для печати
В западном мире тромбоэмболические осложнения являются одной из главных причин материнской заболеваемости и смертности, расчетная частота их составляет 1,94 на 100 000 беременностей [1]. Риск развития глубокого венозного тромбоза у беременных женщин в 5 раз превышает риск развития его у небеременных женщин приблизительно такого же возраста, достигая 1 на 1000 родов [2]. Во Франции регистрируется 5–10 материнских смертей вследствие легочной эмболии или 6–12 на 1 000 000 родов. При этом помощь в 1/3 случаев является субоптимальной. Отмечается тенденция к возникновению тромбоза глубоких вен (ТГВ) в дородовом периоде, а легочной эмболии — в послеродовом. До 15 % в структуре заболеваемости ТГВ во время беременности приходится на женщин с предшествующим глубоким венозным тромбозом. Риск первичного или повторного венозного тромбоза более высок после рождения ребенка, быстро снижаясь к шестой неделе после родоразрешения. Частота глубокого венозного тромбоза нижних конечностей в течение беременности составляет 0,13–0,61 на 1000 беременностей [3]. При этом нет убедительных данных, что венозная тромбоэмболия (ВТЭ) чаще возникает в третьем триместре беременности. Вместе с тем ТГВ развивается в 6–7 раз чаще (до 90 %) в левой ноге, чем в правой. Это связывают со сдавлением левой подвздошной вены пересекающей ее возле правой подвздошной артерии аортой. Экстренное кесарево сечение повышает риск ВТЭ в 2–5 раз, тогда как плановое кесарево сечение имеет низкую степень риска.
Беременность сама по себе является фактором риска ВТЭ, поскольку в ходе ее происходят природные физиологические изменения в виде повышения продукции факторов свертывания крови, снижения продукции ингибиторов свертывания крови и изменений в фибринолитической системе.
Поэтому, оценивая вероятность развития ВТЭ у беременной, выделяют индивидуальные факторы риска и факторы риска, связанные с беременностью. Значимость многих как клинических, так и биологических факторов риска может быть различной: минимальной (возраст, курение, ожирение, не О группа крови), значительной (заболевание сердца в анамнезе) или не до конца ясной (поверхностный флебит в анамнезе). Наличие ВТЭ в анамнезе повышает риск рецидива с частотой от 0 до 20 %. Вероятность рецидива зависит от двух относительных причин:
1. Был ли фактор риска во время предыдущего случая ВТЭ временным или постоянным (риск рецидива считается меньшим, если фактор риска был временным).
2. Наличия биологических тромбофилических дефектов.
Преобладание ВТЭ и относительный риск вследствие наследственных факторов представлены в табл. 1. Гомозиготная мутация метилентетрагидрофолатредуктазы (MTГФР) не связана со значительным риском ВТЭ в ходе беременности (в частности, при дополнительном назначении фолиевой кислоты). Среди приобретенных дефицитов системы коагуляции наибольшее распространение имеет антифосфолипидный синдром (0,5–1,0 на 1000 беременностей).
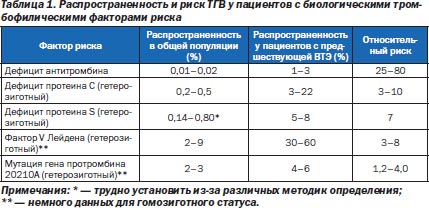
К факторам риска, связанным с беременностью, относят количество родов в анамнезе, множественные беременности, строгий постельный режим, преэклампсию, послеродовое угнетение лактации, тромбоцитоз после кесарева сечения, анемию, кровотечение и трансфузию. При этом предполагают, что риск ВТЭ, ассоциированный с одним из вышеперечисленных факторов, низок и возрастает при их сочетании. Вместе с тем плазменные уровни D-димера или комплекса «тромбин — антитромбин» не являются маркерами риска акушерской ВТЭ. Страфикация риска ВТЭ в акушерстве представлена в табл. 2.
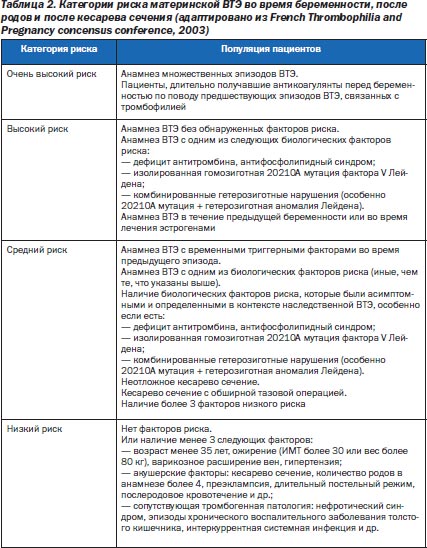
Диагностика тромбоза при беременности всегда задерживается вследствие неспецифической симптоматики, которая может быть неправильно интерпретирована. К тому же большинство диагностических тестов, которые широко используются у небеременных женщин, нельзя адекватно перенести на беременных. Физиологические изменения, как и анатомические могут обусловливать меньшую значимость обычных диагностических тестов при беременности. Например, D-димер повышается у большинства беременных женщин, что снижает эффективность его использования для исключения ВТЭ у беременных. Хотя нет крупных доказательных исследований, большинство авторов считает, что компрессионная ультрасонография (КУ), изолированная или в комбинации с дуплексным допплером, должна быть первым диагностическим шагом у беременных с подозрением на ТГВ. К сожалению, проксимальные тромбы, которые превалируют у беременных (илеофеморальная локализация — в 70 %, левосторонняя локализация — в 80 %), труднее диагностируются при КУ. Когда клинические подозрения очень сильны, следует рассмотреть возможность венографии (по возможности с абдоминальной защитой). Вместе с тем роль магнитно-резонансной венографии не до конца изучена. Для диагностики легочной эмболии возможно использовать вентиляционно-перфузионную сцинтиграфию, спиральную компьютерную томографию, иногда в сочетании с КУ.
Методы профилактики ВТЭ в акушерстве, подобно другим разделам хирургии, подразделяют на механические и фармакологические [3].
К механическим методам относят гольфы с эластической компрессией. Гольфы помогут уменьшить боль, отек, тромбообразование. Длительное использование их снижает риск формирования посттромбоэмболического синдрома. Они используются самостоятельно у пациенток с низким риском ВТЭ и в сочетании с другими мерами — при высоком риске (степень доказательности D). При возникновении на фоне беременности ТГВ и наличии противопоказаний к антикоагулянтам либо при недавнем обширном тромбозе в анамнезе и наличии высокого риска эмболии в периродовом периоде беременной устанавливают временный фильтр в нижней полой вене (степень доказательности D).
Для предупреждения и лечения ВТЭ в течение беременности применяется антитромботическая терапия. Она позволяет также предотвратить как системную эмболию у беременных с протезами клапанов сердца, так и нарушения роста и выкидыш плода у беременных с антифосфолипидным синдромом.
Пероральные антикоагулянты (варфарин) проходят через плаценту к плоду, оказывая тератогенное и эмбриотоксическое действие. Использование антагонистов витамина К в течение первых 6–12 недель беременности ассоциируется с гипоплазией лицевого черепа и скелетной мускулатуры в 5 % случаев (уровень доказательности II). Эмбриональное кровотечение — еще один побочный эффект варфарина, особенно на фоне высоких доз препарата (уровень доказательности 2). Риск материнских кровотечений также повышен (уровень доказательности II). Варфарин не проникает в материнское молоко, а поэтому может применяться в послеродовом периоде (уровень доказательности II).
Терапией выбора до недавнего времени был нефракционированный гепарин (НФГ). НФГ является отрицательно заряженным гликозаминогликаном с вариабельной длиной цепи, не проникает через плаценту и не вызывает эмбриональных осложнений, что позволяет использовать его в течение всей беременности (уровень доказательности II). Лечение НФГ требует продолжительной внутривенной инфузии или подкожного введения препарата два раза в сутки с обязательным лабораторным мониторированием и корректировкой дозы. К неблагоприятным эффектам препарата относят тромбоцитопению (уровень доказательности II), остеопороз и угрозу акушерского кровотечения у 2 % женщин, принимавших терапевтические дозы препарата во время беременности (уровень доказательности III). Длительная терапия НФГ уменьшает костную массу, что может привести к асимптоматическим переломам позвонков у 2,2 % пациентов. Вместе с тем, если продолжительность терапии НФГ превышает 6 месяцев при ежедневной дозе до 20 000 МЕ, частота остеопороза достигает 10 % (уровень доказательности II).
Низкомолекулярные гепарины (НМГ), включая надропарин, заменили НФГ в лечении и профилактике ВТЭ. Их преимущества связывают с более низкой заболеваемостью остеопорозом (уровень доказательности II), повышенной биодоступностью и удлиненным периодом полувыведения. Это позволяет назначать препарат, как правило, 1 раз в сутки без лабораторного мониторирования. Доза НМГ должна быть адаптирована под вес пациента и/или анти-Ха(АХа)-активность (степень доказательности D). НМГ не проникают через плацентарный барьер во втором и третьем триместрах и не увеличивают риск развития мальформации или кровотечений у новорожденных (уровень доказательности II). Частота гепарин-индуцированной тромбоцитопении на фоне применения НМГ не превышает 1 % (уровень доказательности IV). Как НФГ, так и НМГ не нарушают течение беременности. Вместе с тем высокая частота преждевременных родов соотносится с пациентками, которые получали профилактику (уровень доказательности II).
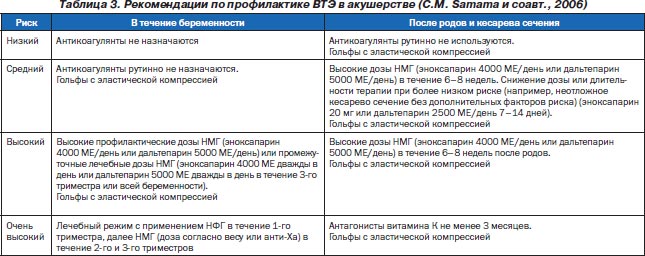
Назначение и длительность лечения при различных клинических ситуациях и категориях риска приведены в табл. 3. Они основаны на доказательствах низкого уровня (уровень IV).
В табл. 3 отсутствуют данные о надропарине, поскольку авторы не изучали его. Вместе с тем в литературе имеются обширные сведения об использовании препарата у беременных [2–4, 7].
Надропарин является низкомолекулярным гепарином со средней молекулярной массой 4,5 кДа. Это смесь гликозаминогликановых цепей, полученных путем деполяризации натрий гепарина слизистой оболочки свиньи. Препарат имеет мультифакторный механизм действия. Его главный — антитромботический — эффект реализуется путем потенцирования антитромбина ІІІ. Последний является природным ингибитором сериновых протеаз в коагуляционном каскаде, включая тромбин (фактор IIа) и фактор Ха.
Надропарин селективно потенцирует ингибирование Ха-фактора в соотношении анти-Ха/анти-IIа как 3,2–3,4. Надропарин также индуцирует продукцию ингибитора тканевого фактора (TFPI), который является мощным природным ингибитором внешнего пути свертывания. TFPI моделирует как негативный обратный механизм действия Ха-фактора, так и комплексные механизмы формирования тромбина. Биодоступность препарата достигает 100 %. Быстро адсорбируясь из места инъекции, он почти полностью растворяется в плазме и выводится с мочой. Длительный период полураспада (3,79 ± 1,46 часа против 2 часов у НФГ) и высокая биодоступность обеспечивают возможность ежедневного назначения препарата без регулярного мониторирования системы гемостаза. Антикоагуляционная активность надропарина оценивается, подобно другим НМГ, по анти-Ха-активности. 1 мл препарата эквивалентен 9500 МЕ АХа (установка европейской фармакопеи).
Обычная профилактическая доза надропарина составляет 0,3 мл (2850 МЕ АХа). Для пациентов с очень высоким риском ее можно увеличивать до 0,6 мл один раз в сутки. Терапевтическая, или лечебная, доза препарата неизменна и составляет 0,1 мл/10 кг (95 МЕ/кг) два раза в день.
Результаты использования НМГ при беременности обобщены в систематических обзорах B.J. Sanson и соавт. (1999); M. Ensom, M.D. Stephenson (1999), M. Bazzan, Donvito (2001), J.S. Ginslerg и соавт. (2001), А.Д. Макацария и соавт. (2003). Большинство авторов считают, что НМГ являются наиболее безопасными препаратами для предупреждения и лечения ВТЭ во время беременности. Так, B.J. Sanson(1999) проанализировал использование надропарина у 208 из 486 беременных. Показания к назначению надропарина включали ВТЭ в анамнезе (149 беременных), лабораторно подтвержденный антифосфолипидный синдром (163 женщины), периодическое невынашивание плода (93), преэклампсию (28), острую ВТЭ (8), механические клапаны сердца (3) и прочие (9). Неблагоприятные исходы беременности зафиксированы в 45 (9,3 %) из 486 беременностей.
G. Daskalaris и соавт. (1997) изучили результаты лечения надропарином у 18 беременных женщин с ТГВ. Все женщины изначально получали НФГ 14 дней, после чего им назначали надропарин в дозе 0,6 мл (6150 МЕ) один раз в день до конца беременности и 1 месяц спустя после родов. Здоровые дети родились в 17 случаях, и одна беременность закончилась абортом в сроке 10 недель. Королевская коллегия акушерства и гинекологии (Великобритания) и Американская коллегия торакальных хирургов (АССР) выделили два возможных варианта лечения ВТЭ в ходе беременности:
1. Весозависимые НМГ в терапевтических дозах для оказания неотложной помощи и при дальнейшем лечении (или альтернативное лечение дозозависимыми НФГ гепаринами в течение трех месяцев);
2. Дозозависимые НФГ для неотложной помощи и лечения.
Антикоагулянтная терапия рекомендуется на всем протяжении беременности и первые шесть недель после родов. При использовании НМГ регулировать их дозу рекомендовано 3 путями:
1) оставлять начальную дозу неизменной на протяжении всей беременности;
2) регулировать дозу согласно весу в течение беременности;
3) регулировать дозу согласно рациону (перед следующей инъекцией) или по пиковому уровню антифактора Ха (через 3–4 часа после инъекции). Пиковый уровень должен быть в диапазоне 0,5–1,2 U/мл. Лучше применять НМГ дважды в день, так как у беременных увеличена почечная экскреция.
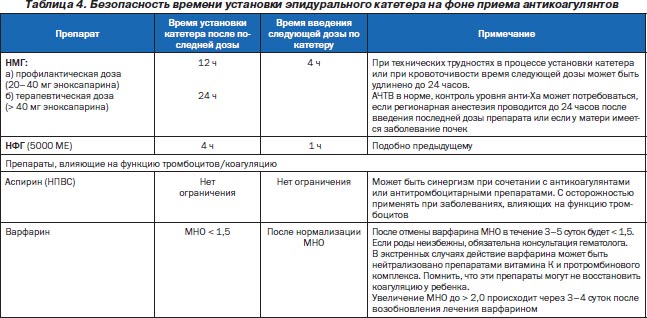
С целью уменьшения риска кровотечения во время родов рекомендуется прекратить лечение антикоагулянтами. Если роды длительные (более 18 часов) или если они не ожидаются в ближайшие три часа, рекомендовано введение профилактической дозы НМГ. При плановом кесаревом сечении прием НМГ прекращают за 12–24 часа. Если время от последней инъекции НМГ менее 12 часов, спинномозговая анестезия противопоказана. Если со времени инъекции НМГ прошло от 12 до 24 часов, возможность спинномозговой анестезии рассматривается индивидуально. Эпидуральная анестезия не показана женщинам, получавшим терапевтические дозы антикоагулянтов. Основные правила безопасности эпидуральной анестезии представлены в табл. 4.
Тромбофилии у матерей обусловливают такие осложнения беременности, как внутриутробная задержка развития, преэклампсия, внутриутробная смерть плода или мертворождение. Поэтому женщины с повторными выкидышами подлежат обязательному обследованию для выявления и лечения врожденных тромбофилий.
Наследственные, или семейные, тромбофилии включают дефициты АТ-III, протеинов С или S, резистентность к активированному протеину С (АПС).
АПС-резистентность является результатом точечной мутации в гене V фактора (фактор Лейдена). F.E. Preston и соавт. (1996) изучали связь между тромбофилией и потерей плода у 1384 женщин (843 — с тромбофилией, 541 — здоровая). Авторы установили, что потеря плода была достоверно большей у женщин с тромбофилией (29,4 против 24,5 %; р = 0,04). Риск мертворождений на фоне тромбофилии достоверно превышал риск выкидышей (3,60 против 1,27 при доверительном интервале 95 %). Количество выкидышей у беременных с дефицитом протеинов С или S на 30–36 % превышало количество их у женщин с тромбофилией и на 200 % превышало количество их у женщин с дефицитом АТ-III или с обоими дефицитами. Z. Boda и соавт. (1998) изучали использование надропарина как средства профилактики ВТЭ у 7 беременных с семейной тромбофилией и ТГВ в анамнезе. Доза надропарина составляла 0,2–0,4 мл 1 раз в день с ежемесячным контролем уровня анти-Ха в плазме крови. Все беременности закончились рождением здоровых детей, не было тромбоэмболических или геморрагических осложнений, тромбоцитопении или подъема печеночных ферментов.
Таким образом, антикоагулянтная терапия у беременных с семейной тромбофилией уменьшает риск потери плода, защищая мать от ВТЭ и предотвращая маточно-плацентарный тромбоз.
Успехи в хирургии сердца увеличили количество женщин с протезами клапанов сердца, имеющих шанс выносить беременность. У беременных с протезами митрального клапана риск тромбоза клапана и периферической эмболии достигает 35 %, поэтому терапия антикоагулянтами является обязательной. Исследования различных типов и способов антикоагулянтой терапии в этой группе женщин позволили выработать 3 схемы профилактики и лечения:
1. Непрямые антикоагулянты (варфарин) всю беременность с заменой на НФГ только в родах.
2. Непрямые антикоагулянты (варфарин) всю беременность с заменой на НФГ с 6-й по 12-ю неделю гестации.
3. НФГ весь период беременности.
Вместе с тем в литературе увеличивается количество сообщений, подтверждающих возможность использования НМГ у беременных с протезами клапанов сердца. Так, L.H. Lee и соавт. (1996) описывают два случая, в которых женщины с искусственным клапаном сердца получали надропарин в дозе 0,1 мл/10 кг 2 раза в день всю беременность с заменой его на НФГ за 2 дня до родов. В день родов терапию не проводили, а после родов женщин перевели на варфарин. При этом не отмечали побочных эффектов, тромбоцитопении или геморрагических осложнений. Незначительное влияние надропарина на плод и мать подтверждено и другими работами.
Тромбопрофилактика изучалась у 20 беременных с шариковым протезом (Y.O. Bitsadze и соавт., 2000). Время протезирования до беременности колебалось от 10 месяцев до 10 лет. Переносимость протеза у 12 женщин была хорошей, удовлетворительной — у 8. Доза надропарина равнялась 0,1 мл/10 кг один раз в день. Лечение начинали от первых признаков тромбофилии и продолжали до родов, возобновляя его через 8 часов после родов в дозе 0,1 мл/10 кг в течение 10 дней. Состояние плода оценивали с помощью УЗИ, кардиомониторирования и допплеровского мониторирования маточно-плацентарного и фетаплацентарного кровотока. У 18 беременных (90 %) родился здоровый ребенок, у двух наблюдалась легкая гипотрофия плода. Вес детей варьировал от 2500 до 3700 граммов. Признаков тромбоцитопении, геморрагического синдрома или тромбофилии не наблюдалось.
Большинство иммуноопосредованных тромбозов обусловлено APS, для которого характерна циркуляция антител в русле. Общепризнано, что АР-антитела у беременных повышают риск тромбозов и прерываний беременности. Эти антитела принадлежат к LgG, LgM и LgA классам. Распространенность АР-антител у женщин с осложненной беременностью колеблется от 11 до 61 % против 2 % у женщин с неосложненной беременностью, причем угроза потери плода превышает 80 %.
З. Янкова, М. Богданова (1999) описали клинический случай ведения 38-летней женщины, которая получала антикоагулянты после тромбоэмболии легочной артерии (ТЭЛА) и у которой было два выкидыша в анамнезе. Наличие у нее антикардиолипиновых антител было подтверждено лабораторно. При диагностике третьей беременности женщине были отменены антикоагулянты и назначен надропарин в дозе 0,3 мл в сутки до двадцатого дня послеродового периода. Беременность завершилась рождением здорового ребенка. В другом исследовании представлены результаты изучения безопасности и эффективности применения надропарина у 85 беременных с APS. Женщины были разделены на 3 группы:
1-я группа (n = 26) — женщины с осложненным акушерским анамнезом в сроке беременности до 12 недель;
2-я группа (n = 29) — женщины с осложненным акушерским анамнезом в сроке беременности 12–20 недель;
3-я группа (n = 30) — женщины без клинических признаков APS, но с осложненной беременностью и циркуляторными АР-антителами.
Все пациентки 1-й группы и 20 из 2-й группы получали надропарин (57 МЕ/кг ежедневно). 9 женщин из 2-й группы получали НФГ всю беременность и 7–10 послеродовых суток. Женщины 3-й группы получали надропарин в сочетании с аспирином (50–80 мг/сутки). Беременность закончилась успешно в 84 случаях. У одной пациентки была внутриутробная смерть плода. Частота преждевременных родов была выше у женщин, которые получали надропарин со второго триместра (17,6 против 7,6 %). Поздний токсикоз легкой или средней степени тяжести отмечался у 19,2 % в 1-й группе и у 27,6 % — во 2-й. Гипотрофия плода отмечена у 30 % беременных 1-й группы и у 35,7 % — во 2-й — при полном отсутствии ее в 3-й группе. При исследовании пуповинной крови у 15 женщин ни в одном случае не было выявлено АР-антител и увеличения показателей коагуляции, тогда как повышенная агрегация тромбоцитов выявлена в двух случаях. Ни у одной женщины не возникло гепарин-индуцированной тромбоцитопении или ВТЭ.
Таким образом, раннее назначение и длительное применение надропарина у беременных с APS позволяет предупредить потерю плода, возникновение ВТЭ, способствует нормальному развитию плаценты и снижает риск преждевременных родов. Длительное применение надропарина требует лабораторного контроля количества тромбоцитов и, при необходимости, корректировки дозы надропарина в сроке 28–30 недель беременности. Более ранний лабораторный контроль показан только при наличии в анамнезе абортов, токсемии или плацентарной недостаточности.
Инфекция простого герпеса может быстро распространяться от матери к плоду, нарушать развитие и вызывать смерть последнего. Женщины с рецидивирующей герпес-инфекцией имеют высокий риск развития APS, который приводит к ДВС-синдрому, тромбоэмболическим осложнениям и к потере плода. Частота неблагоприятных исходов беременности у женщин с простым герпесом в 4–15 раз выше, чем у здоровых женщин. От 20 до 51,5 % женщин с хронической вирусной инфекцией также имеют APS. Это обусловливает иммунные нарушения, последствиями которых являются тромбоз, уменьшение плацентарного кровотока, преждевременные роды и потеря плода. Стандартная терапия у беременных с APS состоит из антикоагулянтов, антитромбоцитарных препаратов в комбинации с кортикостероидами. Вместе с тем кортикостероиды противопоказаны при ассоциации герпес-инфекции с иммунодефицитом, так как они способствуют репликации вируса и усугубляют APS. Поэтому терапией выбора у таких женщин будет антикоагулянт, который стабилизирует гемостаз и не имеет негативного влияния на иммунную систему.
Исследования эффектов надропарина были проведены Н.В. Долгушиной и А.Д. Макацария (2001) у 54 беременных с генитальным герпесом и APS. У пациенток, получавших надропарин в ходе беременности, не было случаев неонатальной герпетической инфекции, а количество осложнений беременности было меньшим.
Таким образом, надропарин является НМГ, который прост в употреблении, ассоциируется с низкими патологией плода и осложнениями у матери, безопасен как во время беременности, так и вне ее. Ведение беременных пациенток с повышенным риском ВТЭ или наличием ее, с повышенным риском выкидыша, с механическими клапанами сердца допускает применение надропарина в профилактической или лечебной дозе для уменьшения тромбофилических нарушений и предотвращения потери плода.
1. Clyburn Р., Collis R., Harries S., Davies S. Obstetric anaesthesia. — Oxford University Press, 2008.
2. Jacobsen A.F., Sandset P.M., Arnesen H. et al. Anticoagulant treatment in a hypercoagulable woman with mechanical prosthetic mitral valve — failure of high-dose low molecular weight heparin (LMWH) treatment // 2nd Int. Symp. on Women’s Health Issues in Thrombosis and Haemostasis, Vienna, February 2007, Thrombosis Research. — 2007. — 119(Suppl. 1). — S115. Abstract 66.
3. Samama C.M., Albaladejo P., Benhamou D. et al. // European Journal of Anesthesiology. — 2006. — 23. — 95-116.
4. Makatsaria A.D., Bitsadze V.O., Dolgushina N.V. Use of the Low-Molecular-Weight Heparin Nadroparin During Pregnancy: A Review published: 04/02/2003. htpp://www.medscape.com/viewarticle/450389
5. Ginsberg J.S., Greer I., Hirsh J. Use of antithrombotic agents during pregnancy // Chest. — 2001. — 119. — 122-31S.
6. Bazzan M., Donvito V. Low molecular weight heparin during pregnancy // Thromb. Res. — 2001. — 101. — V175-86.
7. Sanson B.J., Lensing A.W., Prins M.H., Ginsberg J.S., Barkagan Z.S., Lavenne-Pardonage E. et al. Safety of low-molecular-weight heparin in pregnancy: a systematic review // Thromb. Haemost. — 1999. — 81. — 668-72.
8. Ensom M., Stephenson M.D. Low molecular weight heparins in pregnancy // Pharmacotherapy. — 1999. — 19. — 1013-25.
9. Tarn W.H., Wong K.S., Yuen P.M., Leung T.N., Li C.Y. Low molecular weight heparin and thromboembolism in pregnancy // Lancet. — 1999. — 353-932.
10. Daskalakis G., Antsaklis A., Papageorgiou I., Michalas S. Thrombosis prophylaxis after treatment during pregnancy // Eur. J. Obstet. Gynecol. Reprod. Biol. — 1997. — 74. — 165-7.
11. Dolgyshina N.V., Makatsaria A.D. The use of low molecular weight heparin in pregnant patients with herpes and antiphospholipid syndrome // The Herald of Russian Association of Obstefricians and Gunecologists. — 2001. — 1. — 41-6.
