Газета «Новости медицины и фармации» 16(336) 2010
Вернуться к номеру
Место амоксициллина/клавуланата при инфекциях нижних дыхательных путей
Авторы: М.А. Куценко, А.Г. Чучалин, НИИ пульмонологии МЗ РФ, г. Москва
Версия для печати
В 1969 г. эпидемиолог и министр здравоохранения США Вильям Стюарт в послании к Конгрессу заявил: «Пришло время закрыть книгу инфекционных болезней. Война против эпидемий выиграна» [1].
Действительно, расцвет открытия новых классов антибиотиков и производства вакцин пришелся как раз на 50–60-е годы XX в., и казалось, что человечество действительно выигрывает в этой невидимой перманентной борьбе, хотя ее долговременный характер определился еще до первого клинического использования антибиотиков, а именно с открытием у микроорганизмов резистентности к антибактериальным препаратам [2].
Именно широкое развитие резистентности к антибиотикам среди микроорганизмов не позволяет «закрыть книгу», о которой говорил В. Стюарт, а наоборот, заставляет «прочитывать» ее снова и снова, открывая вновь возникающие страницы.
И если в 1940 г. был известен лишь один механизм развития устойчивости, то в настоящий момент мы говорим о том, что существует как минимум пять групп механизмов резистентности микроорганизмов к антибиотикам:
1) ферментативная инактивация антибактериального агента;
2) модификация мишени действия антибактериального агента;
3) эффлюкс (механизм активного удаления антибиотика из бактериальной клетки);
4) нарушение проницаемости оболочки бактериальной клетки;
5) защита мишени (синтез белков, закрывающих мишень для антибактериального агента).
Пожалуй, наиболее распространенным механизмом приобретенной защиты от антибиотиков является выработка ферментов, способных разрушать молекулярную структуру антибактериального агента, лишая его своих свойств. Среди инактивирующих ферментов известны трансферазы, эстеразы и представители гидролаз — β-лактамазы [3].
Именно выработка β-лактамаз, катализирующих расщепление β-лактамного кольца у пенициллинов, цефалоспоринов и других β-лактамов (монобактамов, карбапенемов и т.д.), является самым частым механизмом в развитии резистентности к β-лактамным антибиотикам у грамположительных и грамотрицательных микроорганизмов (например, S.aureus, H.influenzae, M.catarrhalis, E.coli, K.pneumoniae и др.) [4, 5]. Этот механизм резистентности микроорганизмов оказался наиболее распространенным и достаточно эффективным, что привело к эволюционированию β-лактамов в сторону не только расширения спектра антибактериальной активности и улучшения фармакокинетических характеристик, но и преодоления резистентности возбудителей.
Поэтому в качестве одного из эффективных способов борьбы с резистентностью микроорганизмов было предложено комбинировать β-лактамные антибиотики с каким-либо ингибитором β-лактамаз. Так в клинической практике появилась группа защищенных (или комбинированных) β-лактамов. Включение ингибитора значительно расширяет спектр микробиологической активности антибиотика и во многих случаях позволяет преодолеть приобретенную микроорганизмом резистентность. Среди ингибиторов β-лактамаз наибольшее применение получили клавулановая кислота, сульбактам и тазобактам.
Исторически первым анти-β-лактамазным агентом была клавулановая кислота, полученная в начале 70-х гг. XX в. из культуры грибка Streptomyces clavuligerus в результате исследований способности микроорганизмов продуцировать естественные ингибиторы β-лактамазы [6]. Приблизительно в это же время (1972) появился новый препарат группы пенициллинов — амоксициллин — благодаря целенаправленной разработке полусинтетического аминопенициллина с высокой биодоступностью при пероральном приеме, т.к. его предшественник ампициллин обладал биодоступностью лишь в 40 %, которая еще и снижалась при приеме пищи. Его преимущества перед ампициллином и возможность перорального назначения в отличие от существовавших на тот момент цефалоспоринов определили выбор для создания комбинированного препарата — ингибитора β-лактамаз и β-лактамного антибиотика [7].
Возможность применения сочетания амоксициллина и клавулановой кислоты (АКК) для лечения пациентов с инфекциями дыхательных путей была показана еще при регистрационных исследованиях. В них препарат продемонстрировал высокую эффективность против основных респираторных патогенов, таких как S.pneumoniae, S.pyogenes, H.influenzae, M.catarrhalis и S.aureus.
Следует отметить, что несмотря на тот факт, что внебольничные инфекции нижних дыхательных путей (ИНДП) способны вызывать более сотни патогенов, основную роль играет не так уж много микроорганизмов (табл. 1, 2).
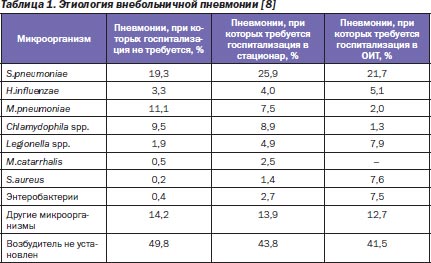
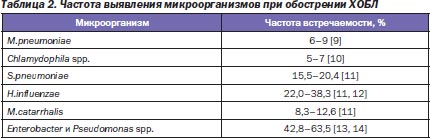
Как видно из табл. 1, 2, микробиологические характеристики внебольничной пневмонии (ВП) и обострения хронического бронхита/хронической обструктивной болезни легких (ХОБЛ) во многом совпадают, при этом их можно разделить на три основные клинические группы:
1) микроорганизмы, чувствительные к β-лактамным антибиотикам (S.pneumoniae, H.influenzae, M.catarrhalis, S.aureus, энтеробактерии), встречающиеся более чем в половине всех микробиологически диагностированных случаев;
2) внутриклеточные возбудители (M.pneumoniae, Chlamydophila spp., Legionella spp.), являющиеся причиной 1/5 случаев инфекций нижних дыхательных путей;
3) микроорганизмы, для которых сложен эмпирический подбор антибактериального препарата.
Учитывая большой вес в этиологической структуре инфекций нижних дыхательных путей микроорганизмов, чувствительных к β-лактамным антибиотикам, эта группа на протяжении многих лет оставалась группой выбора для их лечения. Однако снижение чувствительности S.pneumoniae к пенициллину, впервые отмеченное в 1967 г., впоследствии значительно распространившееся и постоянно нарастающее к концу ХХ в., а также появление штаммов других микроорганизмов, способных продуцировать β-лактамазы, привели к тому, что значимость β-лактамных антибиотиков стала снижаться.
Действительно, по данным исследования Alexander Project за 1998–2000 гг. [15], резистентность к пенициллину (МПК ≥ ≥ 2 мг/л) среди 8882 изолятов S.pneumoniae составила 18,2 %, тогда как, по данным предыдущей фазы этого исследования [16], в 1997 г. — 14,1 %, а в 1996 г. — всего 10,4 %. При этом устойчивость S.pneumoniae к пенициллину довольно часто ассоциируется с резистентностью к другим группам АМП (макролидам, тетрациклинам, ко-тримоксазолу).
Высокий уровень резистентности к незащищенным аминопенициллинам показали H.influenzae и M.catarrhalis. Так, резистентность H.influenzae к аминопенициллинам, обусловленная продукцией плазмидных β-лактамаз, составляет в среднем 16,9 %, а M.catarrhalis — 92,1 % [15].
Конечно, распространенность резистентных штаммов в различных регионах мира может сильно различаться: по данным того же исследования Alexander Project, распространенность пенициллинорезистентного пневмококка варьирует от 0 до 56 %, а резистентных штаммов H.influenzae — от 4,2 до 29,6 % [15]. Состояние резистентности основных респираторных патогенов в России в 1999–2005 гг. было изучено в ходе многоцентровых проспективных исследований ПеГАС I и ПеГАС II. Согласно полученным данным, частота выделения пневмококков, нечувствительных к пенициллину, в нашей стране не превышает 10 % [17]. Сохраняется высокая активность аминопенициллинов в отношении H.influenzae: только 4,7 % штаммов H.influenzae, включенных в исследование ПеГАС II в 2003–2005 гг., оказались устойчивыми к полусинтетическим пенициллинам [18], однако многие исследователи считают, что по мере использования незащищенных пенициллинов уровень резистентности микроорганизмов к ним в Российской Федерации будет возрастать.
С этой точки зрения особое значение приобретает использование защищенных аминопенициллинов при инфекциях нижних дыхательных путей. Как показали указанные ранее исследования, резистентность к амоксициллину/клавуланату основных возбудителей ИНДП не увеличивается с течением времени и препарат сохраняет свою высокую антибактериальную эффективность. Так, количество чувствительных к амоксициллину/клавуланату штаммов S.pneumoniae, по данным Alexander Project, составило 95,5 % (несколько выше показатель только у респираторных фторхинолонов), H.influenzae — 99,6 %, а M.catarrhalis — 100 % [15]. В исследованиях ПеГАС в России только 0,5 % штаммов S.pneumoniae были устойчивы к амоксициллину/клавуланату, резистентных же штаммов H.influenzae не было обнаружено [17, 18].
Широкий спектр действия, включая большинство грамположительных и грамотрицательных микроорганизмов, с минимальным риском резистентности в сочетании с достижением высоких концентраций в крови и мокроте, низкой токсичностью и возможностью проведения ступенчатой терапии позволяет использовать амоксициллин/клавуланат в качестве препарата выбора для эмпирической терапии инфекций нижних дыхательных путей.
Клиническая эффективность амоксициллина/клавуланата при ИНДП, даже при тяжелом течении заболевания, была доказана многими исследованиями. Так, в исследовании с участием 50 пациентов с пневмонией тяжелого течения, требующей ведения в отделении интенсивной терапии, в 76 % случаев оказалась эффективной монотерапия амоксициллином/клавуланатом [19].
Амоксициллину/клавуланату отведено значительное место в современных схемах антибиотикотерапии ВП у взрослых, причем назначение может быть и пероральным, и парентеральным, и ступенчатым — в зависимости от тяжести течения пневмонии. Именно амоксициллин/клавуланат представляет класс защищенных аминопенициллинов в Российских рекомендациях по ведению пациентов с ВП. Он является препаратом выбора в случаях амбулаторной терапии пациентов, имеющих факторы риска, такие как возраст старше 60 лет и/или наличие сопутствующих заболеваний (хронический бронхит/ХОБЛ, сахарный диабет, застойная сердечная недостаточность, хроническая почечная недостаточность, заболевания печени), т.к. именно у таких пациентов возрастает вероятность наличия пенициллин-резистентных S.pneumoniae, H.influenzae, S.aureus и бактерий семейства Enterobacteriaceae [20].
В случае госпитализации пациенту с пневмонией нетяжелого течения проводится, как правило, ступенчатая терапия амоксициллином/клавуланатом (первые дни — парентерально, затем — per os), при тяжелом течении проводится внутривенное введение препарата.
Сравнительные исследования амоксициллина/клавуланата с другими антибактериальными агентами для лечения пневмонии показали его высокую клиническую и микробиологическую эффективность. Так, при сравнении с эритромицином и спарфлоксацином при пневмонии среднетяжелого течения успех был достигнут у 87 % пациентов в группе амоксициллина/клавуланата [21]. Амоксициллин/клавуланат не уступает по эффективности и новым антибактериальным агентам. В исследовании Bonvehi et al. было показано, что частота клинического и микробиологического выздоровления пациентов с ВП выше в группе амоксициллина/клавуланата (93 %) по сравнению с группой кларитромицина (91 %) [36]. По своей эффективности при лечении пациентов с ВП амоксициллин/клавуланат не уступает респираторным фторхинолонам. Leophonte et al., проведя сравнительное исследование, сделали следующий вывод: «Гемифлоксацин клинически, бактериологически и рентгенологически эффективен так же, как амоксициллин/клавуланат для лечения внебольничной пневмонии предположительно пневмококковой этиологии» [37].
Большим преимуществом амоксициллина/клавуланата является то, что оптимизированные для максимальной эрадикации возбудителя параметры фармакокинетики/фармакодинамики позволяют не только увеличить частоту клинического и бактериологического излечения, но и замедлить развитие и распространение резистентных штаммов.
Резистентность к β-лактамам S.pneumoniae развивается за счет изменений пенициллиносвязывающих белков, что приводит к снижению аффинности к антибиотикам данной группы. β-лактамы различаются по своей способности к спонтанной селекции резистентных штаммов и к повышению резистентности штаммов с уже сниженной чувствительностью к β-лактамам. Так, в исследовании Sifaoui et al. показано, что пенициллины (в том числе амоксициллин/клавуланат) обладают относительно низким потенциалом селекции мутантных штаммов S.pneumoniae с незначительным повышением минимальной подавляющей концентрации (МПК). Напротив, некоторые цефалоспорины (цефиксим, цефуроксим, цефпродоксим, цефотаксим и цефаклор) индуцировали наряду с высокой частотой резистентных штаммов значительное повышение МПК, которая тем не менее для пенициллинов оставалась низкой или даже снижалась [31, 35].
Значительную роль амоксициллин/клавуланат играет и в лечении пациентов с обострением хронического бронхита/хронической обструктивной болезни легких. Международные рекомендации по ведению пациентов с обострением ХОБЛ предусматривают назначение амоксициллина/клавуланата как единственного препарата выбора для перорального применения в случае обострения средней степени тяжести у пациентов с факторами риска (к препаратам 2-го ряда отнесены респираторные фторхинолоны) и одним из альтернативных препаратов в случаях легкого обострения ХОБЛ, при том что к препаратам выбора в данном случае отнесены незащищенные пенициллины, тетрациклин и сульфаниламиды [34]. Выбор альтернативного антибиотика (амоксициллин/клавуланат, современные макролиды, цефалоспорины 2–3-го поколений) как препарата для начала терапии может быть обусловлен клинической ситуацией или особенностями локальной эпидемиологической картины.
Учитывая тот факт, что в РФ большое распространение для лечения обострений ХОБЛ наряду с амоксициллином/клавуланатом получили современные макролиды и респираторные фторхинолоны, представляют интерес результаты сравнительных исследований этих препаратов.
В 1995 г. Beghi сравнил эффективность амоксициллина/клавуланата и азитромицина в лечении обострения хронического бронхита (1021). Преимущество амоксициллина/клавуланата в достижении эрадикации возбудителей было столь значительным, что вслед за этим исследованием появилась целая серия работ по сравнению эффективности наиболее современных макролидов (азитромицин и кларитромицин) с амоксициллином/клавуланатом. Во всех указанных исследованиях амоксициллин/клавуланат превосходил макролиды по уровню эрадикации возбудителя в случаях, вызванных S.pneumoniae и H.influenzae, а по уровню эрадикации M.catarrhalis препараты были сравнимы [23–25].
Проводились сравнительные исследования амоксициллина/клавуланата и с респираторными фторхинолонами: левофлоксацином [26], моксифлоксацином [27, 28] и гемифлоксацином [29]. Все эти исследования показали сравнимую клиническую эффективность препаратов. При оценке микробиологической эффективности амоксициллин/клавуланат имел значительное преимущество перед левофлоксацином в отношении эрадикации H.influenzae (100 vs 83 %), схожие показатели в отношении M.catarrhalis (84 vs 83 %) и уступал по уровню эрадикации S.pneumoniae (77 vs 88 %) [26].
В 2007 г. Siempos et al. провели метаанализ сравнительных исследований применения амоксициллина/клавуланата, респираторных фторхинолонов и макролидов при обострении хронического бронхита и сделали следующее заключение: «Макролиды, хинолоны и амоксициллин/клавуланат могут считаться эквивалентными для лечения пациентов с острым бактериальным обострением хронического бронхита» [30].
В то же время следует отметить тот факт, что амоксициллин/клавуланат обладает минимальными селективными свойствами по отношению к S.pneumoniae и H.influenzae в отличие от макролидов и фторхинолонов. Так, G.A. Pankuch et al. [31] сравнили селекцию резистентных штаммов при экспозиции амоксициллина/клавуланата по сравнению с азитромицином. Культивирование с амоксициллином/клавуланатом привело к повышению МПК (с 0,008 до 1,25 мг/л) только у одного из шести чувствительных к пенициллину штаммов, причем у остальных штаммов МПК оставалась стабильной. Азитромицин же легко вызывал селекцию резистентных штаммов: МПК увеличилась у 8 штаммов из 10 с 0,03–4 до 0,5–256 мг/л.
Также была доказана высокая селекционная активность в отношении пневмококка и для фторхинолонов. Было установлено, что МПК для S.pneumoniae при использовании гемифлоксацина повышался у 6 штаммов из 16, тровафлоксацина — у 9 из 16, гатифлоксацина — у 13 из 16 и левофлоксацина — у 12 из 16.
Подобные многоэтапные исследования по селекции резистентности проводились также для Н.influenzae. Амоксициллин/клавуланат не индуцировал селекцию резистентных штаммов в отличие от азитромицина (10 из 10 штаммов) и кларитромицина (8 из 10 штаммов). Кроме того, при экспозиции азитромицина и кларитромицина очень высокая МПК (более 256) отмечена у 6 из 10 штаммов [33].
Немаловажным фактором выбора антибактериального препарата является наличие побочных эффектов. Амоксициллин/клавуланат обычно хорошо переносится. Наиболее часто из побочных эффектов отмечаются расстройства со стороны желудочно-кишечного тракта, в первую очередь диарея, частота которой при использовании амоксициллина/ клавуланата достигает 24 % [38]. Обширный анализ безопасности и переносимости провели Neu и соавт. [39]. Авторы оценили данные по безопасности из 374 отчетов клинических испытаний амоксициллина/клавуланата, опубликованных за период 1979–1992 гг., включивших 38 500 пациентов. Во всех исследованиях применяли режим дозирования 3 раза/сут. Побочные эффекты отсутствовали у большинства пациентов; у 8,4 % отмечены диспептические явления. Нарушения со стороны ЖКТ (в первую очередь диарея) в основном связывают с действием клавулановой кислоты, поэтому стали появляться новые формы, позволяющие уменьшить ее суточную и курсовую дозы. В исследовании A. Calver et al. с участием 1191 взрослого пациента показано, что частота побочных эффектов достоверно не различается при назначении амоксициллина/клавуланата 875/125 мг 2 раза/сут или 500/125 мг 3 раза/сут. Тем не менее у пациентов, получавших препарат 2 раза/сут, наблюдали тенденцию к уменьшению частоты диареи (2,9 против 4,9 %, р = 0,28) [40].
Таким образом, амоксициллин/клавуланат, за счет своей уникальной комбинации проявляющий широкий спектр антимикробной активности, а также из-за удовлетворительного профиля безопасности продолжает оставаться ценным клиническим инструментом для лечения инфекций дыхательных путей.
Печатается в сокращении
Впервые опубликовано в «Русском медицинском журнале» 18 марта 2010 г., т. 18, 6 (Человек и лекарство. Часть 2)
Печатается при поддержке компании «ГлаксоСмитКляйн»
AGMT/10/UA/17.09.2010/3942
1. Brad Spellberg Dr. William H. Stewart. Mistaken or Maligned? // Clinical Infectious Diseases. — 2008. — 47. — 294-294.
2. Abraham E.P., Chain E. An enzyme from bacteria able to destroy penicillin // Nature. — 1940. — 373. — 837
3. Антибактериальная терапия: Практическое руководство / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — М.: РЦ «Фармединфо», 2000.
4. Страчунский Л.С., Козлов С.Н. Пенициллины. Часть II: Ингибиторзащищенные и комбинированные пенициллины // Клиническая антимикробная химиотерапия. — 2000. — 2(2).
5. Du Bois S.K., Marriott M.S., Amyes S.G. TEM- and SHV-derived extended-spectrum β-lactamases: relationship between selection, structure and function // J. Antimicrob. Chemother. — 1995. — 35. — 7-22.
6. Brown A.G., Butterworth D., Cole M., Hanscomb G., Hood J.D., Reading C., Rolinson G.N. Naturally-occurring β-lactamase inhibitors with antibacterial activity // J. Antibiot. — 1976. — 29. — 668-669.
7. Cars O. Efficicy of beta-lactam antibiotics: integration of pharmacokinetics and pharmacodynamics // Diagnostic Microbyology and Infectious Disease. — 1997. — 27. — 29-34.
8. Woodhead M. Community acquired pneumonia in Europe: Causative pathogens and resistance patterns // Eur. Respir. J. — 2002. — 20. — 20-27.
9. Mogulkoc N., Karakurt S., Isalska B. et al. Acute purulent exacerbation of chronic obstructive pulmonary disease and Chlamydia pneumoniae infection // Am. J. Respir. Crit. Care Med. — 1999. — 160. — 349-353.
10. Blasi F., Legnani D., Lombardo V.M. et al. Chlamydia pneumoniae infection in acute exacerbations of COPD // Eur. Respir. J. — 1993. — 6. — 19-22.
11. Leeper K.V., Jones A.M., Tillotson G. The changing bacterial etiology of chronic obstructive pulmonary disease // Chest. — 1997. — 112. — 21S.
12. Soler N., Torres A., Ewig S. et al. Bronchial microbial patterns in severe exacerbations of chronic obstructive pulmonary disease requiring mechanical ventilation // Am. J. Respir. Crit. Care Med. — 1998. — 157. — 1498-1505.
13. Eller J., Ede A., Schaberg T., Niederman M.S. et al. Infective exacerbations of chronic bronchitis: relation between bacteriologic etiology and lung function // Chest. — 1998. — 113. — 1542-8.
14. Miravitlles M., Espinosa C., Fernandez-Laso E. et al. Relationship between bacterial flora in sputum and functional impairment in patients with acute exacerbations of COPD. Study Group of Bacterial Infection in COPD. // Chest. — 1999. — 116. — 40-46.
15. Jacobs M.R., Felmingham D., Appelbaum P.C. et al. The Alexander Project 1998–2000: susceptibility of pathogens isolated from community-acquired respiratory tract infections to commonly used antimicrobial agents // J. Antimicrob. Chemother. — 2003. — 52. — 229-246.
16. Felmingham D., Gruneberg R.N. & the Alexander Project Group. The Alexander Project 1996–1997: latest susceptibility data from this international study of bacterial pathogens from community-acquired lower respiratory tract infections // J. Antimicrob. Chemother. — 2000. — 45. — 191-203.
17. Козлов Р.С., Сивая О.В., Шпынев К.В. и др. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999–2005 гг.: результаты многоцентровых проспективных исследований ПеГАС–I и ПеГАС–II // Клин. микробиол. антимикр. химиотер. — 2006. — 8. — 1. — 33-47.
18. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. — М.: Боргес, 2002. — 33-38.
19. Cioffi R., Turco D., Alfano B., Di Salvatore F., Gnasso P., Mastroianni S. Treatment of respiratory tract infections with augmentin // J. Chemother. — 1989 Jul. —1 (4 Suppl.). — 766-7.
20. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике. — М.: OOO «Издательский дом «М-Вести», 2006. — 76 с.
21. Lode H., Garau J., Grassi C., Hosie J., Huchon G., Legakis N., Segev S., Wijnands G. Treatment of community-acquired pneumonia: a randomized comparison of sparfloxacin, amoxicillin-clavulanic acid and erythromycin // Eur. Respir. J. — 1995 Dec. — 8 (12). — 1999-2007
22. Beghi G., Berni F., Carratu L. et al. Efficacy and tolerability of azithromycin versus amoxicillin/clavulanic acid in acute purulent exacerbation of chronic bronchitis // J. Chemother. — 1995. — 7. — 146-152.
23. Anzueto A., Fisher C.L. Jr., Busman T., Olson C.A. Comparison of the efficacy of extended-release clarithromycin tablets and amoxicillin/clavulanate tablets in the treatment of acute exacerbation of chronic bronchitis // Clin. Ther. — 2001. — 23. — 72-86.
24. Martinot J.B., Carr W.D., Cullen S. et al. A comparative study of clarithromycin modified release and amoxicillin/clavulanic acid in the treatment of acute exacerbation of chronic bronchitis // Adv. Ther. — 2001. — 18. — 1-11.
25. Hoepelman I.M., Mollers M.J., van Schie M.H. et al. A short (3-day) course of azithromycin tablets versus a 10-day course of amoxicillin-clavulanic acid (co-amoxiclav) in the treatment of adults with lower respiratory tract infections and effects on long-term outcome // Int. J. Antimicrob. Agents. — 1997. — 9. — 141-146.
26. Martinez F.J., Grossman R.F., Zadeikis N. et al. Patient stratification in the management of acute bacterial exacerbation of chronic bronchitis: the role of levofloxacin 750 mg // Eur. Respir. J. — 2005. — 25. — 1001-1010.
27. Starakis I., Gogos C.A., Bassaris H. Five-day moxifloxacin therapy compared with 7-day co-amoxiclav therapy for the treatment of acute exacerbation of chronic bronchitis // Int. J. Antimicrob. Agents. — 2004. — 23. — 129-137.
28. Schaberg T., Ballin I., Huchon G. et al. A multinational, multicentre, non-blinded, randomized study of moxifloxacin oral tablets compared with co-amoxiclav oral tablets in the treatment of acute exacerbation of chronic bronchitis // J. Int. Med. Res. — 2001. — 29. — 314-328.
29. File T., Schlemmer B., Garau J., Lode H., Lynch S., Young C. Gemifloxacin versus amoxicillin/clavulanate in the treatment of acute exacerbations of chronic bronchitis. The 070 Clinical Study group // J. Chemother. — 2000. — 12. — 314-325.
30. Siempos I., Dimopoulos G., Korbila I., Manta K. and Falagas M. Macrolides, quinolones and amoxicillin/clavulanate for chronic bronchitis: a meta-analysis // Eur. Respir. J. — 2007. — 29. — 1127-1137.
31. Pankuch G.A., Jueneman S.A., Davies T.A., Jacobs M.R., Appelbaum P.C. In vitro selection of resistance to four beta-lactams and azitromycin in S.pneumoniae // Antimicrob. Agents. Chemother. — 1998. — 42. — 2914-2918.
32. Nagai K., Davies T.A., Dewasse B.E., Jacobs M.R., Appelbaum P.C. Single- and multi-step resistance selection study of gemifloxacin compared with trovafloxacin, ciprofloxacin, gatifloxacin and moxifloxacin in Streptococcus pneumoniae // Journal of Antimicrobial Chemotherapy. — 2001. — 48. — 365-374.
33. Clark C., Bozdogan B., Peric M., Dewasse B., Jacobs M.R., Appelbaum P.C. In vitro selection of resistance in Haemophilus influenzae by amoxicillin-clavulanate, cefpodoxime, cefprozil, azithromycin, and clarithromycin // Antimicrob. Agents Chemother. — 2002 Sep. — 46 (9). — 2956-62.
34. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Updated 2009. — MCR Inc., 2009. — 93 p.
35. Sifaoui F., Kitzis M.-D. & Gutmann L. In vitro selection of one-step mutants of Streptococcus pneumoniae resistant to different oral β-lactam antibiotics is associated with alterations of PBP2x // Antimicrobial Agents and Chemotherapy. — 1996. — 40. — 152-156.
36. Bonvehi P., Weber K., Busman T., Shortridge D., Notario G. Comparison of Clarithromycin and Amoxicillin/Clavulanic Acid for Community-Acquired Pneumonia in an Era of Drug-Resistant Streptococcus pneumoniae // Clin. Drug Investig. — 2003. — 23 (8). — 491-501.
37. Leophonte P., File T., Feldman C. Gemifloxacin once daily for 7 days compared to amoxicillin/clavulanic acid thrice daily for 10 days for the treatment of community-acquired pneumonia of suspected pneumococcal origin // Respir. Med. — 2004 Aug. — 98 (8). — 708-20.
38. White AR, Kaye C, Poupard J, et al. Augmentin (amoxicillin/clavulanate) in the treatment of community–acquired respiratory tract infection: a review of the continuing development of an innovative antimicrobial agent. J Antimicrob Chemother 2004;53 (suppl. 1):3–20.
39. Neu H.C., Wilson A.P.R. & Gruneberg R.N. Amoxicillin/clavulanic acid — a review of its efficacy in over 38,500 patients from 1979–1992 // J. Chemother. — 1993. — 5. — 67-93.
40. Calver A.D., Walsh N.S., Quinn P.F. et al. Dosing of amoxicillin/clavulanate given every 12 hours is as effective as dosing every 8 hours for the treatment of lower respiratory tract infection // Clin. Infect. Dis. — 1997. — 24. — 570-4.
