Газета «Новости медицины и фармации» Инфекционные болезни (330) 2010 (тематический номер)
Вернуться к номеру
Ієрсиніоз: клініко-епідеміологічні аспекти
Авторы: О.М. Домашенко, Донецький національний медичний університет ім. М. Горького
Версия для печати
Ієрсиніоз належать до числа значно поширених інфекційних захворювань, у міру вивчення яких були описані різноманітні клінічні форми, що відрізняються тяжкістю, тривалістю перебігу, залученням до патологічного процесу різних органів і систем. Захворюваність на ієрсиніоз дуже поширилася. Протягом останніх десятиліть ХХ століття висока спорадична захворюваність і спалахи ієрсиніозу спостерігалися в багатьох країнах Західної Європи, особливо в Бельгії, Данії, Фінляндії, а також у Північній Америці і країнах Африки [1]. З моменту введення офіційної реєстрації (1986 р.) ієрсиніоз був виявлений на всіх адміністративних територіях України, при цьому рівень захворюваності визначався не стільки природногеографічними, скільки соціальноекономічними умовами [2]. Захворюваність на ієрсиніоз, що відповідає середньому й високому рівням, реєструвалася майже повсюдно, без чітко окреслених територіальних зв’язків, але була переважно спорадичною (90,2 %). Відносно рідко виникали групові захворювання в родинах і дитячих колективах. Найбільш висока захворюваність на ієрсиніоз відзначалася в Чернігівській, Харківській і Донецькій областях, а найнижча — у Волинській, Львівській, Закарпатській, Хмельницькій, Черкаській, Миколаївській, Сумській областях, а також Автономній Республіці Крим. За офіційними даними МОЗ України, захворюваність на ієрсиніоз коливається в межах 0,56–0,24 на 100 000 населення. Серед хворих на гострі кишкові інфекції виявляється від 6 до 10,8 % хворих на ієрсиніоз [3, 4], однак більша частина цих захворювань не діагностується або реєструється під іншими діагнозами [5].
Збудник кишкового ієрсиніозу виявлений у США у 30х роках минулого століття [6]. Окремі випадки цієї інфекції спостерігалися в різних країнах Європи, а також Японії і країнах Африки в 60ті роки ХХ століття. Однак уже до періоду 1976–1983 рр. число хворих на кишковий ієрсиніоз у багатьох країнах різко зросло (у Великобританії, наприклад, у 150 разів), наближаючись або навіть випереджаючи захворюваність на сальмонельоз [1]. В Україні щорічно виявляють 107–192 хворих на ієрсиніоз, що, напевне, становить лише невелику частину захворілих [7].
Особливості патогенезу й епідеміології ієрсиніозу значною мірою обумовлені біологічними властивостями збудника цього захворювання. Відповідно до «Визначника бактерій Берджі» [8, 9], рід Yersinia включає 11 видів бактерій, у тому числі: Y.pestis, Y.pseudotuberculosis, Y.enterocolitica, Y.fridericsenia, Y.cristensenia, Y.intermedia, Y.aldovae. Найбільше значення (крім збудника чуми) мають Y.рseudotuberculosis і Y.enterocolitica. Однак за останні роки опубліковані повідомлення, відповідно до яких «рідкісні» види ієрсиній (Y.fridericsenia, Y.cristensenia і Y.intermedia), що контамінують овочі і предмети навколишнього середовища в теплицях і овочесховищах, також можуть викликати в людей гострі кишкові захворювання [8–10]. Важливо відзначити суттєву стійкість ієрсиній у зовнішньому середовищі, а також їхню здатність до репродукції при широкому діапазоні температур (від 2 до 40 °С). При цьому на відміну від інших ентеробактерій, оптимальною для росту є температура 22–28 °C [11–13]. Установлено також, що серогрупи О3, О5в і О9 довше зберігають життєздатність у грунті й річковій воді при 4 °С, ніж при 20 °С. Припускається, що виживанню патогенних ієрсиній у воді, як і інших інвазивних мікробів, сприяє їх внутрішньоклітинна персистенція в організмі водних найпростіших [14–15]. Здатності ієрсиній до збереження й репродукції при низьких температурах сприяє також контамінація ними різних продуктів, особливо овочів у процесі їх зберігання [3, 16–23]. У свинині ріст ієрсиній спостерігали в діапазоні від 0 до 20 °С. В інтервалі від 4 до 20 °С вони репродукуються на поверхні сиру, у пастеризованому молоці зберігають життєздатність при 10 °С понад 120 днів, а при 20 °С — до 30–60 днів, у морозиві — від 1,5 до 8 місяців [16]. Дослідженнями, виконаними за останні роки, встановлено, що психрофільність Y.enterocolitica — основна умова для їх розмноження і біохімічної активності в грунті [17–29]. Грунти природних вогнищ найбільш сприятливі для існування патогенних ієрсиній, при цьому вміст у грунті органічних сполук — один із лімітуючих факторів, що сприяють персистенції Y.enterocolitica, які утилізують молекулярний водень і вуглекислоту. Припускають, що в грунтовій екосистемі патогенні ієрсинії мають своїх господарів, що забезпечує безперервність епізоотичного процесу. Різні гідробіонти можуть бути господарями Y.еnterocolitica, а температура, вологість, хімічний склад грунту впливають на тривалість збереження ієрсиній, їхню вірулентність і біохімічну активність [20].
За Оантигеном (ОАГ) виділений 51 серовар Y.enterocolitica, більшість із яких належать до сероварів О3 (15–60 %); О5,27 (10–50 %); О7,8 (5–10 %) і О9 (1–3 %). Є дані про те, що серовар ієрсиній О3 має більшу ентеротоксичність, а О9 — більшу інвазивність, що позначається на клінічній картині [16, 22–26]. Представники виду Y.enterocolitica гетерогенні за метаболічним профілем, відповідно до якого виділяють п’ять біоварів цих мікроорганізмів. Y.enterocolitica має О і Vантигени, а при інкубації нижче 30 °С виявляється також Нантиген (НАГ) [27]. Відмінною рисою Y.enterocolitica є антигенна різноманітність — понад 50 ОАГ і 20 НАГ [28]. Існують спільні антигени з сальмонелами й бруцелами, що може сприяти утворенню відповідних антитіл і утруднювати серологічну діагностику [16, 27]. Нарешті, патогенні ієрсинії мають спільні антигени з тканинами людини [26, 29]. Це може зумовити утворення автоантитіл і визначати механізм ушкодження тканин. Наприклад, установлено, що розвитку спондилоартрозу у хворих на ієрсиніоз сприяє гомологія між антигеном лейкоцитів HLA — B27 і YadAадгезином ієрсиній [30–32]. Більшість сероварів Y.enterocolitica здатні до адгезії й колонізації на поверхні кишкового епітелію, а також можуть обумовлювати ентеротоксичний ефект. Разом із тим відомі й неентеротоксичні штами ієрсиній, що мають здатність тільки до адгезії [13, 33]. Ці особливості різних сероварів обумовлюють відому варіабельність клінічної картини. Не встановлено кореляції між інвазивністю й ентеротоксигенністю різних штамів ієрсиній [33].
Збудники ієрсиніозу надзвичайно поширені в природі. Мікроорганізми виду Y.enterocolitica виділяють від багатьох видів теплокровних тварин (диких, свійських, сільськогосподарських), рідше — від рептилій, риб і молюсків. Однак вважають, що основним джерелом патогенних для людини Y.enterocolitica серогруп О3 і О9 є свині [34–35]. Втім непатогенна Y.enterocolitica біовара 1А часто виділяється з об’єктів зовнішнього середовища, створюючи передумови для контамінації води й харчових продуктів [36]. Основними вхідними воротами інфекції при ієрсиніозі є шлунковокишковий тракт, при цьому інфікування відбувається при вживанні води, молочних продуктів, свинини, морепродуктів.
Сучасне уявлення про патогенез ієрсиніозу базується на комплексі даних мікробіологічних, епідеміологічних, імунологічних і експериментальних досліджень, а також клінічних спостереженнях.
Ж.І. Возіанова [37] наводить патогенез ієрсиніозу у вигляді ряду послідовних етапів:
1. Зараження — проникнення збудника.
2. Проникнення ієрсиній у кишечник, їх репродукція.
3. Місцева запальна реакція (апендицит, ентерит, термінальний ілеїт).
4. Проникнення збудника в лімфовузли (мезентеріальний лімфаденіт).
5. Бактеріємія (загальнотоксичний синдром).
6. Паренхіматозна дифузія (незавершений фагоцитоз, дифузійне метастатичне вогнищеве ураження внутрішніх органів, у якому виникають вогнища запалення).
7. Повторна генералізація, формування нових вогнищ запалення (рецидиви, загострення, роль автоімунних і алергійних реакцій).
8. Звільнення від інфекції (фагоцитоз, специфічні антитіла).
Y.enterocolitica має ентеротоксин, дія якого подібна до ентеротоксинів інших грамнегативних мікроорганізмів і проявляється активацією аденілатциклази ентероцитів, підвищенням проникності їхніх мембран для води й електролітів, що обумовлює діарею аж до дегідратації. Вважають, що токсичність ієрсиній визначається ліпополісахаридом, що є одним із компонентів клітинної стінки [38]. Відзначається також збільшення рівня простагландину Е, чим підтверджується роль алергії в патогенезі захворювання. Значенню алергії в патогенезі ієрсиніозу приділяється увага багатьма авторами [37, 39]. Ієрсинії серовару О3 несуть плазміди вірулентності, у зв’язку з чим при зараженні цим сероваром частіше виникають генералізовані форми захворювання [40]. За відсутності у збудника цих плазмід розвиваються переважно легкі форми (переважно гастроінтестинальні). За ієрсиніозу можливий розвиток хронічної форми. При цьому в крові й інших біологічних рідинах виявлені Оантитіла, високий рівень імунних комплексів, а також антитіла класів М і G [41]. При затяжному й рецидивному перебігу ієрсиніозу спостерігається тривала продукція специфічного імуноглобуліну А (IgA), обумовлена персистенцією ієрсиній, тривалою Оантигенемією, і постійна антигенна стимуляція імунної системи [39]. Своєрідність патогенезу ієрсиніозу, чим обумовлена розмаїтість клінічних проявів, зокрема широкий діапазон вираженості токсикозу й поліморфізм органних уражень, значною мірою залежить від складності антигенної структури ієрсинії. Поверхневий Оантиген, будучи термостабільним ліпополісахаридом, має високу специфічність і визначає приналежність ієрсиній до певних серогруп [25, 41]. Нантиген містить загальний для всіх серологічних варіантів компонент.
Поверхневі V і Wантигени подібні до із аналогічних антигенами чумних мікробів і визначають інтенсивність токсикозу (антигени вірулентності) [12, 42]. При цьому їх синтез детермінується плазмідами ієрсиній і залежить від температури культивації. Антигени вірулентності забезпечують помітне підвищення інвазивності й цитотоксичності ієрсиній, активацію репродукції в макрофагах та дисемінацію збудників [12, 43]. Наявність гетерогенних антигенів, спільних з антигенами тканин людини (печінки, нирок, кишечника, еритроцитів), обумовлюють автоімунні процеси, поліорганність ураження й вірулентність [23, 44]. Ліпополісахариди ієрсиній стимулюють Влімфоцити й макрофаги, опосередковано впливаючи на алергійні й автоімунні процеси, а також викликають активацію автореактивних клонів, продукуючих антитіла проти колагену 1го й 2го типів [45]. Частота виявлення й рівень антитіл до тканинних структур, а також антинуклеарні антитіла залежать від тривалості захворювання й активності запального процесу у сполучній тканині [44]. Разом із тим не можна виключити вплив індивідуальних особливостей імунної системи на перебіг розглянутих захворювань.
Складність класифікації ієрсиніозу значною мірою обумовлена частим сполученням або послідовним розвитком різних синдромів, кожен із яких може бути вираженим досить інтенсивно. У клінічній практиці широко використовується класифікація ієрсиніозу, що запропонована М.Д. Ющуком зі співавт. [11], що подана в табл. 1.
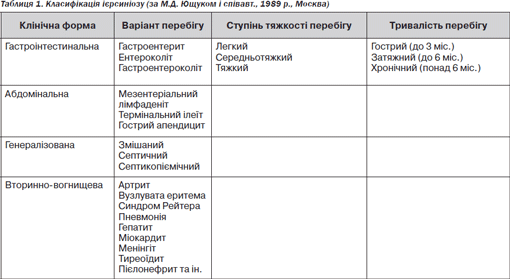
Гастроінтестинальна форма зустрічається в 55–75 % випадків ієрсиніозу. Поряд із діарейним синдромом спостерігаються ознаки інтоксикації й невластиві гострій кишковій інфекції симптоми: перхота в горлі, нежить, осиплість голосу, кашель, біль у суглобах, різі при сечовипусканні, набряклість і гіперемія обличчя та долонь. У частини хворих в 1шу — 2гу добу хвороби на шкірі тулуба і кінцівок з’являється неяскравий, часом ефемерний висип. В 1/3 хворих збільшується печінка.
Абдомінальна форма спостерігається у 5–10 % хворих на ієрсиніоз. Провідний симптом — біль у животі, що має постійний або нападоподібний характер і є приводом для лапаротомії з приводу передбачуваної хірургічної патології. Термінальний ілеїт і ієрсиніозний мезаденіт нерідко мають затяжний, рецидивуючий перебіг із тенденцією до хронізації. Відзначено ускладнений перебіг ієрсиніозного ілеїту (виразковий ілеїт, некроз, кишкова непрохідність).
Генералізована форма ієрсиніозу розвивається після локалізованих (гастроінтестинальної та абдомінальної) і зустрічається у 15–20 % хворих. Нерідко спостерігається первинногенералізована форма захворювання, що характеризується винятковим поліморфізмом симптомів: гострим початком, підвищенням температури до 38–40 ˚С, вираженою інтоксикацією, поєднанням диспептичного, тонзилокатарального синдромів, артралгії та артритів, лімфаденопатії, гепатоспленомегаліі. Один із головних симптомів — висип, що частіше з’являється на 2–3й день хвороби, плямистопапульозний, рідше — дрібноплямистий, локалізується на тулубі, кінцівках, обличчі, навколо суглобів. Можливі й інші варіанти висипу: геморагічний, везикульознопапульозний, за типом кільцеподібної та ексудативної еритеми. Перебіг захворювання сприятливий, проте можлива трансформація в затяжний і хронічний перебіг.
Вторинновогнищева форма ієрсиніозу може виникати як безпосередньо слідом за первинними змінами, так і через 2–3 тижні після гострої форми, супроводжуючись у ряді випадків хронічним перебігом. Такий перебіг у Фінляндії спостерігається в 4,0 %, в Угорщині — у 10,8 % випадків [46, 47].
У монографіях, присвячених менінгітам, немає вказівок на роль ієрсиній у їх етіології. Однак частота виявлення менінгіту становила від 0,26 до 17,9 % ієрсиніозів [11]. У дітей, які хворіють на генералізовану форму ієрсиніозу, описано полірадикулонейропатичний тип ураження периферійних нервів демієлінізуючоаксонального характеру [48].
Жовтяничну форму виявляли в 5–13,6 % хворих на ієрсиніоз, відзначаючи при цьому здебільшого гострий розвиток захворювання, субфебрильну або високу гарячку в жовтяничному періоді, але відносно рідко виникали висипання на шкірі [22].
Найбільш тяжкий перебіг ієрсиніозу спостерігається при септичному варіанті цих захворювань. Септична форма при ієрсиніозі виникає з частотою від 0,3 до 6,3 %. У цих випадках патологічний процес характеризується ациклічним перебігом і в половини хворих завершується летально. Сепсис формується на фоні імунодефіциту, переважно в людей з обтяженим преморбідним фоном (алкоголізм, цукровий діабет), проявляється гектичною або ремітуючою гарячкою, ознобами й поліорганною патологією, характерними для сепсису будьякої етіології [11].
У зв’язку зі складністю клінічного розпізнавання, обумовленого розмаїтістю клінічної картини, методам лабораторної діагностики при ієрсиніозі надають особливо важливого значення. Найбільш доказовим є виділення культури ієрсиній.
З метою виділення антигенів збудника, що забезпечує ранню діагностику ієрсиніозу, використовують метод флюоресцуючих антитіл, реакцію гальмування непрямої гемаглютинації (РГНГА), реакцію коаглютинації і реакцію аглютинації латексу.
РГНГА за чутливістю близька до ІФА, перевершує за цим показником РЗК і вірогідна щодо відтворення результатів. Вважають, що діагностичним є розведення сироватки крові 1 : 200, але діагностична цінність методу зростає при збільшенні титру в динаміці. Діагностична цінність методу наближається до 100 % [21].
Реакція аглютинації — використовують живі культури або формалінізовані препарати як антигени, реакція стає позитивною з 10–14ї доби хвороби. Можливі неспецифічні результати дослідження.
Впровадження ІФА дозволяє з високою специфічністю й чутливістю розпізнавати ієрсиніоз. Специфічність тесту складає 95 %, чутливість — 82 %. Найбільш інформативними сучасними методами є ПЛР та імуноблотинг, однак їх відтворюваність можлива лише у спеціалізованих лабораторіях.
Всі клініцисти, які займаються проблемою лікування ієрсиніозів, підкреслюють необхідність сполучення етіотропної й патогенетичної терапії, що включає дезінтоксикаційні засоби й заходи, спрямовані на зниження частоти загострення та рецидивів.
До 70х років минулого сторіччя накопичено досвід застосування більше ніж п’ятдесяти різних антибіотиків для етіотропної терапії при ієрсиніозі [49]. Для лікування ієрсиніозу у дорослих рекомендують використовувати фторхінолони (ципрофлоксацин по 1000 мг на добу) [16]. У 41 хворого на ієрсиніоз як етіотропні препарати призначали похідні оксихінолонкарбоксилової кислоти — фторовані хінолони третього покоління — пефлацин по 400 мг 2 рази на добу і ципрофлоксацин по 500 мг 2 рази на добу протягом 7–8 діб. Терапевтичний ефект спостерігався в 96,2 % випадків [50]. Деякі серовари Y.enterocolitica утворюють пеніцилінази і цефалоспоринази, тому при ієрсиніозі не рекомендується призначати беталактамні антибіотики, за винятком цефалоспоринів ІІІ покоління [51]. У рекомендаціях, присвячених проблемі ієрсиніозу, звертається увага на доцільність використання різних вітамінів, засобів дезінтоксикаційної терапії, неспецифічних протизапальних і дезінтоксикаційних препаратів відповідно до вираженості різних синдромів, властивих розглянутій патології.
1. Марамович А.С., Лысанов Ю.И., Климов В.Т. и др. Эпидемиология иерсиниозов // Инфекционные и паразитарные болезни: экспрессинформация. — М., 1990. — Вып. 4. — С. 116.
2. Головчак Г.С. Епідеміологічна характеристика ієрсиніозів в умовах урбанізованих територій та удосконалення системи епідеміологічного нагляду: Автореф. дис... канд. мед. наук: спец. 14.01.13 «Інфекційні хвороби» / Г.С. Головчак. — К., 2000. — 19 с.
3. Ющенко Г.В. Современное состояние проблемы иерсиниозов // Эпидемиология и инфекционные болезни. — 1998. — № 6. — С. 811.
4. Федоров Е.И., Гончарова Т.Е. Клиникоэпидемиологическая характеристика кишечного иерсиниоза // Медицина: эксперимент, практика: Сб. науч. статей. — Харьков, 1994. — С. 137140.
5. Ющенко Г.В. Псевдотуберкулез и иерсиниоз // Инфекции, обусловленные иерсиниями: междунар. конф. — СПб., 2000. — С. 36.
6. Schleifstein J., Coleman M.B. An unidentified microarganism resembling B.lignieri and Pasteurella pseudotuberculosis and pathogenic for man // St. J. Med. — 1939. — Vol. 39. — P. 17471753.
7. Гончарова Т.Е. Экологоэпидемиологическая характеристика псевдотуберкулеза и кишечного иерсиниоза в условиях северовосточного региона Украины и пути повышения эффективности их профилактики: Автореф. дис... канд. мед. наук: спец. 14.01.13 «Інфекційні хвороби» / Т.Е. Гончарова. — К., 1996. — 16 с.
8. Ющенко Г.В., Хромова Л.П., Якунина Н.Е. Современная тенденция эпидемиологического процесса при иерсиниозе // Вопросы эпидемиологии инфекционных болезней. — М., 1996. — С. 4648.
9. Старостина Н.В. Эпидемиологические и экологические особенности заболеваний, вызываемых J. fridericsenia, J. kristensenia и J. intermedia: Автореф. дис... канд. мед. наук: спец. 14.00.10 «Инфекционные болезни» / Н.В. Старостина. — М., 2000. — 18 с.
10. Ket B., Trafny E.A. The application of PCR tu the identification of selected virulence markers of Yersinia genus // Pol. J. Vet. Sci. — 2004. — Vol. 7, № 1. — P. 2731.
11. Ющук Н.Д., Кареткина Г.Н., Проскурина Л.Н. и др. О клинике, патогенезе и лечении иерсиниоза // Клиническая медицина. — 1989. — Т. 167, № 5. — С. 9198.
12. Иерсиниозы / Н.Д. Ющук, Г.Я. Ценева, Г.Н. Кареткина, Л.Е. Бродов — М., 2003. — 265 с.
13. Ценева Г.Я., Воскресенская Е.А., Солодовникова Ю.Ю. Биологические свойства иерсиний и лабораторная диагностика псевдотуберкулеза и иерсиниоза: пособие для врачей. — СПб., 2001. — 60 с.
14. Butler T. Yersinia speciens, including plague // Principles and Practice of Infectious Diseases / Ed. G.L. Mandell, J.E. Bennet, R. Dolin. — 5th ed. — Philadelphia: Churchill Livingstone, 2000. — P. 24042414.
15. Falcao J.P., Broechi M., ProencaModena J.L. et al. Viurlence characteristics and epidemiology of Yersinia enterocolitica and Yersinia other thau Y.pseudotuberculosis and Y.pestis isolated from water and sewage // J. Appl. Microbiol. — 2004. — Vol. 96, № 6. — P. 12301236.
16. Смирнов И.В. Возбудитель иерсиниоза и близкие к нему микроорганизмы // Клин. микробиол., антимикроб. химиотерапия. — 2004. — T. 6, № 1. — С. 1021.
17. Литвин В.Ю. Обратимый переход патогенных бактерий в покоящееся (некультивируемое) состояние: экологические и генетические механизмы / В.Ю. Литвин, А.Л. Гинзбург, В.И. Пушкарева // Вестник РАМН. — 2000. — № 1. — С. 712.
18. Литвин В.Ю., Пушкарева В.И., Емельяненко Е.Н. Биоценотические основы природной очаговости сапрозоонозов (итоги 15летних наблюдений) // Журн. микробиол. — 2004. — № 4. — С. 102108.
19. Бренева Н.В., Марамович А.С., Климов В.Т. Экологические закономерности существования патогенных иерсиний в почвенных экосистемах // Журн. микробиол. — 2005. — № 6. — С. 8288.
20. Щербаков А.А., Зыкин Л.Ф., Хапцев З.Ю. и др. Иерсиниоз и псевдотуберкулез сельскохозяйственных животных // VIII Всероссийский съезд эпидемиологов, микробиологов и паразитологов: материалы, 26–28 марта 2002 г. — М.: РОСИНЭКС, 2002. — Т. I. — С. 284.
21. Кокорина Г.И., Шендерович О.А., Ценева Г.Я. Применение иммуноблота в диагностике затяжных форм иерсиниозов и изучение вопросов патогенеза (обзор литературы) // Клин. лабор. диагн. — 2006. — № 4. — С. 4044.
22. Самсон А.А., Барьяш Г.М., Протасов С.А. Иерсиниоз и псевдотуберкулез в общеврачебной практике // Клин. антибиотикотерапия. — 2005. — № 7. — С. 2530.
23. Киселева И.С. Мясо как фактор передачи инфекции при иерсиниозе: Автореф. дис... канд. биол. наук: спец. 03.00.07 «Микробиология» / И.С. Киселева. — Саратов, 2005. — 18 с.
24. Сидельникова С.М., Ющенко Г.В., Асеева Э.М. Иерсиниозы как терапевтическая проблема // Терапевтический архив. — 2000. — № 11. — С. 2730.
25. Yermak I.M., Davidova U.N., Gorbach U.I. et al. Forming and immunological properties of some lipopolysaccharidechitosan complexes // Biochimie. — 2006. — Vol. 88, № 1. — P. 2330.
26. МcNally A., Cheasty T., Fearnley C. et al. Comparison of the biotypes of Yersinia enterocolitica isolated from piqs, cattle and sheep at slaughter and from humans with yersiniosis in Great Britain during 1999–2000 // Lett. Appl. Microbiol. — 2004. — Vol. 39, № 1. — P. 103108.
27. Naktin J., Beavis K.G. Yersinia enterocolitica and Yersinia pseudotuberculosis // Clin. Lab. Med. — 1999. — № 19. — P. 523536.
28. Bockemuhl J., Wong J. Bockemuhl J. Yersinia // Manual of clinical microbiology / P.R. Murray, E.J. Baron, J.H. Jordansen et al. / Ed. Yolken R.H. — 8th ed. — Washington (DC): ASM Press, 2003. — P. 672683.
29. Лебедь Н.Е., Поддубиков А.В., Ястребова Н.Е. и др. Специфические противоиерсиниозные антитела классов G и M у здоровых доноров крови и больных пищевой токсикоинфекцией // Журн. микробиол. — 2001. — № 2. — С. 8789.
30. Heise T. Identification of a domain in Yersinia virulense factor Yad A that is crucial for extracellular matrixspecific cell adhesion and uptake / T. Heise, P. Dersch // Proc. Nate. Acad. Sci. USA. — 2006. — Vol. 103, № 9. — P. 33753380.
31. Sonnevend A., Czirok E., Pal T. Sonnevend A. Yersinia Yopspecific JgA antibodies in Hungarian blood donors // Folia Microbiol. — 2005. — Vol. 50, № 3. — P. 269272.
32. Huppertz H.I. The influence of HLA B27 and interferongamma on the invasion and persistence of yersinia in primary human fibroblasts / H.I. Huppertz, J. Heesemann // Med. Microbiol. Immunol. — 1996. — Vol. 185, № 3. — P. 163170.
33. Иерсинии и иерсиниозы / Под. ред. Г.Я. Ценевой. — СПб., 2006. — 168 с.
34. Kot B., Trafny E.A. The application of PCR to the identification of selected virulence markers of Yersinia genus // Pol. y Vet. Sci. — 2004. — Vol. 7, № 1. — P. 2731.
35. Laukkanen R., Niskanen T., FredrikssonAhomaa M. et al. Yersinia pseudotuberculosis in piqs and piq houses in Finland // Adv. Exp. Med. Biol. — 2003. — Vol. 529. — P. 371373.
36. Carniel E. The Yersinia highpathogenicity island // Int. J. Microbiol. — 1999. — Vol. 2, № 3. — P. 161167.
37. Возианова Ж.И. Заболевания, вызываемые иерсиниями // Инфекционные и паразитарные болезни. — Киев: Здоров’я, 2000. — Т. 1. — С. 458497.
38. МcNally A., Cheasty T., Fearnley C. et al. Comparison of the biotypes of Yersinia enterocolitica isolated from pigs, cattle and sheep at slaughter and from humans with yersiniosis in Great Britain during 1999–2000 // Lett. Appl. Microbiol. — 2004. — Vol. 39, № 1. — P. 103108.
39. Попова О.В., Шепелева Г.К., Шестакова И.В. Иммунологические аспекты развития реактивных артритов при иерсиниозной инфекции // Инфекционные болезни. — 2006, Т. 4. — № 2. — С. 5358.
40. Шурыгина И.А., Малов И.В., Чеснокова М.В. и др. Влияние плазмиды pVM 82 MDa Yersinia pseudotuberculosis на клинические и морфологические проявления псевдотуберкулеза // VI Российский съезд врачейинфекционистов: материалы съезда, 29–31 октября 2003 г. — СПб.: В.МедА, 2003. — С. 445.
41. Бениова С.И., Гордеец А.В. Динамическое наблюдение детей, перенесших иерсиниозную инфекцию // Педиатрия. — 2002. — № 2. — С. 4448.
42. Zhou D., Han Y., Yang R. Molecular and physiological insights into plaque transmission, virulence and etiology // Microbes Infec. — 2006. –Vol. 8, № 1. — P. 273284.
43. Семинский И.Ж., Шурыгина И.А., Климов В.Т. Особенности клеточных реакций в очаге воспаления различной этиологии. Сообщение 3. Инфекционное воспаление // Журн. инфекционой патологии. — 2000. — Т. 7, № 3–4. — С. 2833.
44. Шестакова И.В., Ющук Н.Д., Андреев И.В. и др. О формировании иммунопатологии у больных иерсиниозом // Терапевтический архив. — 2005. — № 11. — С. 710.
45. Di Gerano M.S., Munoz E., Aguilera C. et al. Yersinia enterocolitica O:8 and O:5 lipopolysaecharide arhtritogenicity in hamsters // Rheumatology. — 2000. — № 39. — P. 7378.
46. Laukkanen R., Niskanen T., FredrikssonAhomaa M. et al. Yersinia pseudotuberculosis in piqs and piq houses in Finland // Adv. Exp. Med. Biol. — 2003. — Vol. 529. — P. 371373.
47. Sonnevend A., Czirok E., Pal T. Yersinia Yopspecific JgA antibodies in Hungarian blood donors // Folia Microbiol (Praha). — 2005. — Vol. 50, № 3. — P. 269272.
48. Команцев В.Н., Скрипниченко Н.В., Тихомирова О.В. и др. Поражение периферической нервной системы при иерсиниозной инфекции у детей // Воен.мед. журн. — 2003. — № 2. — С. 2729.
49. Борисова М.А. Клиника иерсиниозов / М.А. Борисова. — Владивосток, 1991. — 179 с.
50. Лучшев В.И., Андреевская С.Г., Михайлова Л.М. и др. Лечение больных иерсиниозами препаратами фторхинолонового ряда // Эпидемиология и инфекционные болезни. — 1997. — № 3. — С. 4143.
51. Gayrand M., Scavizzi M.R., Mollaret H.H. et al. Antibiotic treatment of Yersinia enterocolitica septicemia: a retrospective review of 43 cases // Clin. Infect. Dis. — 1993. — Vol. 17. — P. 405410.
