Газета «Новости медицины и фармации» Инфекционные болезни (330) 2010 (тематический номер)
Вернуться к номеру
Інфекційний мононуклеоз Епштейна — Барр вірусної етіології в дітей: клінічні прояви, лікування із застосуванням ліпосомальних препаратів інтерферону
Авторы: С.О. Крамарєв, О.В. Виговська, Т.М. Камінська*, О.В. Головач, Л.А. Большакова, Н.В. Чемьоркіна, О.В. Савіна, А.А. Іванович, О.Є. Луцька, Національний медичний університет імені О.О. Богомольця, *Київська міська дитяча клінічна інфекційна лікарня
Версия для печати
Інфекційний мононуклеоз (ІМ) — це одна з найпоширеніших і найвідоміших форм первинної вірусної інфекції Епштейна — Барр (EBV) [2, 5, 13].
EBV належить до гамма-герпесвірусів і являє собою вірус герпесу 4-го типу [16]. Основна його мішень — В- та Т-лімфоцити, рідше він вражає епітеліоцити, клітини природних кілерів (NK-клітини), макрофаги, моноцити, нейтрофіли. У цих клітинах вірус розмножується і здатний персистувати впродовж тривалого часу [17].
EBV-інфекція являє собою імунологічний парадокс. Клінічні прояви та її патогенез — це результат імунного «двобою» між інфікованими В-лімфоцитами і цитоплазматичними Т-лімфоцитами. EBV викликає адаптаційно-компенсаторні зміни з боку імунної системи, має імуносупресивну дію, включаючи імунні порушення клітинної та гуморальної ланки імунітету, цитокінового, інтерферонового статусу, факторів уродженої резистентності [4, 7, 13, 17].
Участь у запальному процесі інтерферонів (ІФН) визначається їх біологічними ефектами. ІФН формує захисний бар’єр на шляху вірусу набагато раніше специфічних захисних реакцій імунітету, стимулюючи клітинну резистентність, роблячи клітини вірусів непридатними для розмноження. ІФН активізує макрофаги та природні кілери, які потім синтезують гаммаІФН, IL1, IL2, IL4, IL6, TNF, у результаті чого макрофаги та природні кілери набувають здатність викликати лізис вірусінфікованих клітин. ІФНгамма є спеціалізованим індуктором активації макрофагів, продуцентами цієї молекули є активовані Тлімфоцити (Th1) та NKклітини. ІФНгамма індукує і стимулює синтез прозапальних цитокінів (IL1, IL6, TNF) [3, 11, 15].
Ряд досліджень показали, що в дітей, хворих на ІМ, має місце значне пригнічення продукції інтерферонів, як загального, так і його фракцій, особливо ІФНa та ІФНg, що в подальшому створює умови для тривалого рецидивуючого перебігу захворювання та формування хронічних форм EBVінфекції [4, 7, 13].
До основних клінічних симптомів інфекційного мононуклеозу належать інтоксикаційний синдром, тривала гарячка, системна лімфаденопатія, гепатомегалія, спленомегалія, ураження ротоглотки, гострий тонзиліт, синдром екзантеми, синдром гепатиту, гематологічні порушення (лейкоцитоз, лімфоцитома, моноцитоз, наявність віроцитів) [4, 16].
Проблема лікування ІМ на сьогодні залишається актуальною і потребує індивідуального та комплексного підходу з урахуванням патогенетичних особливостей захворювання, наявних імунологічних змін, ступеня тяжкості хвороби, віку дитини, клінічних особливостей та ін. [5].
Метою лікування ІМ є швидка інволюція симптомів, зниження активності вірусу, попередження несприятливих наслідків захворювання.
Метою нашого дослідження було оцінити ефективність лікування хворих на ІМ, у яких мало місце зниження рівня інтерферонів (ІФН сироватковий, ІФНa, ІФНg), шляхом включення до базисної терапії препарату Ліпоферон (компанія АТ «Ядран», «Галенська Лабораторія»).
Препарат Ліпоферон є представником групи ліпосомних препаратів. Він являє собою ліофілізований порошок для перорального застосування у флаконах по 500 000 МО. Ліпосомне покриття складається з лецитину й холестерину. Серед активних субстанцій препарату є інтерферон людський рекомбінантний альфа2b, вітамін Е, аскорбінова кислота. Поліпептидна структура молекули, біологічна активність та фармакологічні властивості рекомбінантного білка та людського лейкоцитарного інтерферону альфа2 ідентичні [1, 8].
Існуючі препарати інтерферонів для системного застосування при ін’єкційному способі введення можуть викликати небажані побічні ефекти — грипоподібний синдром, погіршення настрою, випадіння волосся, свербіж, висип на шкірі, диспепсію, біль у животі та інші небажані явища [3, 15].
Оскільки інтерферони належать до високомолекулярних білкових сполук, визначальним моментом для їх перорального застосування є підвищення біодоступності та безпечності. Одним із напрямків реалізації цього є створення ліпосомальних форм.
 Ліпосоми — це мікроскопічні сферичні частки, заповнені рідиною, з оболонкою з фосфоліпідів, аналогічних тим, які входять до складу клітинних мембран (рис. 1). Утворення ліпосом пов’язане зі здатністю деяких ліпідів за певних умов формувати у водному середовищі концентричні біошари, що відокремлені один від одного водними проміжками. Для запобігання утворенню везикул з великим внутрішнім об’ємом і для стабілізації ліпідної мембрани використовується холестерин. Гідрофільні (водорозчинні) лікарські речовини можуть бути поміщені у внутрішній водний простір ліпосом, тоді як гідрофобні (жиророзчинні) включаються безпосередньо в ліпідну мембрану. За рахунок того, що оболонка ліпосом складається з природних компонентів, вона є такою, яка повністю біодеградується, і біосумісною [12].
Ліпосоми — це мікроскопічні сферичні частки, заповнені рідиною, з оболонкою з фосфоліпідів, аналогічних тим, які входять до складу клітинних мембран (рис. 1). Утворення ліпосом пов’язане зі здатністю деяких ліпідів за певних умов формувати у водному середовищі концентричні біошари, що відокремлені один від одного водними проміжками. Для запобігання утворенню везикул з великим внутрішнім об’ємом і для стабілізації ліпідної мембрани використовується холестерин. Гідрофільні (водорозчинні) лікарські речовини можуть бути поміщені у внутрішній водний простір ліпосом, тоді як гідрофобні (жиророзчинні) включаються безпосередньо в ліпідну мембрану. За рахунок того, що оболонка ліпосом складається з природних компонентів, вона є такою, яка повністю біодеградується, і біосумісною [12].
Включені в ліпосоми лікарські речовини виявляються стійкішими в організмі, оскільки захищені ліпідною мембраною від дії зовнішніх умов, зокрема від руйнування в травному тракті, що дозволяє здійснювати пероральний прийом ліпосомних препаратів [12]. Речовина, що діє, вивільняється з ліпідної плівки шляхом екзоцитозу, унаслідок злиття ліпосоми з клітинною стінкою або в результаті полегшеної дифузії при адсорбції ліпідних везикул на поверхні клітини, що забезпечує доставку активної речовини безпосередньо всередину клітин.
Ліпосоми як носії лікарських речовин мають низку переваг: захищають клітини організму від токсичної дії лікарських засобів; пролонгують дію введеного в організм лікарського засобу; захищають лікарські речовини від деградації; сприяють націленій специфічності за рахунок селективного проникнення з крові в тканини; змінюють фармакокінетику лікарських препаратів, підвищуючи їхню фармакологічну ефективність; дозволяють створити водорозчинну форму ряду лікарських субстанцій, збільшуючи тим самим їх біодоступність.
Препарат Ліпоферон за рахунок вмісту ІФН має противірусну, імуномодулюючу, антипроліферативну дію. До його складу також входить антиоксидант — вітамін Е. Застосування інтерферону разом із вітаміном Е підсилює його противірусну дію. Також це мінімізує токсичний вплив ІФН на організм, що дозволяє використовувати препарат у педіатричній практиці [1, 6, 8, 9].
У літературі відображений досвід застосування Ліпоферону в дітей з гострими і хронічними вірусними гепатитами, у тому числі вірусним гепатитом С, для профілактики ГРЗ, алергічного ринокон’юнктивіту, атопічної бронхіальної астми, вітряної віспи, серозних менінгітів [1, 6, 8, 9, 18].
Об’єкт і методи дослідження
У дослідження було включено 60 дітей, хворих на ІМ, віком від 3 до 18 років, які методом рандомізації були розподілені на дві групи. Дітям 1ї групи, крім базисної терапії, призначали препарат Ліпоферон. Діти 2ї групи отримували лише базисну терапію ІМ.
Верифікацію діагнозу здійснювали на підставі даних анамнезу, клінічного та лабораторного обстеження (загального аналізу крові, визначення активності трансаміназ крові), виявлення специфічних маркерів EBVінфекції — антитіл класів IgМ VCA, IgG VCA, IgG EA до EBV, відсутності в крові IgG EBNA, визначення ДНК EBV у крові та слині.
У дослідження ввійшли діти, у яких при проведенні первинного імунологічного дослідження було виявлено зниження в крові рівня сироваткового інтерферону, ІФНa та ІФНg.
Статистичну обробку результатів дослідження проводили за допомогою MS Excel 2007. Визначались середні показники (tтест Student) та стандартні відхилення (М ± SD). Різницю частот визначали за методом оцінки різниці між частотами появи ознаки в окремих серіях спостереження, статистично вірогідною вважали різницю, якщо р < 0,05 [10].
Серед дітей 1ї групи хлопчиків було 45,0 %, дівчаток 55,0 %; дітей від 3 до 6 років — 35,0 %, 7–9 років — 25,0 %, 10–14 років — 20,0 %, понад 14 років — 20,0 %; із середньотяжким ступенем тяжкості захворювання було 50,0 % дітей, із легким — 25,0 %, із тяжким — 25,0 %.
У другій групі хлопчиків та дівчаток було по 50,0 %; дітей від 3 до 6 років — 30,0 %, 7–9 років — 25,0 %, 10–14 років — 25,0 %, понад 14 років — 20,0 %; середньотяжкий ступінь тяжкості захворювання був у 45,0 % дітей, тяжкий — у 30,0 %, легкий — у 25,0 %.
Суттєвих відмінностей у розподілі хворих 1ї та 2ї груп за віком, статтю, ступенем тяжкості захворювання не було, що свідчить про відсутність відмінностей у підібраних групах для подальшої порівняльної оцінки ефективності лікування.
Аналіз скарг і даних об’єктивного обстеження показав, що в усіх дітей захворювання починалося гостро, із загальноінфекційного синдрому, який проявлявся у вигляді загальної слабкості, кволості, нездужання (100,0 %), зниження апетиту (75,0 %), головного болю (83,3 %), нудоти (50,0 %), у дітей з тяжкими формами — артралгії, міалгії, блювоти.
У всіх дітей також спостерігалися порушення з боку центральної нервової системи (ЦНС), що проявлялися емоційною лабільністю, плаксивістю, підвищеною збудливістю, негативною реакцією на огляд, млявістю (100,0 %), порушенням сну (66,7 %).
Зміни з боку шкіри у вигляді блідості, «синяви» під очима, акроціанозу реєструвалися в усіх обстежених дітей. Екзантема зустрічалася у 40 % хворих 1ї групи та 30 % пацієнтів 2ї групи, переважно в дітей, які приймали в домашніх умовах ампіцилін або його похідні. У більшості хворих висип з’являвся на 4–7й день від початку лікування і зберігався впродовж 10–14 днів. Переважав плямистопапульозний висип (61,9 %) середніх або/та великих розмірів, розташований по всій поверхні тіла, у більшості пацієнтів висип мав зливний характер. У 23,8 % дітей характер висипу був дрібнокрапчастий, у 14,3 % хворих висип мав геморагічний характер.
Гіпертермічний синдром реєструвався в усіх дітей. Підвищення температури тіла до 38 °С відзначалося у 37,0 %; 38,1–39 °С — у 35,2 %; 39–41 °С — у 27,8 % пацієнтів.
Ураження лімфоїдної тканини виявлено в усіх хворих. Системний характер лімфаденопатія мала в 76,7 % дітей. Відзначалося збільшення переважно підщелепних (73,3 %), передньошийних та задньошийних (83,3 %), пахових груп (50,0 %) лімфатичних вузлів. Також були збільшені й інші групи лімфовузлів — підпахвинні (50,0 %), потиличні, надключичні та підключичні (41,7 %) лімфовузли.
У всіх хворих спостерігалося ураження носо та ротоглотки у вигляді закладеності носу — 86,8 % дітей, набряку обличчя та повік — 52,8 %, утруднення носового дихання — 75,5 %, храпу під час сну — 50,0 %. Виділення з носу з’являлися після 4го дня від початку хвороби та мали місце в 47,2 % пацієнтів.
У всіх дітей (100,0 %) мав місце гострий тонзиліт, який проявлявся дискомфортом, болем у горлі при ковтанні, гіперемією слизової оболонки ротоглотки, зернистістю м’якого піднебіння, дужок, бугристістю задньої стінки глотки. На момент госпіталізації нашарування на мигдалинах спостерігалися у 81,7 % хворих. Із них у 65,3 % вони були гнійними, у 34,7 % — плівчастими, у 25 % — «творожистими». У 5 хворих нашарувань на мигдаликах не було, у них відзначалася лише гіперемія й набряклість слизової оболонки ротоглотки.
Постійним симптомом захворювання була гепатомегалія. Вона мала місце у 100,0 % дітей. Явища гепатиту із синдромом цитолізу спостерігали в кожного третього хворого. У цих пацієнтів за відсутності гіпербілірубінемії реєструвалось підвищення активності аланінамінотрансферази (70,5 ± 7,8 од.), аспартатамінотрансферази (59,0 ± 2,8 од.). При цьому жовтяничність шкіри та слизових оболонок мала місце лише у 24,5 % хворих. У цих дітей спостерігалася помірна гіпербілірубінемія (90,0 ± 4,6 мкмоль/л). Спленомегалія відзначалася у 86,7 % хворих.
Гематологічні порушення спостерігалися в усіх дітей. У крові 73,3 % хворих відзначався помірний лейкоцитоз — 14,4 ± 3,5•109/л, лімфоцитоз — 88,3 %, моноцитоз — 83,3 %. У 61,7 % хворих були виявлені атипові мононуклеари (віроцити), їх кількість в периферичній крові коливалася від 10 до 55 %, ШОЕ була прискореною у 70,0 % (25,0 ± 5,2 мм/год).
Результати дослідження
Базисна терапія включала антибактеріальні препарати (пеніцилін, цефалоспорини І–ІІІ генерації, макроліди — азитроміцин), які призначали дітям із синдромом гострого тонзиліту; антигістамінні засоби, ентеросорбенти, симптоматичну терапію.
Пацієнтам 1ї групи до комплексного лікування ІМ включали препарат Ліпоферон у таких дозах:
— дітям віком від 3 до 7 років по 500 000 МО (1 флакон) один раз на добу;
— дітям віком від 7 до 15 років по 1 000 000 МО (2 флакони) двічі на добу;
— дітям віком від 15 до 18 років по 1,5 млн МО (3 флакони) двічі на добу.
Курс лікування в середньому тривав від 5 до 10 днів. При середньотяжкій формі захворювання курс лікування становить 5 днів, при тяжкій — 10 днів.
Оцінку ефективності лікування ІМ проводили на основі дослідження динаміки основних клінічних симптомів (при госпіталізації до стаціонару, через 2 тижні, 1 місяць від початку лікування, 3 місяці від початку захворювання) (табл. 1).
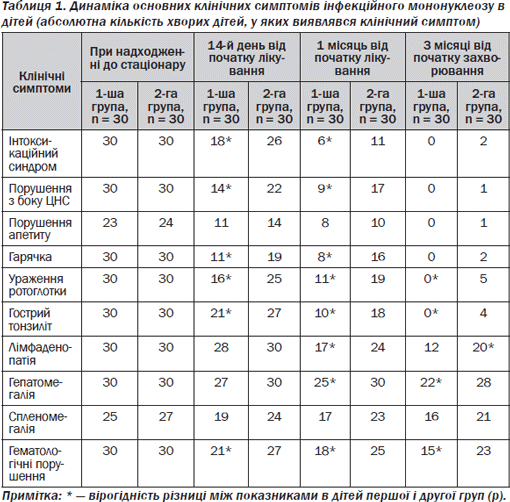
Із даних, що наведені в табл. 1, видно, що при надходженні до стаціонару вірогідної різниці в частоті основних клінічних симптомів в обох групах зареєстровано не було (р > 0,05), що свідчить про репрезентативність наведених груп за діагнозом.
При обстеженні на 14й день від початку терапії в дітей 1ї групи порівняно з дітьми 2ї групи відзначено вірогідне зменшення частоти виявлення клінічних симптомів ІМ, таких як інтоксикаційний синдром, порушення з боку ЦНС, ураження ротоглотки, гострий тонзиліт, лімфаденопатія, гематологічні порушення (р < 0,05).
Через 1 місяць від початку терапії в пацієнтів 1ї групи порівняно з дітьми 2ї групи спостерігали виражену позитивну динаміку з боку таких клінічних симптомів, як інтоксикаційний синдром, порушення з боку ЦНС, гарячка, ураження ротоглотки, гострий тонзиліт, системна лімфаденопатія, гепатомегалія, гематологічні порушення (р < 0,05).
Через 3 місяці від початку захворювання в дітей 1ї групи не реєстрували таких проявів захворювання, як інтоксикаційний синдром, ураження ротоглотки, гострий тонзиліт (р < 0,05). У 6,7 % дітей 2ї групи зберігалися інтоксикаційний синдром та гарячка; у 3,3 % — порушення з боку ЦНС та порушення апетиту. Гематологічні порушення у вигляді лімфоцитозу, моноцитозу зберігалися в 50,0 % хворих 1ї групи та у 76,6 % дітей 2ї групи. Лімфаденопатія виявлялася в 40 % дітей 1ї групи та у 66,6 % хворих 2ї групи. Гепатомегалія зберігалася у 73,3 % пацієнтів 1ї групи та у 93,3 % хворих 2ї групи. Спленомегалія мала місце в 64 % дітей 1ї групи та у 77,8 % хворих 2ї групи.
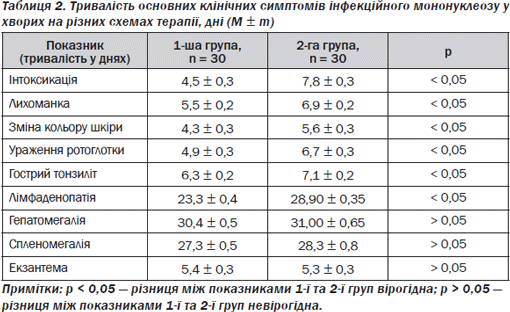
Тривалість інтоксикаційного синдрому, гарячки, ураження ротоглотки, гострого тонзиліту, лімфаденопатії у хворих 1ї групи була меншою (р < 0,05), а також спостерігалася тенденція до більш швидкого зникнення гепатомегалії та спленомегалії у хворих 1ї групи порівняно із хворими групи порівняння (p > 0,05) (табл. 2).
Лабораторну оцінку ефективності лікування здійснювали, аналізуючи динаміку маркерів (при госпіталізації до стаціонару та через 1 місяць від початку лікування), які відображають вірусну активність, — антиEBV IgM VCA, ДНК EBV у крові та слині.
У табл. 3 наведено дані щодо динаміки маркерів вірусної активності EBV у дітей з ІМ залежно від терапії, яку отримували діти.
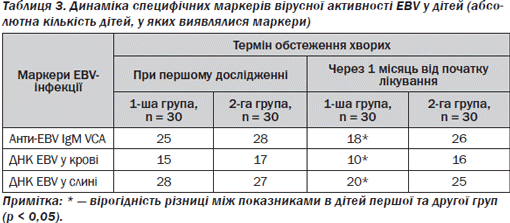
При вивченні динаміки маркерів, що характеризують активність вірусного процесу при ІМ, через 1 місяць від початку лікування у дітей 1ї групи відзначено вірогідне зменшення частоти виявлення антиEBV IgM VCA, ДНК EBV у крові та слині порівняно із хворими 2ї групи (p < 0,05).
У дітей 1ї групи зареєстрували зменшення частоти виявлення антиEBV IgM VCA на 40,0 %, ДНК EBV у крові — на 33,3 %, ДНК EBV у слині — на 28,5 % порівняно з першим дослідженням. У дітей 2ї групи зафіксовано зменшення частоти виявлення антиEBV IgM VCA лише на 7,0 %, ДНК EBV у крові — лише на 5,8 %, ДНК EBV у слині — на 7,4 % порівняно з дітьми з позитивним значенням показника під час госпіталізації до стаціонару.
Впродовж всього терміну обстеження хворих із ІМ побічних дій при призначенні препарату Ліпоферон відмічено не було.
Висновки
1. Включення препарату Ліпоферон до комплексної терапії ІМ у дітей покращує ефективність його лікування.
2. Призначення препарату Ліпоферон при ІМ має виражену клінічну ефективність.
3. Препарат Ліпоферон має противірусну активність при EBVінфекції.
4. Препарат Ліпоферон може застосовуватися в педіатричній практиці для лікування ІМ у дітей.
1. Бажутін Н.Б., Золін В.В., Колокольцов А.А., Таргонський С.Н. Перспективи використання ліпосомальних препаратів у медичній практиці // Здоров’я України. — 2007. — № 3. — С. 71.
2. Волоха А.П., Чернишова Л.І. Епштейн — Барр вірусна інфекція у дітей // Сучасні інфекції. — 2003. — № 4. — С. 7993.
3. Ершов Ф.И. Система интерферона в норме и при патологии. — М.: Медицина, 1996. — 240 с.
4. Иванова В.В., Камальдинова О.Г., Левина А.С. Инфекционный мононуклеоз: тактика терапии больных с нелегким течением заболевания. Информационное письмо для педиатров. — СПб., 2004. — 24 с.
5. Исаков В.А., Архипова О.И., Исаков Д.В. Герпесвирусные инфекции человека: руководство для врачей / Под ред. В.А. Исакова. — СПб.: СпецЛит, 2006. — 303 с.
6. Колокольцов А.А., Золін В.В., Таргонський С.Н., Бажутін Н.Б. Терапевтична ефективність Ліпоферону ліпосомального в профилактиці і лікуванні вірусних інфекцій // Здоров’я України. — 2007. — № 7. — С. 7475.
7. Краснов В.В. Инфекционный мононуклеоз. Клиника, диагностика, современные принципы лечения. — СПб.; Нижний Новгород, 2003. — 44 с.
8. Ліпоферон: новий препарат — нові можливості // Аптека. — 2007. — № 21 (592) (www.apteca.ua)
9. Лобзин Ю.В., Львов Н.І., Колокольцов А.А. Клінічна ефективність препарату Ліпоферон в комплексній терапії хворих грипом та другими ГРЗ // Новости медицины и фармации. — 2007. — № 14 (220).
10. Мінцер О.П., Угаров Б.Н., Власов В.В. Методи обробки медичної інформації: Навч. посібник. — К.: Вища школа, 1991. — 271 с.
11. Соловьев В.Д., Бектемиров Т.А. Интерфероны в теории и практике медицины. — М., 1981.
12. Швець В.І., Краснопольский Ю.М. Ліпосоми в фармації. Продукти нанобіотехнології // Хімікофарм. журнал. — 2006. — № 3. — С. 3638.
13. Юліш Е.І., Волосовець О.П. Вроджені та набуті TORCHінфекції у дітей. — Донецьк: Регіна, 2005. — 216 с.
14. Юлиш Е.И., Абатуров А.Е. Липосомальная терапия: настоящее и будущее // Здоровье ребенка. — 2009. — № 4.
15. Baron S., Tyring S.K., Fleischmann W.R. Jr., Coppenhaver D.H., Niesel D.W., Klimpel G.R., Stanton G.J., Hughes T.K. The interferons. Mechanisms of action and clinical applications // JAMA. — 1991. — Vol. 266, № 10. — P. 13751383.
16. Cohen J.I. EpsteinBarr virus infection // N. Engl. J. Med. — 2000. — 343. — 48192.
17. Principles and practice of pediatric infectious diseases / Ed. by S.S. Long, L.K. Pickering, C.G. Prober. — Churchill Livingstone Inc., 1997. — P. 1821.
18. Yershova I.B., Kosenko V.S., Osych nyuk L.M., Osipova T.F., Mochalovа A.A. Liposome forms of interferon in pediatric practice at treatment of acute respiratory viral infection in children // Клінічна педіатрія. — 2009. — № 2. — С. 21 (www.pediatric.mifua.com)
