Газета «Новости медицины и фармации» Инфекционные болезни (330) 2010 (тематический номер)
Вернуться к номеру
Механизмы, последствия бактериальных инфекций и управление ими у больных с заболеваниями печени
Авторы: В.В. Кобзева, ассистент, Донецкий национальный медицинский университет им. М. Горького
Версия для печати
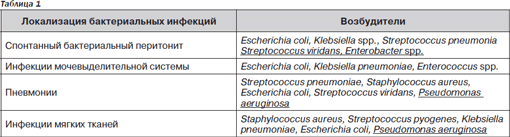
Одной из основных проблем у больных циррозом печени является риск развития бактериальных инфекций, который значительно выше в сравнении с общей популяцией. С другой стороны, бактериальные осложнения чаще встречаются у пациентов с декомпенсированным циррозом, чем с компенсированным. Последние могут иметь любую локализацию, однако наиболее частыми являются спонтанный бактериальный перитонит (СБП), инфекции мочевыделительной системы, пневмонии, бактериемия в результате медицинских манипуляций, целлюлит и спонтанная бактериемия (табл. 1) [1].
Механизмы, повышающие восприимчивость к бактериальным инфекциям, у больных циррозом печени не достаточно ясны. Спонтанная бактериемия, вероятно, играет ведущую роль в возникновении бактериальных осложнений у таких больных. Это особенно характерно для возникновения СБП, который в большинстве случаев является результатом перемещения грамотрицательных бактерий семейства Enterobacteriaceae из кишечника в системный кровоток. Кроме того, способными вызвать бактериальные осложнения, могут оказаться грамположительные бактерии, выделенные из мезентеральных лимфатических узлов, что чаще встречается у неинфицированных пациентов с циррозом печени в сравнении со здоровыми субъектами, более того, чем тяжелее заболевание печени, тем выше вероятность распространения этой грамположительной флоры [2]. Подтверждением этих гипотез является то, что применение селективных антибиотиков предупреждало развитие СБП у пациентов с циррозом печени [3]. Липополисахаридный комплекс, являющийся компонентом внешней мембраны грамотрицательных бактерий, может быть определен в плазме больных тяжелым циррозом печени, хотя существуют некоторые меж и индивидуальные особенности, которые могут быть связаны с короткой персистенцией липополисахаридного комплекса в крови человека. Обнаружение бактериальной ДНК в крови и асцитической жидкости предполагает распространение бактерий из крови в брюшную полость [4]. Высокая вероятность спонтанной бактериемии может быть объяснена двумя патофизиологическими механизмами: повышением проницаемости кишечной стенки и избыточным бактериальным ростом. Цирроз печени сам по себе является состоянием, сопровождающимся иммуносупрессией, что, в свою очередь, приводит к повышению восприимчивости к бактериальным осложнениям и увеличению риска смерти. Такая восприимчивость может быть объяснена несколькими причинами. Известно, что цирроз ассоциирован с повреждением макрофагальных рецепторов (Fcgreceptor mediated), что коррелирует с тяжелой бактериальной инфекцией. Нарушение синтетической функции печени вследствие печеночной недостаточности ведет к дефициту С3 и С4фрагментов комплемента, что также повышает чувствительность к бактериальным осложнениям. Снижение уровня белка в асцитической жидкости у этих пациентов ассоциировано со снижением опсонической активности, что существенно увеличивает риск возникновения СБП. У пациентов с терминальными стадиями заболевания и особенно с декомпенсированным циррозом печени имеет место нарушение регуляции экспрессии HLADR на поверхности моноцитов, что, в свою очередь, приводит к снижению способности антигенной презентации на поверхности антигенпрезентирующих клеток. Снижение экспрессии HLADR и повышение уровней IL4, IL6, IL10 и TNFa коррелирует с МНО, лактатом крови, pH и уровнем энцефалопатии, являясь предиктором плохого прогноза [5]. Кроме того, у пациентов с алкогольным циррозом присутствует подавление нейтрофильного фагоцитоза, что ассоциируется с возникновением бактериальных инфекций (особенно у пациентов с алкогольным гепатитом на фоне цирроза печени) [6]. Возникновение бактериальных осложнений, особенно СБП, может быть по крайней мере частично объяснено генетической предрасположенностью. Установлено, что пациенты с циррозом печени и носительством гена NOD2 имеют повышенный риск развития СБП и ограничение времени выживания [7], но при этом отсутствуют исследования, которые демонстрировали бы генетическую предрасположенность к другим бактериальным инфекциям, кроме СБП.
Повреждение печени в результате воздействия вирусов, лекарственных препаратов, токсинов или бактерий приводит к активации иммунной системы, изменению функции макрофагов, активации системы комплемента. Несовершенство иммунного ответа ведет к иммунной дисфункции, что ассоциировано с острой печеночной недостаточностью. Нарушение взаимодействия между двумя противоположными процессами (экспрессия про и противовоспалительных цитокинов) может быть главной причиной органной недостаточности и смерти от острой печеночной недостаточности независимо от этиологии [8]. Одним из наиболее интересных аспектов развития острой печеночной недостаточности и сепсиса является тот факт, что и защитные и повреждающие ответы являются частью одного и того же процесса. Так, например, бактерии выделяют макромолекулы (PAMPs), благодаря которым реализуется бактериальная инфекция. Появление этих макромолекул тут же распознается иммунной системой с помощью специальных, так называемых патогенных рецепторов (PRRs), запускается механизм разрушения микроорганизмов посредством активации клеток иммунной системы, продуцирующих провоспалительные цитокины и хемокины, которые приводят к увеличению экспрессии рецепторов, необходимых для эффективной активации клеточного звена иммунитета, продукции метаболитов арахидоновой кислоты и запуска коагуляционного каскада. При благоприятных условиях местное воспаление управляется многочисленными обратными связями, способствуя гибели возбудителей и регенерации поврежденной ткани. Однако в некоторых случаях по неизвестным причинам воспалительный ответ принимает более широкие масштабы, что, с одной стороны, выгодно для эффективной борьбы с инфекционным началом, а с другой — системное воспаление является разрушающим и приводит к органной недостаточности и смерти [9]. Данное явление описано как синдром системного воспалительного ответа (SIRS), появление и сохранение которого приводит к моно или полиорганной дисфункции и смерти пациента (табл. 2). Органная дисфункция приводит к тканевой гипоперфузии и гипоксии, гипоксия, в свою очередь, сопровождается снижением микроперфузии, что приводит к тромбообразованию, тканевому отеку в результате повышения сосудистой проницаемости, снижению перфузионного давления изза накопления оксида азота (NO) и пареза сосудистой стенки. Кроме того, клетки могут быть неспособными должным образом использовать доступный кислород изза ухудшения митохондриального дыхания, связанного с действием NO. Наконец, нейтрофильные инфильтраты приводят к прямому повреждению тканей в результате действия лизосомальных ферментов и свободных кислородных радикалов.

Таким образом, в результате иммунной дисфункции и преобладания провоспалительного ответа над противовоспалительным, пациенты с циррозом печени склонны к развитию сепсиса, органной недостаточности и смерти. Известно, что в раннюю фазу бактериального сепсиса уровень циркулирующих провоспалительных цитокинов, фактора некроза опухоли (TNFa) и IL6 значительно выше у пациентов с циррозом печени, чем без такового.
Печеночная недостаточность
Развитие сепсиса у пациентов с циррозом сопровождается быстрым ухудшением печеночной функции, что связано с плохим прогнозом [9]. В ходе экспериментальных исследований были получены данные, объясняющие высокий риск развития острой печеночной недостаточности при сепсисе у пациентов с циррозом печени. In vivo было показано, что липополисахаридный комплекс грамотрицательных бактерий способен вызывать продукцию TNFa, который кодирует проапоптотические сигналы. Однако TNFa не вызывает апоптоз нормальных гепатоцитов, в силу того что последние защищены ядерным фактором (NF), препятствующим апоптозу. Показано, что у животных с циррозом печени существует дефицит этого механизма, с одной стороны, и развитие эндотелин1опосредованной нейтрофильной инфильтрации и некроз гепатоцитов — с другой, что не наблюдалось в контрольной группе животных. Таким образом, данные, полученные в ходе эксперимента, предполагают, что острая печеночная недостаточность при экспериментальном циррозе печени является результатом двух процессов: TNFaиндуцированного апоптоза и/или эндотелин1опосредованного некроза.
Острая почечная недостаточность
Острая почечная недостаточность (ОПН) встречается у пациентов с циррозом печени и СБП в 33 % случаев, в 27 % случаев — с сепсисом, не связанным со СБП. Механизмы развития почечной недостаточности, индуцированной сепсисом у пациентов с циррозом печени, недостаточно изучены. Больные циррозом печени и тяжелым сепсисом (без шока) могут иметь почечную недостаточность, возникшую в ответ на неадекватную мочегонную терапию или не связанную с последней. Первая называется гепаторенальным синдромом (ГРС) 1го типа. У пациентов с циррозом и септическим шоком быстрое развитие почечной недостаточности связано с ишемией и острым тубулярным некрозом [10]. Для борьбы с ГРС 1го типа рекомендуется применение аналогов вазопрессина и альбумина, что является эффективным в 40 % случаев ГРС [11]. В случае отсутствия эффекта возможно применение гемодиализа, однако отношение к данному виду терапии ГРС неоднозначно [10].
Респираторная недостаточность
Основные функции легких также претерпевают изменения у больных циррозом печени в виде снижения антибактериальной активности альвеолярных макрофагов, повреждения линии Тлимфоцитов, повышения капиллярной проницаемости. В ходе эксперимента было продемонстрировано, что при циррозе печени увеличивается число легочных внутрисосудистых фагоцитов, повышается риск развития отека легких и смерти, связанных с действием липополисахаридного комплекса грамотрицательных бактерий. Все эти факторы усугубляются гиперпродукцией провоспалительных цитокинов и ON, что увеличивает вероятность развития острого респираторного дистресссиндрома (ОРДС) у больных циррозом печени. Пациенты с циррозом и сепсисом, у которых развился ОРДС, имеют более высокий фактор риска смерти в сравнении с пациентами, у которых развился ОРДС, но без цирроза и сепсиса [12].
Нарушение гемостаза
Цирроз ассоциирован с уменьшением синтеза в печени факторов свертывания (V, VII, X и протромбин) и антикоагулянтных факторов (протеин С, протеин S и антитромбин). Кроме того, для этих пациентов характерна тромбоцитопения вследствие гиперспленизма и/или образования аутоантител. Нарушение синтетической функции печени еще больше усугубляется у больных циррозом и сепсисом. Продукты деградации фибрина определяются у 40 % пациентов с циррозом печени и сепсисом, что способствует развитию диссеминированного внутрисосудистого свертывания [9].
Нарушение неврологического статуса
Острое нарушение неврологического статуса называют септической энцефалопатией, которая распространена у больных сепсисом. Нарушения со стороны нервной системы очень часто наблюдаются у больных с циррозом печени и сепсисом. Некоторые данные предполагают синергизм между системным воспалением и механизмами, вызывающими печеночную энцефалопатию. Гипераммониемия, присущая больным циррозом печени, вызывает существенное ухудшение в неврологическом статусе больных, имеющих синдром системного воспалительного ответа, высокую концентрацию провоспалительных цитокинов и метаболитов ON [13].
Антибиотикотерапия
Микробиологические образцы должны быть получены как можно раньше и перед началом эмпирической антибиотикотерапии. У пациентов с сепсисом, не имеющих цирроза печени, рано начатое лечение правильно подобранными антибиотиками связано с более высокой выживаемостью. В одном из исследований показано, что каждый час промедления терапии уменьшает выживаемость на 7,6 % [9]. Ранее последствия развития СБП и других тяжелых инфекций у пациентов с циррозом печени были драматическими, ситуация изменилась в лучшую сторону лишь за последние 30 лет. Улучшить прогноз пациентов с циррозом и развившимися бактериальными осложнениями можно двумя путями: ранней диагностикой и лечением адекватно подобранными антибиотиками. Антибиотикотерапия должна быть начата сразу же, как только установлен диагноз. Эмпирическая антибиотикотерапия должна назначаться с учетом эпидемиологических данных, распространенности антибиотикорезистентности, должна покрывать всех потенциальных возбудителей и не иметь серьезных побочных эффектов. Снижение в асцитической жидкости абсолютного числа лейкоцитов (PMN) менее чем на 25 % в сравнении с показателями числа лейкоцитов до начала антибиотикотерапии после 2 дней применения антибиотиков предполагает отсутствие ответа на терапию. В таких случаях следует подозревать вторичный перитонит (в результате перфорации или воспаления органов брюшной полости), что является руководством к замене антибиотиков в соответствии с чувствительностью к последним или на эмпирической основе. В настоящее время золотым стандартом в лечении большинства инфекций у больных циррозом печени считаются цефалоспорины третьего поколения. Было установлено, что внутривенное введение цефалоспоринов третьего поколения (цефотаксим) весьма эффективно у пациентов с СБП, так как цефотаксим покрывает большинство патогенных микроорганизмов и создает высокую концентрацию в асцитической жидкости [14–20]. Разрешение инфекций наблюдалось у 80 % пациентов, получавших цефотаксим внутривенно в дозе 4 г либо 8 г в сутки в течение 5 или 10 дней. Альтернативой цефотаксиму может быть амоксициллина клавуланат, применение которого вначале в/в, затем перорально дает результаты, подобные цефотаксиму, по разрешению СБП и снижению показателей внутригоспитальной смертности, но с меньшей стоимостью. Однако некоторые авторы полагают, что рекомендации по применению защищенных пенициллинов основывались на результатах рандомизированных контролируемых исследований, выполненных в течение 1980–90х гг., в которых доля внутрибольничных случаев была низкой [21]. Кроме того, в последние годы произошли значительные изменения в эпидемиологии и профиле антибиотикорезистентных штаммов бактерий, вызывающих СБП и другие бактериальные осложнения у больных циррозом печени, с большим распространением грамположительных кокков и энтеробактерий, требующих применения bлактамов широкого спектра. Применение фторхинолонов оказалось столь же эффективным, как и цефалоспоринов третьего поколения. Ципрофлоксацин при внутривенном введении в течение 7 или 2 дней внутривенно, затем 5 дней перорально увеличивал выживаемость пациентов с СБП подобно цефотаксиму, но с более высокой стоимостью. Однако ступенчатая терапия фторхинолонами (с переходом от внутривенного введения к пероральному) была показана как более эффективная в отношении «цена — качество» по сравнению с внутривенным введением цефтазидима [22]. Но в случае если пациент длительное время получал норфлоксацин с профилактической целью, использование фторхинолонов нецелесообразно, так как существует вероятность того, что бактериальная инфекция вызвана хинолонустойчивыми штаммами. В ранее проведенных исследованиях предполагали, что риск развития СБП или других инфекций, вызванных хинолонустойчивыми штаммами грамотрицательных бацилл, низкий. Большинство случаев повторного СБП у пациентов, получавших норфлоксацин с профилактической целью, были вызваны грамположительными кокками, главным образом стрептококками [21]. Однако в последующих исследованиях сообщалось о высоком риске выделения хинолонрезистентных штаммов E.сoli из кала больных циррозом печени, подвергшихся длительной профилактике фторхинолонами. В 1997 г. были опубликованы результаты первого исследования, которое предполагало долговременную профилактику СБП норфлоксацином. Исследование продемонстрировало появление инфекций, главным образом мочевыделительной системы, вызванных хинолонустойчивыми штаммами грамотрицательных бацилл [23]. Результаты последующих исследований показали, что 37 % бактериальных инфекций у госпитализированных больных с циррозом печени были вызваны хинолонрезистентными штаммами E.coli, причем длительное применение норфлоксацина являлось фактором риска для развития хинолонрезистентных бактериальных осложнений (главным образом мочевыделительной системы) [24]. Более поздние исследования, опубликованные в 2002 и 2008 гг., демонстрировали подобные результаты по частоте бактериальных осложнений, вызванных хинолонрезистентными штаммами E.coli у пациентов, получавших для профилактики норфлоксацин (26 и 38 % соответственно). В этих же исследованиях сообщают о высокой частоте СБП, вызванного триметоприм/сульфаметоксазолустойчивыми штаммами грамотрицательных бактерий (44–72 %), сообщая о том, что этот антибиотик не может быть альтернативой норфлоксацину [25, 26].
Инфекции мочевыводящих путей
Фторхинолоны и триметоприм/сульфаметоксазол являются препаратами первой линии для лечения инфекций мочевыводящих путей в общей популяции. Длительное применение норфлоксацина с профилактической целью является фактором риска развития резистентности к фторхинолонам и триметоприму/сульфаметоксазолу у пациентов с инфекциями мочевыводящих путей. В данной ситуации хорошей альтернативой могут быть амоксициллина клавуланат или цефотаксим [22].
Пневмония
Эмпирический подход к назначению антибиотиков для лечения пневмоний в общей популяции включает применение амоксициллина/клавуланата и цефалоспоринов третьего поколения в сочетании с макролидами или левофлоксацином в случае сопутствующего иммунодефицита. У пациентов с циррозом печени подход к лечению пневмоний такой же, как и в общей популяции, при этом факт заболевания печени рассматривается как тяжелое коморбидное состояние [9]. Необходимо учитывать тот факт, что такой эмпирический подход является неприемлемым в случае пневмоний, вызванных Pseudomonas aeruginosa или метициллинрезистентными штаммами Staphylococcus aureus. В этом случае необходимо использовать пиперациллина тазобактам в сочетании с ципрофлоксацином при подозрении на пневмонии, вызванные Pseudomonas aeruginosa, и ванкомицин в случае пневмоний, возбудителем которых является метициллинрезистентные штаммы Staphylococcus aureus [22].
Инфекции, вызванные широким спектром мультирезистентных энтеробактерий, продуцирующих β-лактамазы, и другими мульти-резистентными штаммами
Бактериальные осложнения, вызванные мультирезистентными Enterobacteriaceae, главным образом продуцирующими широкий спектр bлактамаз, и метициллинрезистентными штаммами S.aureus, в большинстве случаев являются внутрибольничными инфекциями и вызывают 28 % случаев СБП, 63 % — инфекций мочевыводящих путей, 29 % — пневмоний, 36 % — целлюлитов [27]. Эффективность классической эмпирической антибиотикотерапии при внутрибольничных инфекциях, вызванных мультирезистентными штаммами грамотрицательных и грамположительных бактерий, гораздо ниже, чем при соответствующих внебольничных осложнениях [22]. Большинство из этих бактерий продуцируют ферменты, гидролизирующие цефалоспорины и широкий спектр пенициллинов, что объясняет клиническую неэффективность этих антибиотиков. Факторами риска развития инфекций, вызванных мультирезистентными штаммами, являются настоящая или недавняя госпитализация, антибиотикотерапия, главным образом фторхинолонами или bлактамами, использование норфлоксацина в целях профилактики [21]. В ходе одного из исследований оценивали все бактериальные инфекции, диагностированные у 224 больных циррозом печени в течение 2 лет (2005–2007 гг.). Результаты исследования продемонстрировали, что наиболее частым бактериальным осложнением был СБП — 126 случаев, 25 % из которых были вызваны внутрибольничными штаммами. Широкий спектр bлактамазпродуцирующих мультирезистентных энтеробактерий был выделен главным образом из асцитической жидкости больных циррозом печени и СБП. Разрешение бактериальных инфекций при применении цефтриаксона наблюдалось в 76 % внегоспитальных случаев и только в 26 % случаев внутрибольничных бактериальных осложнений. Это исследование также показало высокую распространенность инфекций мочевыводящих путей, вызванных мультирезистентными бактериями, не только как внутрибольничных (60 %), но и как внебольничных инфекций (22 %), основным возбудителем которых являлись энтеробактерии, продуцирующие широкий спектр bлактамаз или хромосомные bлактамазы класса С (AmpC) и Enterococcus faecium. Эффективность от применения цефалоспоринов третьего поколения или амоксициллина клавуланата была значительно выше в случаях внебольничных бактериальных инфекций — 71 % против 32 % в случаях внутрибольничных инфекций, вызванных мультирезистентными штаммами. Кроме того, мультирезистентные штаммы были причиной внутрибольничных осложнений, таких как спонтанная бактериемия (38 %) и целлюлит (27 %) [27]. Таким образом, полученные в ходе исследования данные позволяют заключить, что цефалоспорины третьего поколения и амоксициллин/клавуланат не соответствуют требованиям эмпирической антибиотикотерапии СБП и других инфекций у больных циррозом печени, имеющих высокий риск осложнений, вызванных мультирезистентными штаммами, особенно в условиях стационара. В таких случаях эмпирическая антибиотикотерапия должна включать антибиотики с более широким спектром действия, такие как карбопенемы или тигециклины. Выбор определенного антибиотика будет зависеть от того, какой именно возбудитель распространен в конкретном стационаре, и от характера антибиотикорезистентности.
Инфекции мягких тканей
Кроме S.aureus и Streptococcus pyogenes, инфекции мягких тканей могут вызывать такие возбудители, как энтеробактер и анаэробы. Препаратами выбора в таких случаях могут быть цефтазидим в сочетании с оксациллином [9].
Предупреждение органной недостаточности
Открытые рандомизированные клинические исследования, включающие пациентов с циррозом печени и СБП, получающих цефотаксим, показали, что назначение 20% раствора альбумина в дозе 1,5 г/кг массы тела в пределах 6 часов с момента постановки диагноза СБП, в дальнейшем 1 г/кг трижды в день предупреждало развитие почечной недостаточности и снижало смертность с 29 до 10 %. Однако данный эффект не наблюдался у пациентов с низким риском смертности (общий билирубин < 4 мг/дл и креатинин < 1 мг/дл). При этом отсутствуют какиелибо данные об эффекте от применения альбумина у пациентов с циррозом печени и бактериальными инфекциями, не связанными с СБП [22].
Инфекция, вызванная Clostridium difficile
Антибиотикотерапия, госпитализация, пожилой возраст и химиотерапия — главные факторы риска развития тяжелой бактериальной инфекции, вызванной Clostridium difficile. В ходе недавних клинических исследований было показано, что пациенты с циррозом печени также являются группой риска для развития осложнений, вызванных Clostridium difficilе, которые оказывают отрицательное влияние на госпитальную смертность. Установлено, что антибиотикотерапия и амбулаторное применение ингибиторов протонной помпы являются факторами риска развития данной инфекции у больных циррозом печени [28]. С учетом тяжести данного осложнения и высокой летальности необходимо: 1) госпитализированных с циррозом печени больных мониторировать на предмет возможной инфекции, вызванной Clostridium difficilе, 2) использовать ингибиторы протонной помпы только в случае необходимости, 3) грамотно назначать антибиотики и избегать профилактики фторхинолонами у пациентов, имеющих высокий риск развития инфекции, вызванной Clostridium difficilе.
Грибковый и вирусный сепсис
Тяжелый аспергиллез обычно наблюдается у пациентов с длительной нейтропенией, злокачественными опухолями, трансплантацией органа. Однако существуют сообщения о развитии грибковой инфекции у пациентов, не имеющих перечисленных факторов риска. Тяжелый цирроз печени, особенно у пациентов, длительно пребывающих в отделении интенсивной терапии, и с другими иммуносупрессивными состояниями (гормонотерапия, ВИЧ и т.д.), был определен некоторыми авторами как фактор риска развития этой оппортунистической инфекции. Также появляется все больше и больше сообщений о пациентах с выраженным циррозом печени и развившимся тяжелым кандидозом, чаще находящихся в отделении интенсивной терапии. Эти пациенты, как правило, имеют несколько факторов риска развития этой инфекции, такие как эндотрахеальная интубация, механическая вентиляция, центральная венозная или мочевая катетеризация, длительная антибиотикотерапия и гормонотерапия. И наконец, существуют немногочисленные сообщения о вирусной инфекции у пациентов с тяжелым циррозом печени и отсутствием других факторов риска, таких как ВИЧ или длительная гормонотерапия. Были описаны несколько случаев эзофагита, вызванного вирусом простого герпеса у пациентов с тяжелым алкогольным гепатитом, получавших гормоны [21].
Таким образом, бактериальные инфекции у больных хроническими заболеваниями печени представляют важную клиническую проблему. Фундаментальные вопросы, касающиеся патогенеза развития бактериальных осложнений, все еще не решены. Индивидуальный иммунный ответ на инфекционное начало может быть моделирован множеством факторов, включая этиологию, генетический фон, коморбидные состояния и внешние факторы. Все эти особенности подчеркивают сложности в планировании эффективных методов лечения. Дальнейшее изучение механизмов восприимчивости к бактериальным инфекциям, звеньев патогенеза бактериальных осложнений у больных хроническими заболеваниями печени является необходимым для определения новых целей терапии.
1. Fernandez J., Navasa M., Gуmez J., Colmenero J., Vila J., Arroyo V. et al. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis // Hepatology. — 2002. — 35. — 140148.
2. Cirera I., Bauer T.M., Navasa M., Vila J., Grande L., Taura P., Fuster J., GraciaValdecasas J.C., Lacy A., Suarez M.J., Rimola A., Rodеs J. Bacterial translocation of enteric organisms in patients with cirrhosis // J. Hepatol. — 2001. — 34. — 3237.
3. Gines P., Rimоla A., Planas R., Vargas V., Marco F., Almela M., Fornе M., Miranda M.L., Llach J., Salmerуn J.M., Esteve M., Marquеs J.M., Jimеnez de Anta M.T., Arroyo V., Rodеs J. Norfloxacin prevents spontaneous bacterial peritonitis recurrence in cirrhosis: results of a doubleblind, placebocontrolled trial // Hepatology. — 1990. — 12. — 716724.
4. Such J., Frances R., Muсoz C., Zapater P., Casellas J.A., Cifuentes A., RodriguezValera F., Pascual S., SolaVera J., Carnicer F., Uceda F., Palazon J.M., PerezMateo M. Detection and identification of bacterial DNA in patients with cirrhosis and culturenegative noneutrocytic ascites // Hepatology. — 2002. — 36. — 135141.
5. Antoniedes C.G., Berry P.A., Davies E.T., Hussain N., Bernal W., Vergani D., Wendon J. Reduced monocyte HLADR expression: a novel biomarker of disease severity and outcome in acetaminopheninduced acute liver failure // Hepatology. — 2006. — 44. — 3443.
6. Mookerjee R.P., Stadlbauer V., Lidder S., Wright G.A.K., Hodges S.J., Davies N.A., Jalan R. Neutrophil dysfunction in alcoholic hepatitis superimposed on cirrhosis is reversible and predicts the outcome // Hepatology. — 2007. — 46. — 831840.
7. Appenrodt B., Grunhage F., Gentemann M.G., Thyssen L., Sauerbruch T., Lammert F. NOD2 variants are genetic risk factors for death and spontaneous bacterial peritonitis in liver cirrhosis // Hepatology. — 2010; in press.
8. Antoniades C.G., Berry P.A., Wendon J.A., Vergani D. The importance of immune dysfunction in determining outcome in acute liver failure // J. Hepatol. — 2008. — 49. — 84561.
9. Gustot T., Durand F., Lebrec D., Vincent J.L., Moreau R. Severe sepsis in cirrhosis // Hepatology. — 2009. — 50. — 20222033.
10. Moreau R., Lebrec D. Acute renal failure in patients with cirrhosis: perspectives in the age of MELD // Hepatology. — 2003. — 37. — 233243.
11. Salerno F., Gerbes A., Gines P., Wong F., Arroyo V. Diagnosis, prevention and treatment of hepatorenal syndrome in cirrhosis // Gut. — 2007. — 56. — 13101318.
12. Matuschak G.M. Lungliver interactions in sepsis and multiple organ failure syndrome // Clin. Chest Med. — 1996. — 17. — 8398.
13. Shawcross D.L., Davies N.A., Williams R., Jalan R. Systemic inflammatory response exacerbates the neuropsychological effects of induced hyperammonemia in cirrhosis // J. Hepatol. — 2004. — 40. — 247254.
14. Rimуla A., GarciaTsao G., Navasa M., Piddock L.J., Planas R., Bernard B., Inadomi J.M. Diagnosis, treatment and prophylaxis of spontaneous bacterial peritonitis: a consensus document. International Ascites Club // J. Hepatol. — 2000. — 32. — 142153.
15. Felisart J., Rimola A., Arroyo V., PerezAyuso R.M., Quintero E., Gines P., Rodes J. Cefotaxime is more effective than is ampicillintobramycin in cirrhotics with severeinfections // Hepatology. — 1985. — 5. — 457462.
16. Rimola A., Salmerуn J.M., Clemente G., Rodrigo L., Obrador A., Miranda M.L., Guarner C., Planas R., Sola R., Vargas V. et al. Two different dosages of cefotaxime in the treatment of spontaneous bacterial peritonitis in cirrhosis: results of a prospective, randomized, multicenter study // Hepatology. — 1995. — 21. — 674679.
17. Navasa M., Folio A., Llovet J.M., Clemente G., Vargas V., Rimуla A., Marco F., Guarner C., Forne M., Planas R., Baсares R., Castells L., Jimenez De Anta M.T., Arroyo V., Rodes J. Randomized, comparative study of oral ofloxacin versus intravenous cefotaxime in spontaneous bacterial peritonitis // Gastroenterology. — 1996. — 111. — 10111017.
18. Sort P., Navasa M., Arroyo V., Aldeguer X., Planas R., RuizdelArbol L. et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis // N. Engl. J. Med. — 1999. —341. — 403409.
19. Ricart E., Soriano G., Novella M.T., Ortiz J., Sabat M., Kolle L., SolaVera J., Mifiana J., Dedu J.M., Gуmez C., Barrio J.L., Guarner C. Amoxicillinclavulanic acid versus cefotaxime in the therapy of bacterial infections in cirrhotic patients // J. Hepatol. — 2000. — 32. — 596602.
20. Terg R., Cobas S., Fassio E., Landeira G., Rнos B., Vasen W., Abecasis R., Rios H., Guevara M. Oral ciprofloxacin after a short course of intravenous ciprofloxacin in the treatment of spontaneous bacterial peritonitis: results of a multicenter, randomized study // J. Hepatology. — 2000. — 33. — 564569.
21. Fernandez J. Changes in the epidemiology of infections in cirrhosis. The role of antibiotic resistance, Clostridium Difficile infection, viral and fungal sepsis // J. Postgraduate course: management of acute critical conditions in hepatology. — 2010. — 6267.
22. Gustot T., Moreau R. Mechanisms, consequences and management of infections in liver disease // J. Postgraduate course: management of acute critical conditions in hepatology. — 2010. — 5361.
23. Novella M., Sola R., Soriano G., Andreu M., Gana J., Ortiz J., Coll S., Sabat M., Vila M.C., Guarner C., Vilardell F. Continuous versus inpatient prophylaxis of the first episode of spontaneous bacterial peritonitis with norfloxacin // J. Hepatology. — 1997. — 25. — 532536.
24. Ortiz J., Vila M.C., Soriano G., Minana J., Gana J., Mirelis B., Novella M.T., Coll S., Sabat M., Andreu M., Prats G., Sola R., Guarner C. Infections caused by E.Coli resistant to norfloxacin in hospitalized cirrhotic patients // J. Hepatology. — 1999. — 29. — 10641069.
25. Fernandez J., Navasa M., Gomez J., Colmenero J., Vila J., Arroyo V., Rodes J. Bacterial infections in cirrhosis: epidemiological changes with invasive procedures and norfloxacin prophylaxis // J. Hepatology. — 2002. — 35. — 140148.
26. Cerato F., Herranz X., Moreno E., Andreu A., Vergara M., Fontanals D., Roget M., Simo M., Gonzalez A., Prats G., Genesca J. Role of host and bacterial virulence factors in E.Coli spontaneous bacterial peritonitis // Eur. J. Gastroenterol. Hepatol. — 2000. — 20. — 9249.
27. Acevedo J., Fernandez J., Castro M., Garcia O., Rodriguezde Lopez C., Navasa M., Gines P., Arroyo V. Current efficacy of recommended empirical antibiotic therapy in patients with cirrhosis and bacterial infection // J. Hepatol. — 2009. — 50, suppl. 1. — S5.
28. Bajaj J.S., Ananthakrishnan A.N., Hafeezullah M., Zadvornova Y., Dye A., McGinley E.L., Saeian K., Heuman D., Sanyal A.J., Hoffmann R.G. Clostridium difficile is associated with poor outcomes in patients with cirrhosis: A national and tertiary center perspective // Am. J. Gastroenterol. — 2010. — 105. — 10613.
