Газета «Новости медицины и фармации» 13–14(333–334)
Вернуться к номеру
Ефективність Тіотриазоліну в лікуванні ішемічної хвороби серця в комбінації зі стандартною терапією Результати подвійного сліпого рандомізованого плацебо-контрольованого дослідження
Авторы: В.З. Нетяженко, Т.Й. Мальчевська, Національний медичний університет ім. О.О. Богомольця
Версия для печати
Лікування ішемічної хвороби серця (ІХС) тривалий час розглядалося з позицій покращення кардіогемодинаміки. Відомо, що патогенетично обумовлена дія традиційних лікарських засобів спрямована на зниження потреби міокарда в кисні або на збільшення надходження кисню до кардіоміоцита. Препарати, що впливають на гемодинамічні параметри, ефективні, коли йдеться про профілактику нападів стенокардії, але фактично не захищають клітину міокарда від ішемічних змін.
Ось чому останніми десятиліттями науковий пошук фармакологів, фармацевтів і клініцистів був спрямований на синтез, створення та впровадження в медичну практику кардіопротекторів — засобів, що успішно усувають порушення клітинного метаболізму, іонного гомеостазу та функцій мембран кардіоміоцитів, попереджуючи розвиток необоротних процесів у міокарді. І на сьогодні метаболічна терапія зайняла повноправне чільне місце в схемах лікування серцево-судинної патології, увійшовши до міжнародних рекомендацій [1–4].
Виникнення метаболічного підходу в лікуванні ІХС традиційно пов’язують з глюкозоінсуліновокалієвою сумішшю (ГІК), яку в 1962 році D. SodiPallaris та співавтори вперше застосували в нерандомізованому дослідженні й показали, що вона позитивно впливає на динаміку ЕКГ при гострому інфаркті міокарда, покращує раннє виживання. У наступних дослідженнях було продемонстровано, що ГІК, як і нікотинова кислота, знижує вивільнення вільних жирних кислот (ВЖК) адипозоцитами, а це, у свою чергу, призводить до зниження концентрації ВЖК в зоні ішемізованого міокарда. Отримані дані дозволили зробити висновок про те, що, блокуючи окислення ВЖК, можна досягти значної активації окислення глюкози. Саме такий фармакологічний підхід отримав найбільше поширення в метаболічній терапії ІХС та стабільної стенокардії напруги. Ось чому оптимальним ефектом метаболічної терапії вважають покращення ефективності поглинання кисню міокардом в умовах ішемії [7, 14, 16, 18].
Арсенал медикаментозних засобів із визнаною метаболічною дією із року в рік поповнюється. У кардіологічній практиці широко застосовуються препарати з метаболічною дією, серед яких такі загальновизнані, як триметазидин, ранолазин, Тіотриазолін, Lкарнітин, мілдронат, мексикор, кверцетин, кардонат, а в неврологічній — актовегін, мексидол, ноотропіл, інстенон, Тіотриазолін, яким притамана найбільша тропність до міокарда чи нервової тканини. Більшість із засобів пройшли порівняльні дослідження та підтвердили свою клінічну ефективність. Позитивними рисами метаболічних засобів є повна відсутність небажаних гемодинамічних впливів, добра переносимість пацієнтами усіх вікових груп, спрямованість впливу на глибинні метаболічні механізми розвитку ішемії й кардіоцитопротекції. Раціональне утворення та використання енергії є ключовим моментом у розвитку кардіальної патології, а засоби метаболічної спрямованості підвищують стійкість тканин до гіпоксії й наслідків реперфузії. Останнім часом метаболічна терапія стала одним із напрямків у лікуванні коронарогенної серцевої недостатності [5, 6].
Незаперечні докази фармакологічного захисту міокарда при синдромі ішемії — реперфузії знайшли своє відображення в рекомендаціях Європейського товариства кардіологів (ЄТК) 2006 року щодо призначення метаболічної терапії хворим на стабільну стенокардію. Зокрема, ЄТК рекомендовано для зменшення вираженості симптомів і проявів ішемії застосовувати по можливості метаболічні засоби (триметазидин, ранолазин) (клас ІІв) як додаткову терапію або при непереносимості загальноприйнятої — замість неї.
Ішемічні та реперфузійні синдроми, як часті супутники ішемічної хвороби серця (ІХС) при атеросклеротичному ураженні судин, та власне ішемія міокарда характеризуються недостатнім забезпеченням тканин киснем, виснаженням запасів АТФ і креатинфосфату в кардіоміоциті, переключенням гліколізу з аеробного на анаеробний шлях, підсиленням внутрішньоклітинного ацидозу, дисфункцією іонних насосних каналів, підвищенням рівня натрію, кальцію, зниженням рівня калію в цитоплазмі кардіоміоцитів. Розбалансованість окислювальновідновних процесів у мітохондріях призводить до необмеженого утворення вільних радикалів та інших агресивних чинників, які не лише пошкоджують клітинну мембрану кардіоміоцита, але й ініціюють клітинний апоптоз [7, 14, 15, 17, 18]. Порушення процесів мікроциркуляції, ендотеліальна дисфункція, активація системи фагоцитуючих мононуклеарів, Тлімфоцитів і лейкоцитів, тобто імунного й системного запалення, із активацією індукторів клітинного апоптозу і наступним ремоделюванням лівого шлуночка — ось той неповний перелік багатогранності проявів ішемічної кардіоміопатії.
Щоб осягнути особливості енергетичного метаболізму в здоровому й ішемізованому міокарді, слід нагадати, що в міокарді за фізіологічних умов синтез АТФ як головного субстрату енергетичного метаболізму реалізується через цикли катаболізму глюкози й вільних жирних кислот (ВЖК), що є динамічно урівноваженими. На долю жирних кислот (пальмітинова, стеаринова) припадає 60–80 % синтезу АТФ, у той час як гліколітичний шлях синтезу АТФ складає 20–30 % від усієї енергії, що виробляється в серці. Для порівняння: із 1 молекули пальмітинової кислоти синтезується 134, стеаринової кислоти — 147 молекул АТФ, у той час як із 1 молекули глюкози — 32 молекули АТФ. У здоровому міокарді енергозабезпечення здійснюється за рахунок аеробного bокислення ВЖК з подальшим відщепленням ацетилКоА, причому за більшої потреби в кисні. Так, для утворення тієї ж кількості АТФ із ВЖК необхідно на 17 % більше кисню, ніж при окисленні глюкози. У реакції циклу трикарбонових кислот катаболізм ліпідів і глюкози здійснюється за загальноприйнятим шляхом, проте обумовлює конкуренцію за можливість окислення.
Енергія АТФ витрачається наступним чином:
— 75–80 % — на забезпечення скоротливої здатності міокарда і транспорт іонів Na+, K+, Ca2+ через сарколеми й мітохондріальні мембрани;
— 20–25 % — на збереження об’єму мітохондрій, ресинтез глікогену, активування циклу Кребса.
Звісно, глюкоза є не менш важливим енергетичним субстратом. В умовах дефіциту кисню глюкоза здатна пригнічувати окислення ВЖК. Глюкоза надходить у міокард чи утворюється з ендогенного глікогену (її енергетичного резерву при ішемії). Запаси глікогену в міокарді складають не більше ніж 1 % від загального об’єму клітин.
Відомо, що метаболізм глюкози здійснюється двома шляхами: аеробним і анаеробним.
Аеробний гліколіз: у разі окислювального фосфорилювання в мітохондріях в піруватдегідрогеназному циклі трикарбонових кислот окислення глюкози здійснюється за участі кисню з утворенням пірувату, що призводить до синтезу незначної, менше 10 %, кількості АТФ і під впливом ферменту піруватдегідрогенази конвертується в ацетилкоензим А. Для прикладу: окислення 2 моль пірувату супроводжується синтезом 30 молекул АТФ і ця реакція інгібується надлишком ацетилкоензиму А і ВЖК. З погляду кількості синтезованої енергії аеробний гліколіз є більш продуктивним метаболізмом глюкози.
Анаеробний гліколіз — метаболізм глюкози в цитозолі кардіоміоцита без участі кисню. Анаеробний шлях включає схожі шляхи перетворювання глюкози до пірувату, але з наступним перетворенням пірувату в лактат (молочну кислоту). За відсутності або при дефіциті в клітині кисню піровиноградна кислота підлягає відновленню до молочної кислоти. Такий механізм є менш енергетично вигідним, проте він відіграє неабияку роль при виникненні ішемії міокарда.
Щодо енергетичного метаболізму за умов ішемії міокарда, відомо, що при гіпоперфузії порушується утворення енергії й вичерпуються її резерви. При зменшенні надходження кисню в кардіоміоцит в мітохондріях накопичується велика кількість недоокислених жирних кислот із руйнівною дією стосовно клітинних мембран.
Серед пошкоджуючих механізмів виділяють наступні:
— інгібування утилізації глюкози під час ішемії й реперфузії;
— розрізненість окислення в електроннотранспортному ланцюгу мітохондрій;
— порушення властивостей мембранних ферментів;
— пригнічення функції мітохондрій і швидкості продукції АТФ;
— підвищення проникливості мембран для іонів Са2+, що супроводжується підвищенням бетаадренергічної відповіді міокарда.
При виникненні ішемії в кардіоміоцитах не відбувається адекватного синтезу креатинфосфату і АТФ, концентрація останньої прогресивно та швидко падає, активується анаеробний гліколіз, при якому із пірувату синтезується лактат і лише 2 молекули АТФ. Анаеробний гліколіз не може покрити енергетичну потребу кардіоміоцита, оскільки забезпечує синтез не більш ніж 50 % необхідної АТФ. Надлишок лактату, надходячи в клітину, є характерною ознакою ішемії.
В умовах ішемії активація гліколітичних шляхів утворення АТФ набуває першочергового значення. За умов енергодефіциту кардіоміоцити починають використовувати глюкозу з ендогенного глікогену, оскільки вона вже фосфорильована (на відміну від екзогенної глюкози, що транспортується в клітину) і її утилізація не потребує витрат АТФ для початкової активації. Проте запаси глікогену в кардіоміоцитах виснажуються достатньо швидко, через що виникає необхідність активації резервних шляхів утворення АТФ.
Короткочасно підтримувати енергетичний стан серця в умовах обмеженої доставки кисню може розпад 1 молекули глюкози до двох молекул пірувату при фосфогліцераткіназній і піруваткіназній реакціях, у результаті яких АДФ фосфорилюється до АТФ.
Отже, клітинним метаболізмом при ішемії міокарда є використання ендо і екзогенного пірувату, який активно поглинається міокардом із крові. Піруват переноситься до мітохондрій, де за участі піруватдегідрогенази трансформується в ацетилКоА. Активність піруватдегідрогенази вважається рушійним фактором у гліколітичному шляху утворення енергії. Із 1 молекули глюкози при трансформації в піруват утворюються 2 молекули АТФ, а при наступному окисленні пірувату в циклі трикарбонових кислот — 34 молекули АТФ. При ішемії «переключається» метаболізм кардіоміоцита на використання ЖК на заміну окислення інших субстратів, зокрема глюкози. Проте це вимагає на 15 % більших витрат молекулярного кисню, і «киснева вартість» окислення глюкози є дещо нижчою за окислення ЖК, через що в умовах ішемії більшу перевагу складає шлях окислення глюкози, який дозволяє ефективно використовувати залишковий кисень.
Отже, в умовах ішемії сповільнюється робота дихального ланцюга у циклі Кребса, поступово зменшується утворення ацетилКоА, падає швидкість окислення не лише глюкози, а й ЖК. Накопичені недоокислені ЖК роз’єднують тканинне дихання, сприяють розвитку ацидозу, перевантаженню клітини кальцієм і натрієм, що неминуче порушує розслаблення кардіоміоцита й надалі — скоротливість.
Раніше проведені дослідження встановили, що аеробний метаболізм припиняється при сповільненні коронарного кровотоку менше за 0,56 мл/хв/кг маси міокарда. При поглибленні ішемії єдиним можливим механізмом синтезу АТФ стає анаеробний гліколіз з утворенням АТФ і лактату. Під впливом лактатдегідрогенази молочна кислота може окислюватися знову, утворюючи піруват, який і бере участь у наступних перетвореннях. Надлишок молочної кислоти формує тканинний лактоацидоз, який роз’єднує окислювальне фосфорилювання та викликає перевантаження кардіоміоцитів Са2+. Лактоацидоз, активуючи фосфоліпазу А2, обумовлює пошкодження мембранних структур і ініціює процеси перекисного окислення ліпідів. Надлишок лактату зсуває рівновагу у бік ацидозу, який активує периферичні больові рецептори сегментів С7Т4 спинного мозку, викликаючи розвиток ангінозних болів. Формується гіпоксичний тип метаболізму. Ось чому зниження рівня внутрішньоклітинного лактату через трансформацію в піруват є ключовим в метаболічній терапії.
Отже, одним із основних завдань метаболічної терапії є гальмування окислення ВЖК і «переключення» метаболізму кардіоміоцита на окислення глюкози, що надасть можливість більш ефективного використання залишкового кисню.
Значний прогрес, який останніми роками був досягнутий у розумінні ролі енергетичного метаболізму серця в патогенезі ішемії міокарда, спонукав до розробки нової метаболічної концепції в лікуванні хворих із ІХС. Оптимізація енергетичного метаболізму міокарда базується на підвищенні окислення глюкози міокарда, що підсилює функціональну спроможність серця та захищає міокард від ішемічних і реперфузійних пошкоджень. За умов хронічної гіпоперфузії використання глюкози міокардом може покращуватися при модуляції метаболізму ВЖК не без допомоги препаратів, що інгібують їх окислення. Із урахуванням різнобічності патогенетичних механізмів формування, прогресування ішемічної хвороби серця (ІХС) як найбільш поширеної патології та різноманіття механізмів захисту міокарда, класифікація медикаментозних засобів із кардіопротекторними властивостями є дещо умовною. Так, серед широковживаних препаратів із кардіопротекторним ефектом виділяють препарати прямої дії, які безпосередньо зменшують вираженість впливу патогенних факторів на кардіо міоцит, та непрямої, що зменшують навантаження на серцевий м’яз. Ефект прямих кардіопротекторів обумовлений місцевим впливом на метаболізм безпосередньо в кардіоміоцитах, стабілізацією клітинних мембран, розширенням коронарних судин і центральним впливом на активність нервових центрів, регулюючих судинний тонус [7]. До кардіопротекторів із прямою дією належить і Тіотриазолін, вітчизняний препарат, що є класичним антиоксидантом. Впливаючи на енергетичні процеси міокарда, він зменшує потребу міокарда в кисні як основної патофізіологічної детермінанти ішемії міокарда. Окрім того, він стабілізує мембрану кардіоміоцитів, справляє антиаритмічний ефект, має виражену анаболічну спроможність.
За умов гіпоперфузії міокарда Тіотриазолін ефективно вирівнює дисбаланс в системі аденінових нуклеотидів АТФ — АДФ — АМФ, запобігає швидкому виснаженню енергетичних ресурсів клітин та переходу їх метаболізму на енергетично менш вигідний анаеробний шлях окислення глюкози. Знижений вміст креатинфосфокінази при лікуванні хворих на стабільну стенокардію відображає його позитивний вплив на енергетичний обмін і стабілізацію мембран кардіоміоцитів. За умов тканинної гіпоксії Тіотриазолін ефективно коригує зміни в циклі Кребса. За здатністю знижувати рівень молочної, а також підвищувати вміст піровиноградної і яблучної кислот Тіотриазолін втричі переважає пірацетам.
Експериментально встановлена здатність Тіотриазоліна зменшувати на 42 % зону ішемії й некрозу міокарда, що статистично вірогідно було вищим за застосування карнітину хлориду як визнаного антиоксиданту, і це справляло позитивний вплив на показники ішемічного пошкодження міокарда. Кардіопротекторний ефект Тіотриазоліну реалізувався через вплив на біоенергетичний обмін ішемізованого міокарда, що супроводжувалось зростанням рівня ендогенного глікогену й зменшенням рівня ВЖК, що було відтворено на тваринних моделях.
Останнім часом показано, що антиангінозна дія притаманна метаболічним препаратам: триметадизину, ранолазину, Lкарнітину і вітчизняному препарату — Тіотриазоліну.
Багаточисленні роботи присвячені вивченню ефективності Тіотриазоліну у хворих із різними формами ІХС, зокрема зі стабільною стенокардією. Аналіз досліджень показав, що препарат включали в комплекс метаболічної терапії у хворих зі стабільною стенокардією І–IV ФК і з вираженими ЕКГознаками ішемії, постінфарктним кардіосклерозом в осіб похилого віку. Якщо триметазидин суттєво не впливав на показники кардіогемодинаміки, статистично вірогідно не змінював рівень систолічного АТ і частоти серцевих скорочень, то при лікуванні Тіотриазоліном хворих із постінфарктним кардіо склерозом було встановлено покращення як систолічної, так і діастолічної функції лівого шлуночка [10, 11, 13, 15]. Як підсумок встановлено, що комплексна терапія хворих з постінфарктною стенокардією при використанні нітросорбіду, фенігідину й Тіотриазоліну позитивно впливає на внутрішньосерцеву гемодинаміку не лише завдяки зниженню переднавантаження (нітросорбід), постнавантаження (фенігідин), але й за рахунок підвищення інотропної функції серця, через кардіопротекторну дію Тіотриазоліну як засобу метаболічної корекції ішемізованого міокарда. Хронічна гіпоперфузія тканин міокарда пов’язана з атеросклеротичним ураженням коронарних судин, що обумовлює метаболічний енергодефіцит, і є тією мішенню, на яку спрямований дієвий ефект Тіотриазоліну як метаболічного засобу.
У роботах, присвячених застосуванню Тіотриазоліну у хворих з ІХС незалежно від функціонального класу стенокардії в поєднанні із гіпертонічною хворобою показано сприятливий вплив препарата на перебіг захворювання. Відзначено зменшення вираженості больового синдрому і відновлення серцевого ритму в цієї групи хворих. У хворих зі стенокардією зменшувалась кількість ангінозних нападів, збільшувалась толерантність до фізичних навантажень і зменшувалась гіперліпідемія [7, 9, 12].
Встановлено, що клінічний ефект Тіотриазоліну обумовлений протиішемічними, антиоксидантними, мем браностабілізуючими й імуномодулюючими властивостями. Тіотриазолін підсилює компенсаторну активацію анаеробного гліколізу, зменшує пригнічення процесів окислення в циклі Кребса із збереженням внутрішньоклітинного АТФ. Препарат активує антиоксидантну систему і гальмує процеси окислення ліпідів в ішемізованих ділянках міокарда, зменшує чутливість міокарда до катехоламінів, попереджує прогресування скоротливої спроможності серця, стабілізує та зменшує зони некрозу й ішемії міокарда. Антиоксидантний ефект реалізується через підвищення рівня каталази, зниження рівня малонового альдегіду та дієнових кон’югат, вільних радикалів, тим самим зменшуючи оксидативний стрес і процеси вільнорадикального окислення. У хворих з ІХС як додаткову терапію Тіотриазолін призначають при гострому ІМ, стенокардії напруження і спокою, постінфарктному кардіо склерозі, аритміях. Завдяки унікальній структурі молекули Тіотриазолін має властивості як прямого, так й непрямого кардіопротектору, тобто діє безпосередньо як метаболічний препарат, нормалізуючи енергетичні процеси в кардіоміоциті, й опосередковано — чинить антиагрегантний та метаболічний ефект, знижуючи тим самим навантаження на міокард [19].
Як уже відзначалось, позитивною стороною метаболічних препаратів є повна відсутність гемодинамічних ефектів і спрямованість на глибинні метаболічні механізми розвитку ішемії, виражена кардіоцитопротекція. Препарати метаболічної дії, впливаючи на синтез і утилізацію енергетичних процесів, тим самим збільшують стійкість тканин до гіпоксії і наслідків реперфузії, а також ефективні в лікуванні серцевої недостатності ішемічного ґенезу. Подібно до Тіотриазоліну, триметазидин, як один із поширених метаболічних препаратів в кардіологічній практиці, також інгібує окислення жирних кислот. Механізм дії його реалізується пригніченням метаболізму в міокарді ВЖК, який вимагає для утворення такої ж кількості АТФ на 17 % більше кисню, аніж окислення глюкози, і здійснюється за рахунок селективного інгібування 3кетоацилКоАтіолази — фермента, відповідального за bокислення жирних кислот. На відміну від Тіотриазоліну дія триметазидину проявляється лише при хронічних формах ІХС, у той час як при гострому ІМ вираженого ефекту він не справляє. Його ефект наступає не одразу, а із часом, необхідним для пристосування і стабілізації метаболізму. Триметазидин збільшує окислення пірувату й гліколітичної продукції АТФ, гальмує накопичення лактату й розвиток ацидозу, пригнічуючи вільнорадикальне окислення. Подібно до триметазидину, інший метаболічний препарат — ранолазин, який увійшов у стандарти і внесений ЄАК до рекомендацій лікування стабільної стенокардії, дериват піперазину, також є інгібітором окислення жирних кислот, хоча його біохімічна мішень поки ще не встановлена і на українському фармацевтичному ринку він дотепер ще не зареєстрований. Препарат зменшує частоту нападів стенокардії, підвищує толерантність до фізичного навантаження. Його антиішемічний ефект обумовлений обмеженим використанням в якості енергетичного субстрата ВЖК і підвищенням використання глюкози. Це призводить до утворення більшої кількості АТФ на кожен моль спожитого кисню. Проте ранолазин нездатний справляти антиангінальний ефект за умов монотерапії, через що застосовується у хворих ІХС поряд з бетаадреноблокаторами і блокаторами кальцієвих каналів.
Незважаючи на великий арсенал медикаментозних засобів у лікуванні стенокардії, широкомасштабними дослідженнями (TRIMPOLII, 2000; TRIKET, 2000) встановлено, що 66 % хворих із стенокардією оцінюють якість свого життя як «незадовільне» і «погане», і лише 17 % хворих не відчувають ангінозних болів. Тому й оцінка якості життя у хворих на стабільну ІХС також стала предметом нашого дослідження.
Мета і завдання дослідження
Основною метою даного дослідження була оцінка ефективності та переносимості препарату Тіотриазолін в таблетках виробництва фармацевтичної корпорації «Артеріум» в порівнянні з плацебо у пацієнтів з ІХС, стабільною стенокардією напруги ІІ–ІІІ ФК з подальшою оцінкою якості їх життя.
Матеріали та методи досліджень
Дизайн дослідження включав 292 хворих на ІХС, стабільну стенокардію напруги ІІ–ІІІ ФК, віком від 40 до 70 років (середній вік 63,1 ± 2,0 ро ку), причому чоловіків серед обстежених було майже вдвічі більше. Діагноз встановлювався на підставі даних анамнезу, клінічного та лабораторного обстеження, відповідних змін на ЕКГ, ЕхоКГ, тредмілтесту.
Відповідно до рекомендацій ЄТК з лікування стабільної стенокардії (2006) всім хворим, включеним у дослідження, призначали базову терапію: нітрати, bадреноблокатори, антиагреганти (аспірин), статини, антагоністи Са. Для купірування нападів стенокардії пацієнтам призначали нітрогліцерин сублінгвально. Через 30 днів лікування пацієнти проходили обстеження й були рандомізовані в основну та контрольну групи лікування. Пацієнти основної групи на фоні базової терапії отримували препарат Тіотриазолін, а пацієнти контрольної — препарат плацебо. Групи були гемодинамічно однорідними, зіставні за числом перенесених інфарктів міокарда, проведених інтервенційних втручань, здійснених коронарографій, рівнем толерантності до фізичного навантаження, присутністю асоційованих станів, зокрема гіпертонічної хвороби, цукрового діабету ІІ типу і серцевої недостатності ІІ– ІІІ ФК (рис. 1).
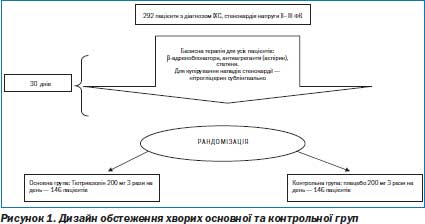
Тіотриазолін/плацебо призначали по 2 таблетки 3 рази на день впродовж 30 днів. Пацієнти проходили стаціонарне лікування в кардіологічному відділенні Дорожньої лікарні № 2 ст. Київ.
Усім пацієнтам проводилось загальноклінічне обстеження, визначались біохімічні показники: активність трансаміназ та МВ фракції КФК, рівень білірубіну, ліпідів, рівень загального холестерину, тригліцеридів, креатиніну, глюкози крові, калію, натрію. Враховувалися особливості клінічного перебігу основного захворювання, включаючи оцінку больового синдрому, частоту нападів стенокардії, нітрогліцериновий поріг, толерантність до фізичного навантаження, яка є інтегральним показником покращення якості життя. Оцінювались основні показники ЕКГ та добового моніторування ЕКГ (ДМ ЕКГ), а саме тривалість інтервалів PQ, QRS та QT, за відсутності протипоказань проводився тредмілтест.
Статистична обробка результатів проводилася з використанням пакету програм Excel (дані подані у вигляді М ± м). Вірогідність розходжень показників оцінювали за допомогою парного tкритерію Стьюдента.
Критерії ефективності терапії оцінювалися на підставі зменшення числа епізодів больової і безбольової ішемії міокарда за даними добового моніторування ЕКГ, збільшення толерантності до фізичного навантаження за даними тредмілтесту, нормалізації лабораторних показників.
Показники ефективності метаболічної терапії:
— збільшення тривалості виконуваного навантаження при проведенні тредмілтесту до появи депресії сегмента ST ≥ 1 мм до закінчення курсу лікування;
— зменшення частоти і вираженості ангінозних нападів;
— збільшення толерантності до фізичних навантажень;
— зменшення нітрогліцеринового порогу, що супроводжувалось зменшенням кількості епізодів ішемії та кількості спожитих таблеток нітрогліцерину за тиждень до закінчення курсу лікування;
— зменшення кількості епізодів ішемії та сумарної тривалості епізодів ішемії за добу за даними добового моніторування ЕКГ;
— збільшення виживання хворих.
Результати досліджень та їх обговорення
Аналіз отриманих результатів показав, що в групі застосування Тіотриазоліну спостерігалася позитивна динаміка щодо клінічного перебігу ІХС. Так, був відзначений швидший регрес больового синдрому, до 5го дня перебування у стаціонарі больовий синдром спостерігався тільки в дев’яти пацієнтів першої й у 43 пацієнтів другої групи. До 10го дня у жодного з пацієнтів, які отримували терапію Тіотриазоліном, больовий синдром не був відмічений.
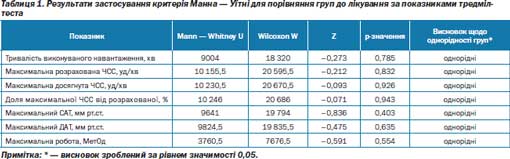
Першочергово вірогідних відмінностей між групами за частотою ангінозніх нападів (за тиждень і за добу), їх тривалістю, кількості таблеток нітрогліцерину для купірування одного нападу і кількістю спожитих таблеток нітрогліцерину на добу не було. У динаміці спостереження, аналізуючи клінічну симптоматику, вдалось виявити в групі хворих зі стабільною стенокардією напруги ІІ–ІІІ ФК, які отримували Тіотриазолін, зменшення середньої кількості типових нападів стенокардії за тиждень на 46,32 % з 4,94 ± 0,22 (візит 2) до 2,65 ± 0,11 (р < 0,01) (на заключному візиті), а також середньої кількості прийнятих таблеток нітрогліцерину на 57,94 % з 4,66 ± 0,31 (візит 2) до 1,96 ± 0,15 (р < 0,01) (на заключному візиті). У групі плацебо кількість ангінозних нападів зменшилась лише на 33,24 % з 5,01 ± 0,21 (візит 2) до 3,34 ± ± 0,12 (р < 0,01) (на заключному візиті), а середня кількість прийнятих таблеток нітрогліцерину зменшилась не так сильно, як у групі Тіотриазоліну: на 47,75 % з 4,48 ± 0,13 (візит 2) до 2,34 ± 0,11 (р < 0,01) (на заключному візиті). Під кінець спостереження основна і контрольна групи вірогідно відрізнялись між собою за частотою ангінозних нападів — відповідно, 2,65 ± 0,11 і 3,34 ± ± 0,12 (р < 0,05), за їх тривалістю — 6,43 ± 0,21 і 8,62 ± 0,24 хв (р < 0,001), кількістю таблеток нітрогліцерину, вжитих за добу — 1,96 ± ± 0,15 і 2,34 ± 0,11 (р < 0,05). Спостерігали також зменшення тривалості ангінозних нападів (р < 0,001), кількості таблеток нітрогліцерину для купірування одного нападу стенокардії (р < < 0,001) і кількості вжитих таблеток нітрогліцерину за добу (р < < 0,001) в групі хворих, які отримували Тіотриазолін (рис. 2–3).

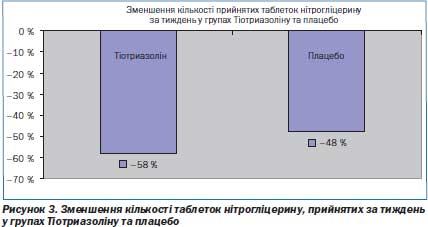
Додавання Тіотриазоліну до базисної терапії вірогідно зменшує кількість епізодів стенокардії та кількість прийнятого пацієнтами нітрогліцерину.
Отже, аналіз клінічного перебігу стабільної стенокардії напруги у хворих, які окрім базової терапії отримували Тіотриазолін, встановив його позитивний вплив на клінічну симптоматику із покращенням якості життя в обстежених пацієнтів.
Антиангінальний ефект лікування обумовлений, очевидно, застосуванням комплексу препаратів, проте вірогідна відмінність між групами через 30 днів терапії за частотою і тривалістю нападів стенокардії, кількістю прийнятих таблеток нітрогліцерину за добу свідчить про антиангінальну активність Тіотриазоліну і його позитивний вплив на перебіг стабільної стенокардії.
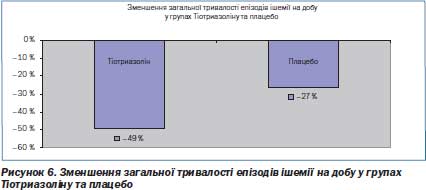
Ефективність препарату оцінювалась при аналізі результатів проведених добового моніторування ЕКГ та подвійного тредмілтесту перед лікуванням та після 30 діб лікування. Так, за даними 24годинного моніторування ЕКГ було вірогідно встановлено зменшення середньої тривалості епізодів ішемії на 22,79 % в основній групі і на 15,05 % в контрольній групі.
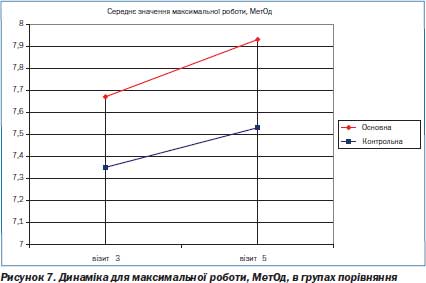
При проведенні тредмілтесту середня тривалість виконаного навантаження до появи депресії сегмента ST ≥ ≥ 1 мм чи ангінозного болю в основній групі (Тіотриазоліну) збільшувалась в середньому на 1,87 хв (на 27,48 % порівняно із вихідними даними), в той час як в контрольній групі (плацебо) — на 0,85 хв (на 17,48 % порівняно із вихідними даними) (рис. 4).
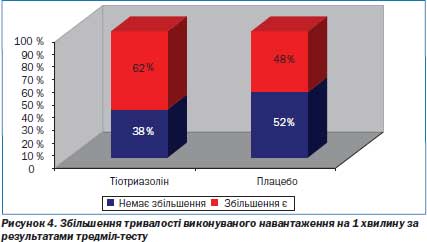
Таке вірогідне збільшення часу фізичного навантаження до появи стійкої депресії сегмента ST в групі застосування Тіотриазоліну порівняно з плацебо свідчить про істотний антиішемічний ефект (рис. 5–7).

Аналіз динаміки лабораторних даних не виявив негативного впливу препаратів в обох досліджуваних групах на показники загального аналізу крові та сечі. Вірогідно не змінювались рівні трансаміназ та показники ліпідного спектру крові, що свідчить про відсутність негативного впливу на стан печінки та нирок. Відсутність небажаної динаміки лабораторних показників свідчить про безпеку курсового лікування досліджуваним препаратом.
Порівняльна характеристика переносимості та побічних явищ при прийомі Тіотриазоліну та плацебо
Порівняльна оцінка переносимості препарату проведена на підставі аналізу даних об’єктивного обстеження та суб’єктивних відчуттів, що повідомлялися пацієнтами, результатів проведеного ЕКГ та добового моніторування ЕКГ. У жодного пацієнта на фоні прийому препарату не виникло алергічних реакцій, нудоти, бронхообструктивного синдрому та інших побічних явищ, які б потребували відміни препарату. За даними проведених тредмілтестів на початку лікування та на 30ту добу лікування Тіотриазоліном було виявлено вірогідне збільшення тривалості фізичного навантаження до появи ангінозного болю. До того ж вірогідно збільшився час фізичного навантаження в основній групі, що свідчить про поліпшення якості життя і притаманний антиішемічний ефект.
Під час клінічних досліджень доведена безпечність використання пероральної форми Тіотриазоліну; використання його доцільне у пацієнтів зі стабільною стенокардією напруги ІІ–ІІІ ФК на фоні сучасної базисної терапії, що включає використання нітратів, статинів, bадреноблокаторів, антагоністів кальцію, дезагрегантів, інгібіторів АПФ.
Отже, проведене дослідження підтвердило, що Тіотриазолін — оригінальний цитопротектор та антиоксидант з високим рівнем доказовості — препарат пройшов плацебоконтрольоване подвійне сліпе багатоцентрове рандомізоване дослідження з оцінки ефективності та переносимості в пацієнтів з ІХС, стабільною стенокардією напруги II–III ФК. По закінченню 30денного курсу лікування Тіотриазолін вірогідно знижував кількість та тривалість епізодів ішемії та стенокардії, що дозволяє знизити кількість прийнятого пацієнтами нітрогліцерину. Тіотриазолін дозволяє збільшити тривалість виконуваного навантаження пацієнтами — підвищує якість життя пацієнтів з ІХС.
Висновки
1. Вірогідне збільшення тривалості фізичного навантаження до появи ангінозного болю і часу фізичного навантаження до появи стійкої депресії сегмента ST підтверджує виявлену антиішемічну ефективність Тіотриазоліну.
2. Застосування Тіотриазоліну покращує клінічну симптоматику та якість життя хворих із ІХС, стабільною стенокардією напруги ІІ–ІІІ ФК. На фоні стандартної терапії застосування Тіотриазоліну призводить до вірогідного збільшення на 27,48 % (р = = 0,007) тривалості фізичного навантаження до появи депресії сегмента ST ≥ 1 мм чи ангінального болю за даними тредмілтесту порівняно до вихідних даних, в той час як у групі хворих, які отримували плацебо, ця відмінність була менш істотною і склала лише 17,48 %, зменшення середньої тривалості епізодів ішемії на 22,79 % за даними холтерівського моніторування.
3. Статистично більш вагоме зменшення тривалості та частоти нападів стенокардії на 46,3 %, кількості спожитих таблеток нітрогліцерину за тиждень на 57,9 % порівняно до вихідних даних упродовж 30денного застосування Тіотриазоліну і базової терапії довело його клінічну ефективність у хворих з ІХС, стабільною стенокардією напруги II–III ФК.
4. Зменшення кількості нападів стенокардії і нітрогліцеринового порогу на заключному візиті порівняно із вихідними даними було істотно вищим в групі хворих, які отримували Тіотриазолін, порівняно із групою плацебо (р = 0,028).
5. Тіотриазолін є ефективним, добре переносимим та безпечним препаратом в терапії хворих на ІХС, стабільну стенокардію напруги ІІ–ІІІ ФК.
1. Амосова Е.Н. Метаболическая терапия повреждений миокарда, обусловленного ишемией. Новый подход к лечению ишемической болезни сердца и сердечной недостаточности. // Укр. кардиол. журнал. — 2000. — № 4. — С. 8692.
2. Бобров В.О., Кулішов С.К. Адаптаційні ішемічні і реперфузійні синдроми у хворих з ішемічною хворобою серця: механізми, діагностика, обгрунтуваня терапії. — Полтава: Дитвосвіт, 2004. — 240 с.
3. Гагаріна А.А. Кардіопротектори метаболічного ряду Тіотриазолін, цитохром, мілдронат в комплексній терапії аритмій серця при некоронарогенних захворюваннях міокарда: Автореф. дис... канд. мед. наук. — Сімферополь, 2001. — 20 с.
4. Дейнега В.Г., Мамедов А.М., Шапран Н.Ф., Кондратенко Л.В., Дейнега И.В. Применение тиотриазолина и прерывистой нормобарической гипоксии при лечении больных ИБС с артериальной гипертензией // Актуальні питання фармацевтичної та медичної науки i практики. — Запоріжжя, 2002. — Вип. 8. — С. 6470.
5. Діагностика та лікування хронічної серцевої недостатності. Головні положення рекомендацій Європейського кардіологічного тоавриства — 2006 // Серце і судини. — 2006. — № 2. — С. 2433.
6. Кошля О.В. Особливості системної гемодинаміки та перекисного окислення ліпідів у хворих з серцевою недостатністю в процесі їх лікування дилтіаземом, нітретом та Тіотриазоліном: Автореф. дис... канд. мед. н. — Запоріжжя, 2000. — 21 с.
7. Мазур И.А., Волошин Н.А., Чекман И.С., Зименковский Б.С., Стец В.Р. Tиотриазолин: фармакологические аспекты и клиническое применение. — Запорожье, 2005. — 160с.
8. Малая Л.Т., Корж А.Н., Балковая Л.Б. Эндотелиальная дисфункция при патологии сердечнососудистой системы. — Харьков: Торсинг, 2000. — 432 с.
9. Пархоменко А.Н. Жизнеспособный миокард и кардиоцитопротекция: возможности метаболической терапии при острой и хронической формах ишемической болезни сердца // Укр. мед. часопис. — 2001. — № 3(23). — С. 511.
10. Поливода С.Н., Черепок А.А., Сычев Р.А. коррекция эндотелиальной дисфункции у больных гипертонической болезнью: эффективность и патофизиологическое обоснование применения тиотриазолина // Медицина Світу. — 2004. — С. 1820.
11. Сиволап В.Д. Оптимізація терапії післяінфарктної стенокардії Тіотриазоліном // Журнал практичного лікаря: Спец. інформ. вид. — К., 2003. — № 5. — С. 5759.
12. Стан здоров’я народу України у зв’язку із хворобами системи кровообігу та можливі шляхи його покращання. Аналітичностатистичний посібник для лікарів — кардіологів, ревматологів, терапевтів загальної практики / Під ред. В.М. Коваленка. — Київ, 2004. — 124 с.
13. Шилов А.М. Некоторые особенности патогенеза ишемической болезни сердца // РМЖ. — 2007. — Т. 15, № 9.
14. Чекман И.С. Горчакова Н.А., Загородний М.І. та ін. Кардіопротектори метаболічної дії: доцільність експериментального і клінічного вивчення // Запорожский мед. журн. — 2003. — № 2. — С. 251252.
15. Яковлева О.А., Савченко Н.П., Стопинчук А.В., Семененко И.Ф. влияние тиотриазолина на состояние эндотелиальной дисфункции и липидноперекисный дисбаланс при моно и комбинированной терапии с метопрололом у больных ИБС // Актуальні питання фармацевтичної та медичної науки і практики. — Запоріжжя, 2002. — Вип. 8. — С. 245249.
16. Di Napoli P., Taccardi A.A., Barsotti A. Long term cardioprotective action of trimetazidine and potential effect on the inflammatory process in patients with ischaemic dilated cardiomyopathy // Heart. — 2005. — 91. — 161–5.
17. Kantor P.F., Lucien A., Kozak R. et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial longchain 3ketoacyl coenzyme A thiolase // Circ. Res. — 2000. — Vol. 86. — P. 580586.
18. Lee L, Horowitz J, Frenneaux M. Metabolic manipulation in ischaemic heart disease, a novel approach to treatment // Eur. Heart. J. — 2004. — 25. — 63441.
19. Визир В.А., Волошина И.Н., Волошин Н.А., Мазур И.А., Беленичев И.Ф. Метаболические кардиопротекторы: фармакологические свойства и применение в клинической практике. Методические рекомендации. — ЗГМУ, 2006. — С. 13.
