Газета «Новости медицины и фармации» 11-12(331-332) 2010
Вернуться к номеру
Неалкогольный стеатогепатит: современные походы к диагностике и лечению
Авторы: И.Н. Скрыпник, д.м.н., профессор, проректор по последипломному образованию, зав. кафедрой внутренних болезней и медицины неотложных состояний. Высшее государственное учебное заведение Украины. «Украинская медицинская стоматологическая академия», Полтава, член Европейской ассоциации по изучению печени (EASL), участник реестра «ТОП100 в медицине» 2009 года
Версия для печати
 Одной из наиболее актуальных в медико-социальном аспекте проблем современной гепатологии является неалкогольный стеатогепатит (НАСГ).
Одной из наиболее актуальных в медико-социальном аспекте проблем современной гепатологии является неалкогольный стеатогепатит (НАСГ).
НАСГ — заболевание печени неалкогольной этиологии с признаками жировой дистрофии и лобулярным гепатитом.
Эпидемиология
В европейских странах НАСГ диагностируют почти у 11 % пациентов путем проведения биопсии печени в связи с повышением активности трансаминаз. У людей с повышенной массой тела распространенность НАСГ составляет 19 %, при нормальной массе тела — 2,7 % [11, 24].
Чаще болеют женщины в возрасте 50 лет, соотношение мужчин и женщин 1 : 3, хотя заболевание встречается во всех возрастных группах [8].
Этиология
Факторы, значительно влияющие на развитие НАСГ:
Первичный НАСГ ассоциирован с эндогенными нарушениями липидного и углеводного обмена (ожирение, сахарный диабет ІІ типа, гиперлипидемия).
Вторичный НАСГ индуцируется внешними факторами и развивается в результате метаболических расстройств, приема препаратов, синдрома мальабсорбции, длительного парентерального питания, синдрома избыточного бактериального роста в кишечнике.
Патогенез
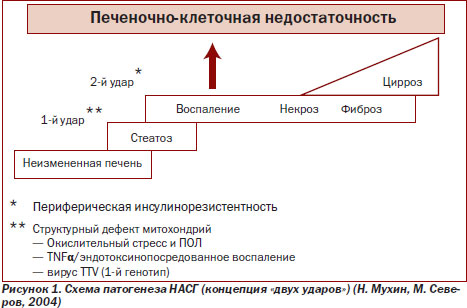
Существующая модель патогенеза НАСГ — теория «двух ударов».
Теория «первичного удара» — при нарастании ожирения увеличивается поступление в печень свободных жирных кислот (СЖК) и развивается стеатоз печени.
Теория «вторичного удара» — реакция окисления СЖК и образования продуктов перекисного окисления липидов (ПОЛ) и реактивных форм кислорода — оксидативный стресс, что приводит к развитию стеатогепатита и имеет наибольшее клиническое и прогностическое значение [14].
Стеатоз — жировая дистрофия печени. При чрезмерном бактериальном росте в кишечнике нарушаются процессы ферментативного гидролиза белков и синтеза витаминов, обусловливая дефицит белков, ферментов и коферментов, которые принимают участие в синтезе липопротеидов очень низкой плотности, и, как следствие, жир не выводится из гепатоцита, а накапливается в печени [11].
Стеатогепатит — некроз гепатоцитов. При нарушении кишечного барьера в портальную систему печени постоянно поступают бактерии и их токсины, которые приводят к развитию воспаления и некрозу гепатоцитов. Некроз гепатоцитов активирует клетки Ито, продуцирующие компоненты соединительной ткани в просвете синусоида, что приводит к формированию внутридолькового фиброза. Трансформация фиброза в цирроз возникает при капилляризации синусоидов. Основной критерий диагностики стеатогепатита — увеличение активности аминотрансаминаз [14].
Механизм трансформации стеатоза в стеатогепатит включает несколько патогенетических звеньев [7], являющихся идентичными как при неалкогольном, так и при алкогольном поражении печени (рис. 1).
Стеатогепатит — «мост» между алкогольной жировой дистрофией и алкогольным циррозом печени, который составляет до 50 % всех больных циррозом печени (ЦП). Открыт возможный маркер хронической интоксикации алкоголем у больных гепатопатиями — углеводно-дефицитный трансферрин. Прием 60 г этанола ежедневно в течение недели вызывает у 85–90 % лиц повышение концентрации изотрансферрина сыворотки крови.
Различные токсины, включая кишечный эндотоксин, в реакциях окисления индуцируют чрезмерную продукцию и накопление в печеночной клетке свободных радикалов и других токсических метаболитов. Свободные радикалы запускают реакции ПОЛ и секрецию цитокинов, включая туморнекротизирующий фактор-α (TNF-α), интерлейкины-1, -2, -6, которые приводят к некрозу гепатоцитов и развитию воспалительной клеточной инфильтрации с последующим фиброзом, а при длительном прогрессировании процесса — обусловливают трансформацию в цирроз печени. НАСГ может прогрессировать в ЦП, приводить к печеночно-клеточной недостаточности и гепатоцеллюлярной карциноме [5, 20].
У пациентов с избыточной массой тела, гиперлипидемией, инсулиннезависимым сахарным диабетом развивается инсулинорезистентность, являющаяся ключевым патогенетическим звеном в развитии НАСГ. Инсулин активирует синтез СЖК и триглицеридов, снижает скорость β-окисления свободных жирных кислот в печени, что приводит к отложению в ней триглицеридов. Важная мишень для TNF-α — инсулиновые рецепторы (IRS-1). TNF-α угнетает синтез липопротеинкиназы, приводя к мобилизации запасов жира и потере массы тела, что способствует накоплению жира в печени [6].
С 90-х годов ХХ века выделяют алкогольные и неалкогольные стеатогепатиты.
Основные клинико-морфологические формы НАСГ (Ju. Ludwig, 2000):
1. Макровезикулярная жировая печень без фиброза, с минимальными воспалительными изменениями. Течение непрогрессирующее.
2. Макровезикулярная жировая печень с умеренными центролобулярными смешанными воспалительными инфильтратами. В 3-й зоне — умеренный фиброз. Прогрессирование болезни медленное, в отдельных случаях — стеатогепатогенный цирроз.
3. Подострый (субфульминантный тип) НАСГ. Жировая печень (макро-микровезикулярная) с субмассивными (по типу центрозональных, мостовидных) некрозами со смешанными воспалительными инфильтратами. Возможно развитие печеночной недостаточности и смерти в течение нескольких месяцев.
Классификация по МКБ Х пересмотра: К 76.0. Жировая дегенерация печени.
Диагностика
Наиболее характерные клинические, лабораторные и инструментальные критерии НАСГ представлены в табл. 1 [13].
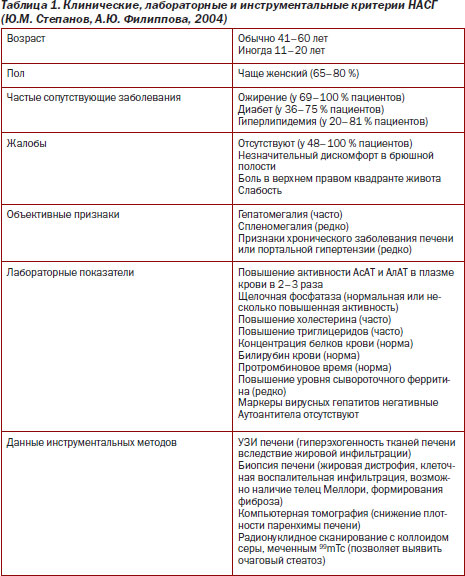
Следует учитывать, что у 48–100 % пациентов с НАСГ могут отсутствовать симптомы, характерные для заболевания.
Гистологическая картина НАСГ характеризуется крупнокапельной жировой дистрофией гепатоцитов в 3-й зоне ацинуса (крупные одиночные липидные капли в цитоплазме со смещением ядра к периферии клетки). Воспалительная реакция представлена внутридольковыми инфильтратами, состоящими из полиморфно-ядерных лейкоцитов (ПЯЛ), лимфоцитов и мононуклеарных фагоцитов [21].
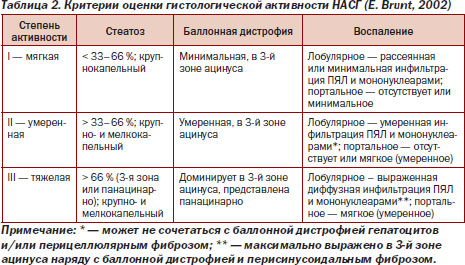
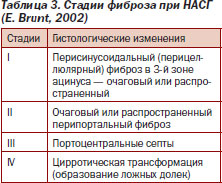
Для оценки степени активности НАСГ и стадии фиброза печени применяют классификацию E. Brunt (табл. 2, 3) [22].
Дифференциальная диагностика
Программа обследования пациента должна быть направлена на исключение других заболеваний печени:
Прогноз зависит от степени прогрессирования заболевания.
Лечение
Строгие схемы ведения больных НАСГ не разработаны. При выборе метода лечения учитывают основные этиологические и патогенетические факторы и фоновые заболевания.
Основные принципы терапии — похудение, отмена потенциально гепатотоксических препаратов, коррекция гиперлипидемии и гипергликемии.
В случае развития НАСГ на фоне ожирения и сахарного диабета наиболее эффективно постепенное снижение массы тела, достигаемое соблюдением диеты и применением адекватных физических нагрузок. Физические упражнения (не менее 1 ч в день) в сочетании с диетой достоверно более значимо улучшают биохимические и гистологические параметры, чем только снижение калорийности рациона.
Низкокалорийная диета (600–1200 ккал) предусматривает снижение массы тела на 5–10 % за 6 месяцев. Уменьшение массы тела (на 0,5–1 кг в неделю) и нормализация углеводного обмена сопровождаются положительной динамикой клинико-лабораторных показателей и снижением индекса гистологической активности. Резкое похудение может привести к ухудшению течения заболевания. При резко выраженном ожирении возможно выполнение гастропластики (наложение илеоеюнального анастомоза, несмотря на уменьшение массы тела, приводит к прогрессированию стеатоза и воспалительно-фибротических изменений в печени) [10].
Целесообразна отмена или замена лекарственных препаратов — потенциальных этиологических и патогенетических факторов развития НАСГ.
Медикаментозная фармакотерапия
Бигуаниды
Лечебный эффект бигуанидов при сахарном диабете II типа обусловлен угнетением глюконеогенеза и синтеза липидов в печени, реализуемого посредством активации цАМФ-зависимой протеинкиназы печени. Это сопровождается снижением синтеза триглицеридов из жирных кислот и подавлением митохондриального β-окисления, снижением экспрессии TNF-α и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А. Метформин оказывает также центральное аноректическое действие [11, 23].
Уменьшение инсулинорезистентности на фоне применения метформина обусловливает его эффект при НАСГ. Метформин в дозе 1500 мг/сут или 20 мг/кг/сут в течение 12 мес. на фоне снижения массы тела (около 1,5 кг/мес) нормализует активность трансаминаз, снижает гиперхолестеринемию и гипертриглицеридемию, приводит к уменьшению размеров печени, снижению гистологической активности НАСГ.
Инсулиновые синсетайзеры
Тиазолидиндионы — новый класс препаратов, селективно повышающих чувствительность инсулиновых рецепторов. Посредством связывания с ядерным пероксисомальным пролифератором-γ (PPAR-γ) они индуцируют пероксисомальные ферменты, окисляющие СЖК, подавляют синтез жирных кислот в печени, повышают активность клеточного транспортера глюкозы GLUT-4. Вследствие этого улучшается усвоение глюкозы периферическими тканями, снижается концентрация глюкозы, инсулина, триглицеридов и СЖК в крови [9, 10].
Применение глитазонов 2-го поколения (пиоглитазон, розиглитазон — роглид) у больных НАСГ в течение 3–12 мес. приводит к достоверному улучшению биохимических показателей крови, уменьшению стеатоза и выраженности некровоспалительных изменений печени.
Гепатопротекторы
Среди большого числа гепатопротекторов предпочтение необходимо отдавать оригинальным лекарственным средствам, имеющим высокую доказательную базу в аспекте ожидаемого получения высокой эффективности и профиля безопасности.
S-аденозилметионин (гептрал) — естественный метаболит, 8 г эндогенного S-аденозилметионина в организме человека образуется ежесуточно. Адеметионин играет центральную роль в межуточном обмене, участвуя в трех метаболических реакциях: трансметилировании (синтез фосфатидилхолина, повышающего текучесть и пластичность мембран), транссульфурировании (синтез глутатиона) и аминопропилировании (синтез полиаминов). Препарат обладает антиоксидантным и антиноцицептивным эффектом [11, 19].
Назначают гептрал сначала парентерально по 400–800 мг внутривенно в первые 5–7 дней, затем перорально по 1 таблетке (400 мг) 2 раза в день в утренние и дневные часы, учитывая антидепрессивный эффект препарата. Курс лечения — 21–28 дней.
Эссенциальные фосфолипиды. Патогенетически оправдано назначение больным НАСГ эссенциальных фосфолипидов (эссенциале Н, эссенциале форте Н), основное действующее вещество которых — 1,2-дилинолеил-фосфатидилхолин (ДЛФХ), участвующий в регуляции липидного обмена в гепатоцитах, обладающий антифибротической и антиоксидантной активностью. Препарат повышает текучесть биомембран и ферментативную активность фосфолипидзависимых ферментов, что приводит к нормализации проницаемости мембран и улучшению в них обменных процессов [4].
Особый интерес представляют вновь открытые свойства ДЛФХ: подавление трансформации жирдепонирующих клеток печени (клеток Ито) в фибробласты, повышение активности коллагеназы, значительное уменьшение образования in vivo F2-изопростанов (маркеры ПОЛ).
Эссенциале форте Н назначают по 2 капсулы 3 раза в сутки; оптимальная продолжительность курса лечения — 6–12 мес. Целесообразно начать с комбинированного приема — эссенциале Н внутривенно струйно в дозе 500 мг (10 мл) и одновременно 2 капсулы (600 мг) 3 раза в сутки в первые 10–14 дней лечения с последующим приемом препарата перорально в дозе не менее 1,8 г/сутки в течение 3–6 мес. Эссенциале Н и эссенциале форте Н могут применяться также при стеатогепатите алкогольной и смешанной этиологии.
Препараты урсодезоксихолевой кислоты (УДХК) — урсофальк, урсосан — оказывают прямой цитопротекторный, антиапоптический и мембраностабилизирующий эффекты. Получены новые данные о положительном влиянии УДХК на соотношение сывороточных маркеров фиброгенеза и фибролиза (матриксные металлопротеиназы и их тканевые ингибиторы). Прием препарата в дозе 10–15 мг/кг/сутки в течение 12 мес. позволяет значительно улучшить печеночные тесты, уменьшить выраженность без существенного снижения массы тела [15].
Цитраргинин — комбинация двух натуральных аминокислот — аргинина (1 г) и бетаина (1 г) в виде раствора для перорального приема в ампулах по 10 мл.
Назначается по 1 ампуле, которую растворяют в 0,5 стакана воды, 3 раза в день. Раствор выпивается за 30 минут до приема еды в течение 1–2 месяцев.
Применение при НАСГ в течение 12 мес. бетаина (20 г/сут), повышающего содержание S-аденозилметионина в гепатоцитах, приводит к улучшению у больных биохимических показателей, но не влияет на гистологические характеристики воспаления и фиброза [11].
α-липоевая кислота (берлитион) — кофермент энзимного комплекса митохондрий, который принимает активное участие в окислительном декарбоксилировании пировиноградной, α-кетоглутаровой и других кетокислот. α-липоевая кислота снижает глюконеогенез и кетогенез, ингибирует гликозилирование белков, активирует процессы окисления глюкозы, уменьшает инсулинорезистентность, оказывая положительное корригирующее влияние на углеводный обмен [12, 17].
Назначают по 12 мл (300 ЕД) внутривенно капельно в 200 мл 0,9% раствора натрия хлорида в течение 30 мин, защищая приготовленный раствор алюминиевой фольгой от света. Курс лечения — 5–10 инъекций, с последующим переходом на пероральный прием по 1 таблетке (300 мг) 2 раза в сутки — до 1,5–2 мес.
Глутаргин — комбинация аминокислот (аргинина и глутаминовой кислоты), которая стабилизирует клеточные мембраны гепатоцитов, подавляет ПОЛ, увеличивает энергообеспечение гепатоцитов, нормализирует белковый, углеводный и липидный обмен. Лечение глутаргином целесообразно начинать с парентерального введения препарата внутривенно капельно в дозе 5 мл 40% раствора на 100–200 мл изотонического раствора натрия хлорида или 5% раствора глюкозы 1 раз в сутки в течение первых 5–10 дней. Далее переходят на пероральный прием препарата в дозе 500 мг (2 табл.) 3 раза в день через 1 час после еды. Общий курс лечения составляет 2–3 месяца [19].
Антраль обладает выраженной антиоксидантной активностью, обеспечивающей гепатопротекторный эффект. Механизм антиоксидантного действия обусловлен как свойствами металла, входящего в его состав, так и фармакологической активностью N-фенилантраниловой кислоты, являющейся основой ряда нестероидных противовоспалительных средств. Антраль также оказывает капилляропротекторное, антиэкссудативное, анальгезирующее действие. В патогенетическом отношении препарат обеспечивает снижение уровня молекул средней массы, приводя к уменьшению выраженности эндогенной метаболической интоксикации [18].
 Его назначение также целесообразно в комплексном лечении больных токсическими, алкогольными и радиационными гепатитами [2, 16]. Антраль — препарат выбора при лечении ликвидаторов последствий аварии на ЧАЭС [2]. Назначается по 0,2 г 3 раза в сутки через 40–50 минут после еды в течение 1–1,5 месяца.
Его назначение также целесообразно в комплексном лечении больных токсическими, алкогольными и радиационными гепатитами [2, 16]. Антраль — препарат выбора при лечении ликвидаторов последствий аварии на ЧАЭС [2]. Назначается по 0,2 г 3 раза в сутки через 40–50 минут после еды в течение 1–1,5 месяца.
Статины — наиболее эффективные препараты, снижающие уровень холестерина. В большинстве случаев они не оказывают положительного действия на биохимические и гистологические признаки НАСГ, однако могут и должны применяться в составе комплексной терапии с целью предотвращения осложнений метаболического синдрома [11].
Ловастатин принимают по 10–20 мг, симвастатин — по 10–40 мг, розувастатин — по 10–20 мг 1 раз в сутки вечером во время еды (под контролем активности трансаминаз — не реже 1 раза в месяц в первые три месяца приема).
Из всех статинов самый высокий профиль безопасности имеет розувастатин.
Фибраты являются эффективными средствами для коррекции нарушений при гипертриглицеридемии. Препаратом выбора в аспекте высокой эффективности и профиля безопасности среди фибратов является фенофибрат (трайкор), который назначается в дозе 145 мг однократно 1 раз в сутки. Длительность назначения препаратов определяется врачом индивидуально.
Лактулоза (дуфалак) — пребиотик, который назначается для коррекции эндотоксемии, уменьшая всасывание ксенобиотиков из кишечника и продукцию TNF-α макрофагами печени [3]. Назначают по 20–30 мл/сутки в течение 1–2 месяцев.
Патогенетически оправдано назначение рифаксимина — невсасывающегося антибиотика, эффективно устраняющего синдром избыточного бактериального роста и обладающего высоким профилем безопасности. Однако в Украине этот препарат до сих пор не зарегистрирован.
Метронидазол показан короткими курсами (750 мг/сут в течение 7–10 дней) при вторичном НАСГ в случае доказанного синдрома избыточного бактериального роста.
Анорексигенные средства назначают с целью ускорения динамики снижения массы тела при недостаточной эффективности сочетания диеты с физической активностью.
Трансплантация печени проводится в случае прогрессирования печеночной недостаточности. Возможны рецидивы стеатогепатита в аллотрансплатате. Отдаленные результаты требуют уточнения.

1. Бабак О.Я. Эффективность использования препарата цитраргинин в терапии хронических гепатитов // Сучасна гастроентерологія. — 2001. — № 1. — С. 64-65.
2. Дегтярева И.И. Клиническая гастроэнтерология. — М.: Междун. информ. агентство, 2004. — 616 с.
3. Дегтярева И.И., Скопиченко С.В. Дуфалак: классическое применение и перспективы. – К.: ЗАО «Атлант ЮЭмСи», 2003. — 236 с.
4. Дегтярева И.И., Скрыпник И.Н., Невойт А.В. Детоксическая и белково-синтетическая функции печени: сравнительный анализ влияния гепатопротекторов различного механизма действия // Экспериментальная и клиническая гастроэнтерология. — 2004. — № 1. — С. 75-76.
5. МакНелли П.Р. Секреты гастроэнтерологии: Пер. с англ. — М. — СПб.: ЗАО «Издательство БИНОМ»: Невский диалект, 1998. — 1023 с.
6. Маммаев С.Н., Багомедова Н.В., Богомолов П.О. и соавт. Цитокиновая система при неалкогольном стеатогепатите // Рос. журн. гастроэнтерол., гепатологии и колопроктологии. — 2007. — Т. 17, № 4. — С. 35-39.
7. Мухин Н., Северов М., Лопаткина Т.Н. Неалкогольный стеатогепатит с исходом в цирроз печени // Врач. — 2004. — № 12. — С. 13-16.
8. Павлов Ч., Бакулин И. Неалкогольный стеатогепатит: клинические особенности и принципы лечения // Врач. — 2007. — № 10. — С. 24-28.
9. Подымова С.Д. Болезни печени: Руководство для врачей. — 4-е изд. — М.: Медицина, 2005. — 768 с.
10. Скрипник І.М. Гепатопротекторні засоби в сучасній гепатології // Consilium Medicum Ukraina. — 2007. — Т. 1, № 5. — С. 11-15.
11. Скрипник І.М., Мельник Т.В., Потяженко М.М. Клінічна гепатологія. — Полтава: Дивосвіт, 2007. — 425 с.
12. Скрипник І.М., Мельник Т.В., Гопко О.Ф. Неалкогольний стеатогепатит: роль і місце берлітіону в лікуванні і профілактиці // Ліки України. — 2005. — № 6. — С. 76-77.
13. Степанов Ю.М., Филиппова А.Ю. Неалкогольный стеатогепатит: современные аспекты диагностики, клиники, лечения // Гастроентерологія: Міжвід. зб. — Дніпропетровськ, 2004. – Вип. 35. — С. 409-424.
14. Хазанов А.И. Возможности прогрессирования алкогольного и неалкогольного стеатогепатита в цирроз печени // Рос. журн. гастроэнтерол., гепатол. и колопроктологии. — 2005. — Т. 15, № 2. — С. 26-32.
15. Харченко Н.В. Сучасні гепатопротектори в лікуванні хворих із хронічними ураженнями печінки // Ліки України. — 2004. — № 3. — С. 14-18.
16. Харченко Н.В., Шаповалов К.А. Вплив антралю на показники ліпопероксидації у хворих із хронічним алкогольним гепатитом // Укр. мед. альманах. — 2006. — Т. 9, № 1. — С. 43-45.
17. Хворостинка В.М., Бобронникова Л.Р. Корекція метаболічних порушень при жировій дистрофії печінки з використанням препарату α-ліпоєвої кислоти // Ліки України. — 2004. — № 7–8. — С. 50-53.
18. Фролов В.М., Григорьева А.С. Антраль — эффективный препарат для лечения заболеваний печени // Укр. мед. часопис. — 2003. — № 2. — С. 65-68.
19. Швец Н.И., Скрыпник И.Н., Бенца Т.М. Фармакотерапия заболеваний пищеварительной системы в практике терапевта. — К., 2007. — 645 с.
20. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. рук.: Пер. с англ. / Под ред. З.Г. Апросиной, Н.А. Мухина. — М: Гэотар Медицина, 2002. — 864 с.
21. Яковенко Э.П., Агафонова Н.А., Яковенко А.В. и соавт. Эффективность препарата галстена в лечении дисфункции сфинктера Одди и неалкогольной жировой болезни печени // Рос. журн. гастроэнтерол., гепатол. и колопроктологии. — 2007. — Т. 17, № 6. — С. 58-65.
22. Brunt E. Histological grading and stading for nonalcoholic steatohepatitis // Falk Symposium. Steatohepatitis: Abstract. — 2000. — P. 14-15.
23. Kuntz L., Kuntz H.-D. Hepatology. Principles and practice. — Berlin: Springer-Verlad, 2002. — P. 56-59.
24. Pinto Н.С., Baptista A., Camilo M.E. Nonalcoholic steatohepatitis: clinico-pathological comparison with alcoholic hepatitis in ambulatory and hospitalized patients // Dig. Dis. Sci. — 1996. — Vol. 41. — Р. 172-179.
