Газета «Новости медицины и фармации» Неврология (328) 2010 (тематический номер)
Вернуться к номеру
Нейрокардиальные изменения у больных в острый период различных типов мозгового инсульта
Авторы: О.Е. Дубенко, И.А. Ракова. Харьковская медицинская академия последипломного образования
Версия для печати
Кардиальная дисфункция является частым и серьезным осложнением острого инсульта, но потенциально может поддаваться коррекции [2, 17]. Изменения на электрокардиограмме (ЭКГ) у больных с острым инсультом впервые были описаны более 60 лет назад [5, 8]. В настоящее время интерес к этой проблеме не уменьшается. A. Rossetti и соавт. [21] изменения ЭКГ выявили у 65,9 % больных с острым ишемическим инсультом (ИИ), при этом депрессия сегмента S-T, желудочковые и предсердные аритмии были связаны с ухудшением прогноза и ранней смертностью. Увеличение постинсультной кардиальной смерти было связано также с удлинением интервала Q-T, которое коррелировало с индексом массы левого желудочка, артериальным давлением и снижением вариабельности сердечного ритма [23]. У больных с внутримозговым кровоизлиянием изменения ЭКГ в виде удлинения интервала Q-T выявлены у 56 % больных, депрессия сегмента S-T — у 36 %, инверсия зубца Т — у 24 %, увеличение зубца Р — у 20 %. При этом внезапная смерть и патологические желудочковые ритмы были связаны с удлинением Q-T [11]. Эти изменения, вероятно, имели неврогенную природу, и в ряде исследований изучалась связь частоты изменений ЭКГ с пораженнием определенных мозговых структур при инсульте [14]. Так, депрессия сегмента S-T чаще выявлялась у больных с ИИ и транзиторными ишемическими атаками в правой гемисфере [19]. M. Brainin и соавт. [4] изменения ЭКГ выявили у 69 % больных из 121 с острым ИИ, у 39 из которых было поражение оперкулярной зоны. Изменения ЭКГ у них наблюдались достоверно чаще и отмечалась независимая связь с удлинением интервала Q-T. В ряде работ показана связь изменений ЭКГ с поражением островка [6, 7, 18]. Было выявлено повышение кардиальных энзимов, в частности МВ-креатинкиназы при инсульте [16]. В последние годы для диагностики миокардиального повреждения стали использовать более чувствительные маркеры — тропонины. В ряде работ [3, 9] было выявлено повышение тропонина I и тропонина Т при остром ИИ, что ассоциировалось с ухудшением прогноза у этих больных. Достаточно известным феноменом является также кардиальная дисфункция и повреждение миокарда после субарахноидального кровоизлияния (САК) [12, 24]. Описаны изменения ЭКГ и повышение кардиальных энзимов у больных с САК без патологии коронарных артерий [10]. В другом исследовании также было выявлено повышение тропонина I у больных с САК, что коррелировало с ухудшением неврологического исхода [20]. Патофизиология кардиального повреждения после САК остается недостаточно изученной. Возможным механизмом является гипертензия и значительное повышение циркулирующих катехоламинов. Повреждение миокарда при этом является неврально обусловленным процессом [13, 15, 22].
Таким образом, кардиальная дисфункция является важным аспектом в проблеме ведения больных с острым инсультом, который может оказывать влияние на течение, прогноз и терапевтические подходы и требует дальнейшего изучения. В связи с этим мы провели собственное исследование, цель которого — уточнить особенности изменений сердечной деятельности при разных типах инсульта, сопоставить изменения ЭКГ с автономной сердечной регуляцией и уровнем кардиальных энзимов.
Материал и методы исследования
В обследование включены 110 пациентов с острым инсультом (59 мужчин и 51 женщина, средний возраст 63,2 ± 9,6 года), которые поступили в отделение острой сосудистой патологии. Из них у 47 больных был ИИ с локализацией инфаркта: в правом полушарии — у 17, в левом — у 16, инфаркт в вертебробазилярном бассейне (в области варолиева моста и мозжечка) — у 14. У 16 (34,0 %) больных очаги охватывали кору и прилежащее белое вещество одной или нескольких долей мозга, у 14 (29,8 %) очаги носили лакунарный характер размерами не более
Тяжесть состояния больных ИИ, определяемая по шкале NIHSS [1], составляла от 8 до 19 баллов. Тяжесть инсульта по шкале NIHSS была статистически значимо выше у больных с корковыми очагами (11,5 ± 2,5 балла) в сравнении с подкорковыми (7,3 ± 2,1 балла, р < 0,05). Умерли 2 больных с обширными инфарктами, охватывающими лобно-теменно-височную область. Тяжесть состояния больных ГИ определялась по шкале комы Глазго и составляла от 5 до 14 баллов, в динамике — по шкале исходов Глазго, тяжесть состояния больных САК по шкале Ханта и Гесса — 2–4 балла [1]. Всем больным производилась 10-минутная запись ЭКГ с анализом вариабельности сердечного ритма (ВСР) при помощи компьютерного кардиографа Cardiolab+ и спектральным анализом с помощью быстрого преобразования Фурье. Определяли общую мощность спектра (ТР), мощность спектра в низкочастотном диапазоне (LF), высокочастотном (HF) и соотношение LF/HF. Определение уровня тропонина I (Тн1) в сыворотке крови производилось иммуноферментным методом с помощью набора реактивов «Хема-Медика» (Россия). Параметры нормы, установленные для используемого набора реагентов, составили 0–0,30 нг/мл. Обследование проводилось трижды в динамике на 1-е — 3-и и 5–7-е и 10–14-е сутки инсульта. Для исключения кардиогенных и метаболических влияний не включались больные с наличием в анамнезе заболеваний сердца (инфаркта миокарда, аритмий, пороков, застойной сердечной недостаточности), легких, почек, сахарного диабета, алкоголизма. Статистическая обработка полученных результатов проводилась на основе пакета программ Statistica 6.0. Результаты представлены в виде среднего значения (М) ± ошибка средней (m). Для сравнения полученных результатов использовали параметрический критерий Стьюдента и непараметрический критерий Вилкоксона. Для определения направления и силы связи между величинами использовали методы линейного и нелинейного корреляционного анализа. Различия считали достоверными при р < 0,05.
Результаты и их обсуждение
Анализ изменений ЭКГ у больных ИИ показал, что при первом обследовании при поступлении (на 1-е — 3-и сутки) изменения деятельности сердца отсутствовали только у 4 (8,5 %) больных. Изменения деятельности сердца заключались в развитии тахикардии у 17,0 % больных, реже наблюдались брадикардия (у 6,3 %) и наджелудочковая экстрасистолия (у 8,5 %). Нарушения функции проводимости регистрировались в виде замедления атриовентрикулярной (A-V) проводимости (у 6,3 %) и удлинения интервала Q-T (у 12,8 % больных). Наиболее часто регистрировались изменения сегмента S-T и зубца Т, называемые «нарушениями процессов реполяризации». Изменения сегмента S-T чаще регистрировались в виде депрессии — у 9 (19,1 %) больных. Наиболее частым феноменом был отрицательный зубец Т — у 19 (40,4 %) больных. При оценке в динамике отмечено, что такие изменения, как тахикардия, экстрасистолия, удлинение интервала Q-T, имели тенденцию к регрессированию. Частота изменений со стороны сегмента S-T и зубца Т не снижалась, а частота депрессии сегмента S-T увеличилась до 26 %. Подъем сегмента S-T был незначительным (до
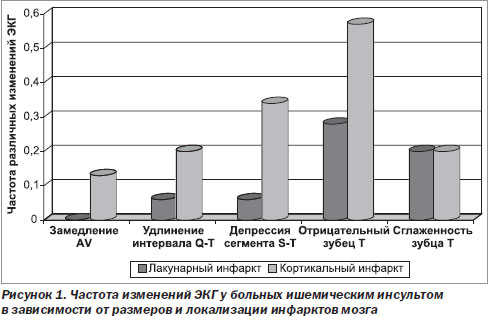
Так, у больных с лакунарными инфарктами не было выявлено замедления AV-проводимости, а удлинение интервала Q-T регистрировалось только у одного больного. У больных с кортикальными инфарктами замедление AV-проводимости наблюдалось у 2 (14,3 %), а удлинение интервала Q-T — у 3 (21,4 %) больных. Депрессия сегмента S-T регистрировалась в 5 раз, а отрицательный зубец Т — в 2 раза чаще при кортикальном инфаркте, чем при лакунарном инфаркте. Сглаженность зубца Т регистрировалась с одинаковой частотой — в 21,4 % случаев в каждой подгруппе. Регистрация ЭКГ в динамике показала, что у больных с лакунарным инфарктом отрицательной динамики ЭКГ не наблюдалось ни в одном случае, у 5 (35,7 %) наблюдалась положительная динамика в виде нормализации всех параметров ЭКГ. У 9 больных с лакунарным инфарктом существенной динамики ЭКГ не отмечено. У больных с кортикальными инфарктами положительная динамика ЭКГ зарегистрирована у 3 (21,4 %) больных, отрицательная динамика в виде появления или усиления депрессии сегмента S-T — у 4 (28,6 %), двое из которых умерли. У одного из этих больных по данным ЭКГ предполагали развитие инфаркта миокарда, который при патологоанатомическом исследовании не был подтвержден. Результаты полученных исследований позволяют предполагать, что на выраженность изменений ЭКГ и их динамику оказывают влияние размеры и локализация инфаркта мозга. Обширные инфаркты больших полушарий, охватывающие кору и прилежащее белое вещество лобно-теменно-височных долей, вероятно, с вовлечением островковой доли мозга и наиболее тяжелым течением инсульта вызывают более выраженные изменения ЭКГ, что позволяет предполагать их нейрогенный характер. Оценка изменений сердечной деятельности по данным ЭКГ у больных с ГИ показала, что тахикардия и экстрасистолия наблюдались несколько чаще, чем у больных с ИИ, замедление AV-проводимости и удлинение интервала Q-T более чем в 2 раза чаще, чем у больных с ИИ (у 12,5 и 27,5 %). Депрессия сегмента S-T и отрицательный зубец Т при регистрации на 1-е — 3-и сутки наблюдались несколько реже, чем у больных с ИИ (у 10,0 и 32,5 % больных), однако при повторной регистрации эти изменения не регрессировали, напротив, частота их увеличилась до 21,2 и 33,3 % соответственно. Сравнение изменений на ЭКГ в зависимости от пораженного полушария у больных с ГИ показало, что удлинение интервала Q-T также чаще было связано с поражением левого полушария. Частота изменений сегмента S-T и появление отрицательного зубца Т в первые 3 суток инсульта статистически значимо не отличалась от больных с ИИ. При анализе ЭКГ в динамике были выявлены те же тенденции, что и при ИИ. При локализации очага в левом полушарии частота этих изменений уменьшалась, тогда как при поражении правого полушария изменения сохранялись, и частота их увеличивалась. Сравнение динамики изменений ЭКГ показало, что у выживших больных с ГИ при повторной регистрации количество «нормальных» ЭКГ увеличилось до 18,2 %, а у больных с ИИ — только до 13,0 %. Мы провели также анализ частоты наиболее типичных изменений ЭКГ у больных с латеральной локализацией гематомы в сравнении с медиальной и смешанной гематомой. Отмечено, что такие изменения, как удлинение интервала Q-T и отрицательный зубец Т, статистически значимо чаще наблюдались у пациентов с медиальной и смешанной гематомой (р < 0,05). Вероятно, большая частота изменений на ЭКГ при медиальной и смешанной локализации внутримозговой гематомы связана с тем, что такая локализация оказывает большее сдавление III желудочка, промежуточного и среднего мозга, вызывая повреждение центральных вегетативных аппаратов.
Изменения деятельности сердца были зарегистрированы у 22 из 23 больных с САК. Брадикардия у больных с САК в 1-е — 3-и сутки заболевания регистрировалась у 34,8 %, что в 3 раза чаще, чем у больных с ГИ, и в 5 раз чаще, чем у больных с ИИ. При этом замедление AV-проводимости не было зарегистрировано. Удлинение интервала Q-T было зарегистрировано у 13,0 % больных, что не отличалось существенно от больных с ИИ, но было в 2 раза реже, чем при ГИ. Изменение сегмента S-T было частым феноменом и регистрировалось более чем у трети больных. Изменения зубца Т наблюдались у большинства больных в виде высокого зубца Т, сглаженности или отрицательного зубца Т. Особенностью динамики ЭКГ у больных с САК был транзиторный характер этих изменений при благоприятном течении заболевания. Так, у 8 из 16 выживших больных к 10–14-м суткам изменения на ЭКГ отсутствовали. Зависимость изменений ЭКГ и их динамики от размеров и локализации ишемического инфаркта мозга, локализации внутримозговой гематомы позволяет предположить их нейрогенный характер, обусловленный развитием нарушений центральной нейрогенной кардиоваскулярной регуляции в результате церебральной катастрофы.
Анализ ВСР у больных ИИ показал, что при первом обследовании (на 1-е — 3-и сутки) наблюдалось угнетение всех исследуемых показателей ВСР (табл. 1).
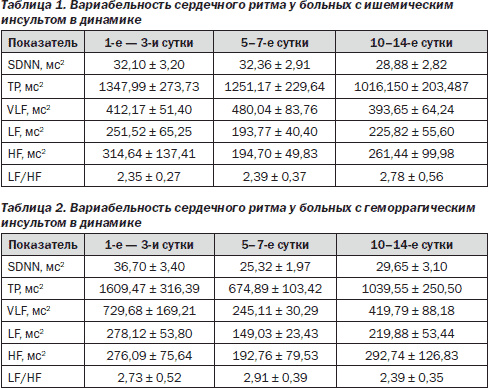
Наиболее выраженными были снижение SDNN, HF-компонента спектра, отражающего парасимпатические влияния и LF-компонента, отражающего симпатические влияния, а также VLF-компонента. Отношение LF/HF составило 2,35 ± 0,27, что свидетельствует об активации симпатических влияний при остром ИИ. При оценке показателей ВСР у больных с ИИ в динамике статистически значимых различий между ними получено не было. Нами отмечено, что все показатели ВСР имели тенденцию к дальнейшему снижению, так, общая мощность колебаний сердечного ритма (ТР) снизилась в 1,3 раза, HF-компонент — в 1,2 раза к 10–14-м суткам. Наблюдалось незначительное увеличение отношения LF/HF, что указывает на сохраняющееся преобладание симпатической регуляции. Данные изменения свидетельствуют о сохранении нарушений автономной регуляции сердца у этих больных на протяжении всего острого периода ИИ при уменьшении тяжести состояния больных по шкале NIHSS с 8,2 ± 2,3 до 5,4 ± 1,7 балла. Была выявлена достоверная корреляционная зависимость между отношением LF/HF и баллом по шкале NIHSS на 1-е — 3-и сутки инсульта (r = 0,43; р = 0,003), а также на 10–14-е сутки (r = 0,52; р = 0,002).
Оценка ВСР у больных с ГИ показала, что при первом исследовании (на 1-е — 3-и сутки) также отмечалось снижение SDNN, общей мощности спектра и всех ее компонентов (табл. 2).
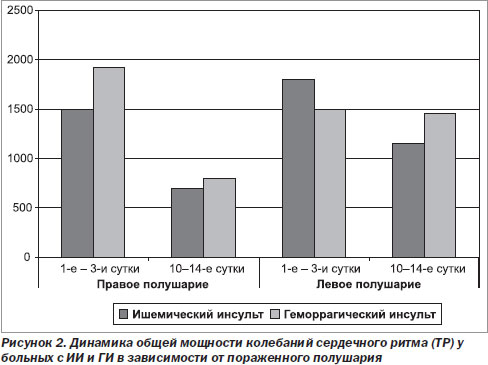
Мощность спектра в области очень низких частот (VLF) была статистически значимо выше (в 1,8 раза) при ГИ, чем при ИИ (р < 0,03). Отношение LF/HF 2,73 свидетельствует о преобладании симпатической активности. При исследовании в динамике отмечено, что на 5–7-е сутки по сравнению с 1–3-ми статистически значимо снижались SDNN в 1,4 раза (р < 0,01), ТР — в 2,4 раза (р < 0,04), вклад компонента VLF — в 2,9 раза (р < 0,002). Компонент HF в динамике при ГИ, напротив, имел тенденцию к увеличению в отличие от ИИ. У больных с ГИ наблюдалась достоверная отрицательная корреляционная зависимость между показателем шкалы комы Глазго и SDNN (r = –0,43, p = 0,01), ТР (r = –0,52, p = 0,003), VLF (r = –0,39, p = 0,03) HF (r = –0,46, р = 0,009) и LF (r = –0,50, р = 0,004). Таким образом, у больных с ГИ динамика показателей ВСР также отражала динамику их состояния. При благоприятном течении инсульта наблюдалось восстановление нормальных спектральных соотношений параллельно с улучшением состояния больных и положительной динамикой ЭКГ. Мы провели сравнительную оценку ВСР у больных с острым инсультом в зависимости от пораженного полушария, которая выявила существенные различия. Так, у пациентов с поражением правого полушария как в результате ишемического инфаркта, так и ГИ наблюдалось статистически значимое снижение SDNN в 1,5 раза к 10–14-м суткам (р < 0,05), общей мощности колебаний сердечного ритма (ТР) — в 2,3 раза (р < 0,05), тогда как при поражении левого полушария значительного снижения не отмечалось. Сравнительная оценка динамики ТР при ИИ и ГИ в зависимости от пораженного полушария выявила отчетливую тенденцию к значительной редукции общей мощности спектра при очагах в правом полушарии к 10–14-м суткам, тогда как при очагах в левом полушарии такая динамика отсутствовала (рис. 2).
При анализе ВСР на 1-е — 3-и сутки у больных САК было отмечено снижение SDNN (табл. 3), однако этот показатель был статистически значимо выше, чем у больных с ИИ (р = 0,001) и ГИ (р = 0,026).
Общая мощность спектра и ее составляющая VLF не снижались и были статистически значимо выше, чем у больных с ИИ и ГИ. Так, ТР при САК был в 2,5 раза больше, чем при ИИ (р = 0,001), и в 2,1 — чем при ГИ (р = 0,001), VLF при САК был в 2,9 раза больше, чем при ИИ (р = 0,007), и в 1,7 раза — чем при ГИ (р = 0,007). Отмечалось снижение низкочастотной составляющей спектра, однако она также была статистически значимо выше в 2,4 раза, чем при ИИ (р = 0,0009), и в 2,2 раза — чем при ГИ (р = 0,002). Мощность спектра в области высоких частот при САК на 1-е — 3-и сутки была статистически значимо выше в 3,2 раза, чем при ИИ (р = 0,002), и в 3,7 раза чем при ГИ (р = 0,001). Оценка ВСР в динамике показала, что имелась тенденция к дальнейшему снижению SDNN. Отмечались статистически значимые снижения ТР к 5–7-м суткам в 2,5 раза (р = 0,003), к 10–14-м суткам в 2,3 раза (р = 0,005) по сравнению с 1–3-ми, VLF в 2,1 раза к 5–7-м суткам (р = 0,006) и в 2 раза (р = 0,008) к 10–14-м, LF в 2,9 раза (р = 0,004) к 10–14-м суткам, HF в 3,9 раза (р = 0,014) к 5–7-м суткам и в 4,6 (р = 0,008) раза к 10–14-м суткам. Отношение LF/HF имело тенденцию к увеличению в 1,6 раза к 10–14-м суткам. У больных САК выявлена достоверная корреляционная зависимость между показателем шкалы Ханта и Гесса и соотношением LF/HF (r = 0,42; р = 0,04).
С целью уточнить, связаны ли выявленные изменения ЭКГ и центральной автономной кардиоваскулярной регуляции с повреждением сердечной мышцы, мы провели определение в сыворотке крови Тн1 у 48 больных: 14 больных с ИИ, 18 больных с ГИ и 16 больных с САК. Определение проводилось в динамике дважды на 1-е — 3-и и 5–7-е сутки острого инсульта. Повышение Тн1 выше контрольных значений в 1-е — 3-и сутки определялось у 10 (71,4 %) больных с ИИ. Однако повышение было незначительным и уровень Тн1 колебался в пределах 0,4–1,1 нг/мл. Средний уровень при первом обследовании составил 0,51 ± 0,07 нг/мл, при повторном — 0,86 ± 0,15 нг/мл, это повышение не было статистически значимым. При этом повышение Тн1 более 1,0 нг/мл отмечалось только при повторном исследовании у больных с крупными корково-подкорковыми инфарктами и у одного больного с большим фатальным инфарктом варолиева моста. При ГИ увеличение Тн1 выше контрольных значений наблюдалось у 16 (88,9 %) больных. Средний уровень на 1-е — 3-и сутки был статистически значимо выше,
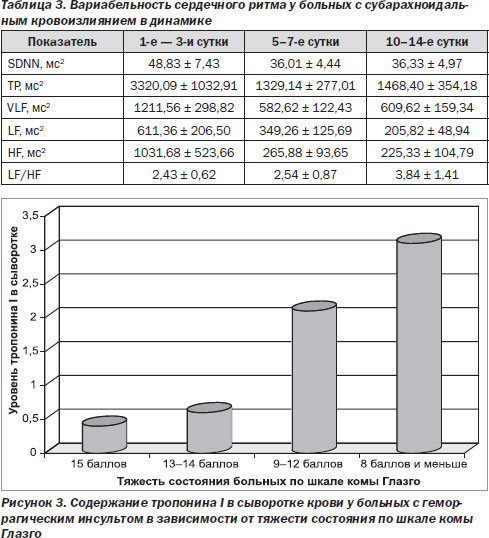
чем у больных с ИИ, и составил 1,29 ± 0,36 нг/мл (р < 0,05). Показатели находились в пределах 0,5–2,4 нг/мл. При повторном исследовании средний уровень Тн1 снизился и составил 0,98 ± 0,16 нг/мл. Корреляционная зависимость между тяжестью состояния больных с ГИ и уровнем Тн1 была статистически значимой: r = –0,69 (р = 0,0012) (рис. 3). При сопоставлении уровня Тн1 и ЭКГ отмечено, что изменения в виде удлинения интервала Q-T, депрессии сегмента S-T, отрицательного зубца Т наблюдались у больных с уровнем Тн1 выше 1,0 нг/мл как при ишемическом, так и при геморрагическом инсульте.
У больных с САК повышение Тн1 выше контрольных значений выявлено у 15 (93,75 %) на 1-е — 3-и сутки. Средний уровень составил 1,57 ± 0,27 нг/мл, что было статистически значимо выше, чем у больных ИИ, и незначимо выше, чем при ГИ. В динамике у выживших больных отмечалось снижение этого показателя до 1,02 ± 0,10 нг/мл. У больных с САК также наблюдалась отчетливая тенденция к нарастанию уровня Тн1 в зависимости от тяжести по шкале Ханта и Гесса, однако корреляционная зависимость была статистически незначимой (r = 0,46; р = 0,072). Умерли 2 больных с ИИ, 5 больных с ГИ и 5 больных с САК. У всех умерших уровень Тн1 был выше 2,0 нг/мл. При этом острый коронарный синдром при ЭКГ, клиническом или патологоанатомическом исследовании не был диагностирован ни у одного больного. Таким образом, у большинства больных при всех типах острого инсульта определялось повышение маркера миокардиального некроза Тн1 без признаков острого коронарного синдрома, которое было наиболее значительным при ГИ и САК и ассоциировалось с тяжестью состояния больных. Появление гипертропонинемии при тяжелом инсульте, возможно, связано с возникновением микроочагов некроза, вызванных массивным выбросом катехоламинов и приводящих к ишемическому поражению сердца. Хотя нельзя исключить наличие асимптомной ишемической болезни сердца у части больных до развития инсульта, особенно при ИИ и ГИ, а острый инсульт провоцирует ее декомпенсацию.
Выводы
1. У больных с острым инсультом изменения ЭКГ характеризуются удлинением интервала Q-T, депрессией сегмента S-T, сглаженностью или отрицательным зубцом Т. Эти изменения чаще развиваются при кортикальных ишемических инфарктах и медиальной локализации гематомы. Выявлена асимметрия изменений ЭКГ в зависимости от поражения правого или левого полушария головного мозга: удлинение интервала Q-T чаще наблюдается при очагах в левом полушарии головного мозга. Для больных с САК в первые сутки характерны брадикардия, депрессия сегмента S-T и отрицательный зубец Т. Изменения ЭКГ у больных с САК носят более обратимый характер, чем при ИИ и ГИ.
2. Повреждения центральной автономной кардиоваскулярной регуляции наблюдаются при всех типах острого инсульта, характеризуются усилением симпатических влияний, которые наиболее значительны при ГИ и САК. При этом у больных с САК в течение первой недели наблюдается транзиторная парасимпатическая гиперактивность, которая затем сменяется усилением симпатической активности. Усиление симпатоадреналовых влияний коррелирует с тяжестью инсульта. Выявлена межполушарная асимметрия повреждения ВСР, что свидетельствует о влиянии определенных мозговых структур на развитие кардиальной дисфункции.
3. Выявленные изменения ЭКГ сопровождаются повышением маркера некроза миокарда Тн1, которое было наиболее значительным при ГИ и САК. Наблюдалась отчетливая тенденция к нарастанию тропонина I в зависимости от тяжести инсульта, которая достигала статистической значимости у больных с ГИ в зависимости от тяжести по шкале комы Глазго (r = –0,69, р = 0,0012). Это свидетельствует о том, что при тяжелом инсульте развивается повреждение миокарда, которое носит микроструктурный и субклинический характер и вызвано, вероятно, усилением симпатоадреналовой активации, то есть имеет нейрогенный характер. Ведение больных острым инсультом требует внимания кардиологов и мероприятий по защите миокарда для предотвращения вторичных кардиальных осложнений.
1. Белова А.Н. Шкалы, тесты и опросники в неврологии и нейрохирургии. — М., 2004. — 432 с.
2. Фонякин А.В., Гераскина Л.А., Трунова Е.С. Подходы к прогнозированию кардиальных осложнений в постинсультном периоде // Матеріали Першого Національного конгресу «Інсульт та судинно-мозкові захворювання», 14–15 вересня 2006 р., Київ. — С. 70-71.
3. Barber M., Morton J.J., Macfarla-ne P.W. et al. Elevated Troponin level are associated with sympathoadrenal activation in acute ischemic stroke // Cerebrovascular diseases. — 2006. — 23(4). — 260-266.
4. Brainin M., Tatschl C., Stollberger C., Yilmar N., Eckhardt R., Novotny M., Dachenhausen A. Opercular involvement prolong Q-T interval on ECG: systematic study of ECG changes seen on an acute stroke unit // Abstracts of 5th World Stroke Congress, 23-26 June 2004, Vancouver, Canada. — 91-92.
5. Buer E., Ashman R., Toth L.A. Electrocardiograms with large upright T-waves and Q-T intervals // Am. Heart J. — 1947. — 33. — 796-806.
6. Cheung R.T.F., Hachinski V. The insula and cerebrogenic sudden death // Arch. Neurol. — 2000. — 57(12). — 1685-1688.
7. Colivicchi F., Bassi A., Santini M., Caltagrirone C. Cardiac Autonomic derangement and arrythmias in right-sided stroke with insular involvement // Stroke. — 2004. — 35(9). — 2094-2098.
8. Cropp C.J., Manning G.W. Electrocardiographic changes simulating myocardial ischemia and infarction associated with spontaneous intracranial haemorrhage // Circulation. — 1960. — 22. — 25-38.
9. Fure В., Bruun Wyller Т., Thommessen B. Electrocardiographic and troponin changes in acute ischemic stroke // J. Intern. Med. — 2006. — 259(6). — 592-597.
10. Horowitz M.B., Willet D., Keffer J. The use of cardiac troponin I (cTnl) to determine the incidence of myocardial ischemia and injury in patients with aneurismal and presumed aneurismal subarachnoid haemorrhage // Acta Neurochir (Wien). — 1998. — 140. — 87-93.
11. Kesser D., Serdarogly P., Gradi A., Kapidzic A., Demetic A. et al. Electrocardiographic changes in patients with intracerebral haemorrhage in ICU // European Journal of Neurology. — 2001. — 8(2). — 49.
12. Kuroiwa Т., Morita H., Tanabe H., Ohta T. Significance of ST segment elevation in electrocardiograms in patients with ruptured cerebral aneurisms // Acta Neurochir (Wien). — 1995. — 133. — 141-146.
13. Lambert G., Naredi S., Eden E., Rydenhag В., Friberg P. Sympathetic nervous activation following subarachnoid haemorrhage: Influence of intravenous clonidin // Acta Anesthesiol. Scand. — 2002. — 46. — 160-165.
14. Lane R.D., Wallance J.D., Petrosky P.P. Schwartz G.E., Gradman A.H. Supraventricular tachycardia in patients with right hemisphere strokes // Stroke. — 1992. — 23. — 362-366.
15. Naredi S., Lambert G., Eden E. et al. Increased sympathetic nervous activity in patients with nontraumatic subarachnoid haemorrhage // Stroke. — 2000. — 31. — 901-906.
16. Norris J.W., Hachinski V.C., Myers M.G. et al. Serum cardiac enzymes in stroke // Stroke. — 1979. — 10. — 548-553.
17. Oppenheimer S.M., Hachinski V.C. The cardiac consequences of stroke // Neurol. Clin. — 1992. — 10. — 167-176.
18. Pasquini M., Laurent C., Kroumova M., Masse I., Peplanque D., Leclerc X., Bordet R., Leys D. Insular infarcts and electrocardiographic changes at admission // Journal of neurology (Sixteenth meeting of the European Neurological Society, 27–31 May, Lausanne, Switzerland). — 2006. — 253(2). — 16.
19. Raicevic R., Tavcioski D., Perisic O., Jekic D. The cardiac complication in patients with stroke // Abstracts of 5th World Stroke Congress, 23–26 June 2004,
20. Ramappa P., Marsh J., Carhuapoma J.R. et al Cardiac troponin I and myocardial injury as predictor of prognosis in aneurismal subarachnoid haemorrhage // Abstracts of 5th World Stroke Congress, 23–26 June 2004, Vancouver, Canada. — 239.
21. Rossetti A., Tonelli C., Catamo A., Finzi G., Mossini G.L., Quarantelli C., Taliani U., Pavesi A. Alteration Detected by Continuous Electrocardiography in acute ischemic stroker or TIA (SPIAH Study) // Cerebrovascular Diseases. 9th European Stroke conference,
22. Tung P., Koperlik A., Banki N. et al. Predictors of neurocardiogenic injury after subarachnoid haemorrage // Stroke. — 2000. — 35. — 548-557.
23. Wong K.Y., Swiggan S., Kennedin S., Wong S.Y., Gavin A., MacWalter R.S., Struthers A.D. Spectrum of cardiac abnormalities associated with long QT in stroke survival // Heart. — 2005. — 91(10). — 1306-1310.
24. Zaroff J., Rordorf G., Newell J., Ogilvy C., Levinson J. Cardiac outcome in patients with subarachnoid haemorrhage and electrocardiographic abnormalities // Neurosurgery. — 1999. — 44. — 34-39.
