Газета «Новости медицины и фармации» Неврология (328) 2010 (тематический номер)
Вернуться к номеру
Провоспалительные цитокины в прогнозе ишемического инсульта
Авторы: Т.С. Мищенко, Н.Б. Балковая, А.В. Линская, В.В. Соколик. ГУ «Институт неврологии, психиатрии и наркологии АМН Украины», г. Харьков
Версия для печати
Патогенетической основой возникновения цереброваскулярных заболеваний и их наиболее тяжелой формы — мозгового инсульта является концепция факторов риска. Ведущими факторами риска ишемического инсульта являются атеросклероз, атеротромбоз, артериальная гипертензия, инсулинорезистентность.
В последние годы все больше внимания уделяется изучению роли латентного воспалительного процесса в патологии сосудов и развитии на его основе атеросклероза [1]. Считается, что воспаление внутренних органов, хронические очаги воспаления потенцируют нарушения системы провоспалительных цитокинов, липидного обмена, приводят к развитию атеросклероза [2–4].
Атеротромбоз и атеротромболия являются причинами развития ишемического инсульта в 34–75 % случаев [5, 6]. Возникновение сосудистых катастроф в разных бассейнах артериального русла связано с появлением нестабильных бляшек [7, 8]. В процессе перехода стабильной атеросклеротической бляшки в нестабильное состояние важное значение имеет наличие воспалительного компонента. При атерогенезе избирательно в зоне поражения происходят сложные клеточно-молекулярные перестройки, характеризующиеся активацией и пролиферацией эндотелиальных гладкомышечных клеток, миграцией активированных лейкоцитов в очаг воспаления, а также выбросом цитокинов, факторов роста и других провоспалительных медиаторов в кровяное русло, что делает капсулу атеротромботической бляшки ранимой. Есть также данные о связи артериальной гипертензии с воспалительным процессом [9]. Высокая частота ишемического инсульта при сахарном диабете второго типа определяется прежде всего его вкладом в развитие атеротромбоза.
Одним из ранних клинических проявлений активации неспецифического воспаления является повышение активности провоспалительных цитокинов и белков острой фазы.
Цитокины являются важнейшими медиаторами воспалительного ответа организма, мощными иммуномодуляторными, про-, антивоспалительными и иммуносупрессорными агентами. Данные, полученные на животных моделях инсульта, свидетельствуют о ключевой роли цитокинов в развитии и исходе ишемического инсульта, запуске процессов, приводящих к повреждениям мозговой ткани, включая инфильтрацию лейкоцитами очага инсульта, активацию микроглиальных клеток, индуцибельной формы синтазы оксида азота и циклооксигеназы-2 [10]. Однако данные относительно участия цитокинов в молекулярных патогенетических механизмах генерации и развития воспалительного ответа организма при ишемическом инсульте у человека весьма малочисленны.
Целью нашего исследования было изучение уровней провоспалительных цитокинов и С-реактивного белка (СРБ) у больных с ишемическим атеротромботическим инсультом.
Объект и методы исследования
Определяли уровни провоспалительных цитокинов — интерлейкина-1α (ИЛ-1α) и интерлейкина-6 (ИЛ-6), а для оценки выраженности системного воспаления — уровень С-реактивного белка.
Обследовано 33 пациента в возрасте 47–68 лет (в среднем 58,4 ± 1,2 года), которые перенесли острый ишемический атеротромботический инсульт. Из них 15 пациентов — с тяжелым инсультом, 18 — с инсультом средней тяжести. У 28 больных (84,8 %) была артериальная гипертензия, у 4 (12,2 %) — сахарный диабет 2-го типа. Группа сравнения включала 10 практически здоровых лиц в возрасте 50–60 лет (в среднем 57,5 ± 1,4 года).
Для верификации диагноза «ишемический инсульт» использовали компьютерную томографию (14 больных), спиральную компьютерную томографию (19 больных), перфузионная компьютерная томография была проведена 3 больным. Для выявления атеросклеротического поражения магистральных артерий головы и шеи применяли ультразвуковое обследование.
Для определения уровней ИЛ-1α и ИЛ-6 использовали наборы IL-lα и IL-6 (набор реактивов ООО «Цитокин», Санкт-Петербург). Уровень СРБ определяли латексным методом.
Забор крови производили через 12–24 часа после развития симптомов инсульта.
Рассчитывали и анализировали средние величины (М), стандартные ошибки средних величин (m), достоверность различий оценивали по критерию Стьюдента.
Результаты и их обсуждение
Анализ показателей провоспалительной цитокиновой системы показал существенные их различия у больных с тяжелым ишемическим инсультом (табл. 1).
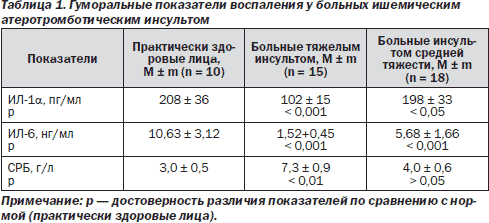
Так, у этих больных концентрация ИЛ-lα в сравнении с нормой была снижена на 50,95 % (в 2,03 раза), а ИЛ-6 — на 85,49 % (в 6,89 раза). Уровень СРБ у больных ишемическим атеротромботическим инсультом был повышен на 144 % (в 2,44 раза).
Хорошо сбалансированные взаимодействия мозга и иммунной системы, характерные для нормального состояния, нарушаются при остром ишемическом инсульте [11]. Одним из последствий такого нарушения регуляции является развитие воспаления в ткани мозга. Постишемический воспалительный ответ играет существенную роль в патогенезе ишемического инсульта. Этот ответ направлен на удаление некротизированной ткани из зоны ишемии, и в то же время он приводит к увеличению зоны ишемии и отягощает заболевание. Такое повреждение центральной нервной системы, как инсульт, вызывает иммуносупрессию, которая является еще одним следствием нарушения регуляции церебрально-иммунных взаимодействий.
Также известно, что ИЛ-6 может играть двоякую роль в развитии воспалительного ответа: оказывать типичные для этой группы провоспалительные эффекты и, одновременно ингибируя выработку ИЛ-1α, проявлять противовоспалительные свойства. Помимо этого, при ишемическом инсульте наблюдается также развитие воспалительного ответа организма на системном уровне. Выраженность и баланс именно этих противовоспалительных реакций будет влиять на прогноз заболевания.
Считается, что провоспалительные цитокины, в частности ИЛ-6, стимулируют выработку в печени таких острофазовых белков, как фибриноген, амилоид А и СРБ [12, 13]. В многочисленных исследованиях была продемонстрирована возможность при помощи показателя СРБ определять как первичный, так и вторичный прогноз при ишемической болезни сердца. Он является независимым предиктором развития сердечно-сосудистых осложнений [14, 15].
В нашем исследовании у больных тяжелым острым ишемическим инсультом установлен глубокий дефицит обоих цитокинов на фоне признаков аутоиммунного воспаления, о чем свидетельствует повышение концентрации СРБ. Это, по-видимому, указывает на снижение защитных сил организма.
Таким образом, низкий уровень провоспалительных цитокинов ИЛ-lα и ИЛ-6 на фоне системного воспаления с повышением уровня СРБ свидетельствует о феномене подавления ИЛ-6 ИЛ-1α в ущерб стимуляции защитных сил организма и является фактором неблагоприятного прогноза при данном заболевании.
В группе больных с ишемическим инсультом средней тяжести отмечались нормальные уровни ИЛ-1α при снижении в 1,86 раза (на 46,5 %) ИЛ-6. Эти изменения отражают начальные проявления феномена угнетения ИЛ-lα ИЛ-6, направленного на подавление системного воспалительного ответа. Нормальный уровень СРБ в этой группе больных свидетельствует об успешной работе цитокиновой системы по подавлению воспаления. Выявленные изменения, судя по всему, являются критерием благоприятного прогноза заболевания.
Таким образом, проведенные нами обследования свидетельствуют о существенных изменениях в системе провоспалительных цитокинов у больных ишемическим атеротромботическим инсультом, а уровень С-реактивного белка может быть критерием оценки общей воспалительной реакции. Характер изменений в системе провоспалительных цитокинов (ИЛ-1α и ИЛ-6), а также наличие общей воспалительной реакции могут служить критерием прогноза ишемического инсульта.
Выводы
1. Концентрации провоспалительных цитокинов ИЛ-1α и ИЛ-6, а также СРБ у больных острым ишемическим инсультом могут использоваться в качестве критерия прогноза заболевания.
2. Глубокий дефицит цитокинов ИЛ-1α и ИЛ-6 на фоне повышения концентрации СРБ указывает на снижение защитных сил организма и является фактором неблагоприятного прогноза.
3. Нормальный уровень ИЛ-1α при снижении концентрации ИЛ-6 и нормальном уровне СРБ свидетельствует об успешной работе цитокиновой системы по подавлению воспаления и является критерием благоприятного прогноза заболевания.
1. Коваль Д.М., Маньковский Б.Н. Изменения содержания маркеров воспалительного процесса в плазме крови больных сахарным диабетом 2-го типа под влиянием терапии глипизидом // Український медичний часопис. — 2002. — № 4 (30). — VII-VIII.
2. Bentz M.H., Magnette J. Hypocholesterolemia during the acute phase of an inflammatory reaction of infectious origin. 120 cases // Rev. Med. Interne. — 1998. — № 19 (3). —
P. 168-172.
3. Hasty A.H., Linton M.F., Brandt S.J. et al. Retroviral gene therapy in ApoE-deficient mice: ApoE expression in the artery wall reduces early foam cell lesion formation // Circulation. — 1999. — № 99 (19). — P. 2571-2576.
4. Gordon B.R., Parker T.S., Levine D.M. et al. Relationship of hypolipidemia to cytokine concentrations and outcomes in critically ill surgical patients // Crit. Care Med. — 2001. — № 29 (8). — P. 1563-1568.
5. Верещагин Н.В. Гетерогенность инсульта: взгляд с позиций клинициста // Журн. неврологии и психиатрии. — 2003. — 103, 9. — 8-9.
6. Инсульт: Практическое руководство для ведения больных / Ворлоу Ч.П., Денис М.С., Ван Гейн Ж. и др. / Под ред. А.А. Скоромца, В.А. Сорокоумова. — СПб.: Политехника, 1998.
7. Калло И.Дж., Эдварде В.Д., Шварц Р.С. Механизмы и клинические проявления разрывов атеросклеротических бляшек // Междунар. журн. мед. практики. — 2000. — 5. — 17-27.
8. Nandalur K.R., Baskurt E., Hagspiel K.D. et al. Calcified carotid atherosclerotic plaque is associated less with ischemic symptoms than is noncalcified plaque on MDCT // Am. J. Roentgenol. — 2005. — 1844, 1. — 295-298.
9. Шаврин А.П., Головской Б.В. Исследование связи маркеров воспаления с уровнем артериального давления // Цитокины и воспаление. — 2006. — № 4.
10. Бояджян А.С., Аракелова Э.А., Айвазян В.А., Манукян Л.А. Интерлейкины и хемокины при остром ишемическом инсульте, отягощенном и не отягощенном диабетом // Цитокины и воспаление. — 2008. — № 1.
11.
12. Ross R. Atherosclerosis — an inflammatory disease // N. Engl. J. Med. — 1999. — Vol. 340. — P. 115-126.
13. Szalai A.J. The biological function of C-reactive proteine // Vascul. Pharmacology. — 2002. —Vol. 39. — P. 105-107.
14. Blake G.J., Rifai N., Buring J.E., Ridker P.M. Blood pressure, C-reactive protein, and risk of future cardiovascular events // Circulation. — 2003. — Vol. 108. — P. 2993-2999.
15. Danesh J., Wheeler J.G., Hirschfie-eld G.M. et al. C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease // N. Engl. J. Med. — 2004. — Vol. 350. — P. 13887-1397.
