Газета «Новости медицины и фармации» 10(326) 2010
Вернуться к номеру
Современные возможности в лечении головной боли и головокружений
25–28 апреля в г. Cудак (АР Крым), состоялась XII Международная конференция «Актуальные направления в неврологии: настоящее и будущее».
К проблеме головной боли приковано внимание неврологов, поскольку, несмотря на проводимые диагностические и лечебные мероприятия, это состояние сохраняет свою распространенность. На состоявшемся в конференц-зале «Крым» сателлитном симпозиуме компании Фармак® «Боль» были рассмотрены основные диагностические критерии мигрени и современные методы ее лечения.
Главный внештатный невролог МЗ Украины, руководитель отдела сосудистой патологии головного мозга Института неврологии, психиатрии и наркологии АМН Украины (г. Харьков) профессор Т.С. Мищенко представила доклад, посвященный дифференциальным критериям мигрени.
Проблема мигрени актуальна для нашей страны. В первую очередь это связано с тем, что в Украине отсутствует официальная статистика распространенности данного состояния в отличие от западных стран, где проводятся популяционные исследования.
Кроме того, среди врачей распространено мнение, что симптомокомплекс мигрени носит вторичный характер, возникая на фоне неврологических заболеваний. Не следует забывать, что удельный вес мигрени, как сопутствующей патологии в структуре головной боли, составляет всего 10 %. Отсюда зачастую неправильная лечебная тактика этого состояния.
Мигрень — это наиболее «старое» заболевание из ныне известных.
В мире 180 млн людей страдают мигренью. Практически каждый человек хотя бы раз в жизни перенес приступ мигренозной головной боли. Мигренью в 3 раза чаще болеют женщины, чем мужчины, средний возраст таких больных — от 18 до 50 лет.
Согласно данным эпидемиологических исследований, распространенность мигрени достигает 11 %. В европейских странах в структуре головной боли первое место занимает мигрень. Кроме того, мигрень считается одним из высокостоимостных заболеваний.
В США ежегодные прямые и косвенные потери от мигрени превышают 15 млн долларов, в Европе эта цифра достигает 20 млрд евро. Ежегодные затраты на амбулаторную и экстренную медицинскую помощь, а также госпитализацию при мигрени составляют 817 долларов из расчета на одного больного.
Проблема мигренозной боли активно изучается. Так, в США данную проблему изучают в специальных институтах, которых насчитывается около 1500. В Украине, к сожалению, мигренозная боль изучается в частных центрах.
Как известно, мигрень — это периодически повторяющийся приступ интенсивной головной боли пульсирующего характера, чаще односторонний, локализующийся преимущественно в лобно-височной области, сопровождающийся фото- и фонофобией, тошнотой, рвотой, свето- и водобоязнью (часто предшествует аура) и обостряющийся при физической нагрузке. Как правило, приступы начинаются в молодом возрасте.
Благодаря внедрению в клиническую практику современных методов нейровизуализации (КТ, МРТ, позитронно-эмиссионная томография) сегодня можно говорить о революционном изменении взглядов на механизмы развития мигрени. Как известно, взгляды на развитие мигрени постоянно изменялись — от биохимической, сосудистой, нейрогенной теорий до современной тригеминоваскулярной. Тригеминоваскулярная теория сегодня считается наиболее патогенетически обоснованной. Она заключается в том, что при воздействии провоцирующего фактора возникает нейрональная гиперактивность в затылочной области головного мозга с распространением на другие области и активацией тригеминальной системы. Фактором, подтверждающим участие рецепторов S-НТ в развитии мигрени, является купирование симптомов мигрени после внутривенного введения агонистов S-НТ.
Международным обществом по изучению головной боли определены следующие диагностические критерии мигрени (2008):
1) для простой мигрени:
2) мигрень с аурой, или ассоциированная мигрень. Мигренозная атака должна иметь не менее трех признаков:
— соответствие мигренозной боли критериям простой мигрени.
Долгое время считалось, что мигрень является гетерогенным заболеванием. Но проведенные нейровизуализационные исследования показали, что при мигрени развиваются прогрессирующие структурные изменения головного мозга. Так, у больных с частыми приступами заболевания обнаружено снижение плотности серого вещества лобной доли, лимбической системы, а также снижение плотности белого вещества лобных долей головного мозга. Кроме того, в последние годы накапливаются данные о том, что мигрень является фактором риска развития ишемического инсульта, причем в 3 раза выше риск у больных с ассоциированной мигренью, нежели у пациентов с простой мигренью.
Лечение мигрени состоит:
Медикаментозное лечение мигрени включает назначение НПВП в высоких дозах при отсутствии противопоказаний к их назначению, при наличии симптомов тошноты и рвоты — сочетание НПВП с противорвотными препаратами, триптаны — суматриптан и золмитриптан. На украинском фармацевтическом рынке золмитриптан представлен препаратом Золмигрен® компании Фармак®, который угнетает проведение болевых импульсов, обладает способностью проникать в центры мигрени, расположенные в головном мозге, воздействуя таким образом на причину возникновения головной боли.
Золмигрен® действует на афферентные и эфферентные волокна тройничного нерва, обеспечивая купирование тригеминального компонента боли. Препарат также обладает центральным действием, блокируя проведение болевых импульсов от ствола головного мозга, и периферическим, которое заключается в сужении дилатированных сосудов во время мигренозной атаки, блокаде болевых импульсов на уровне афферентных окончаний тройничного нерва.
Современные аспекты лечения мигрени освещены в докладе к.м.н. О.О. Савчук (Крымский государственный медицинский университет им. С.И. Георгиевского, г. Симферополь).
Мигрень относится к одной из наиболее частых причин обращений пациента к врачам различных специальностей. Мигрень является ведущим, а иногда и единственным симптомом более 45 заболеваний.
В патогенезе мигренозной боли огромное значение имеет дисфункция центральных серотонинергических систем, влияющих на восприятие боли. У пациентов с мигренью предполагается наличие генетически детерминированной лимбико-стволовой дисфункции, приводящей к изменению взаимоотношения анти- и ноцицептивной систем со снижением влияния последней. Перед приступом происходит нарастание уровня мозговой активации с последующим снижением ее во время болевой атаки. Одновременно активируется тригеминоваскулярная система — преимущественно с одной стороны, что и определяет гемикранический характер боли. В периваскулярных окончаниях тройничного нерва при его активации выделяются вазоактивные вещества: субстанция Р, кальциотонин, вызывающие резкое расширение сосудов, нарушение проницаемости сосудистой стенки и инициирующие процесс нейрогенного воспаления (выделение в периваскулярное пространство из сосудистого русла ноцицептивных веществ: простагландинов, брадикининов, гистамина, серотонина и др.). При мигрени особое значение отводится именно серотонину. Перед приступом мигренозной головной боли усиливается агрегация тромбоцитов, из них высвобождается серотонин, что приводит к сужению крупных артерий и вен и расширению капилляров (важнейший фактор развития первой фазы приступа). Головная боль при мигрени, таким образом, является следствием возбуждения афферентных волокон тройничного нерва в результате выделения ряда биологически активных ноцицептивных веществ, участвующих в формировании нейрогенного воспаления.
Триптаны относятся к средствам патогенетической терапии мигрени. Терапию препаратами данной группы необходимо начинать как можно раньше. Золмигрен® является селективным агонистом 5-НТ1 с двойным механизмом действия, который и воздействует специфически на рецепторы подтипов 5-НТ1В, 5-НТ1D.
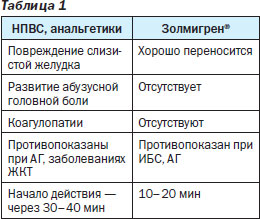 Золмигрен® применяется для купирования приступов мигрени:
Золмигрен® применяется для купирования приступов мигрени:
Проведенные исследования подтверждают высокую эффективность золмитриптана (Золмигрен®):
Заслуживает внимания проведенное исследование применения анальгетиков для лечения приступов мигрени. По данным ученых под руководством исследователей из Колледжа медицины Альберта Эйнштейна Университета Ешива (США), которые исследовали более 8000 пациентов, страдающих мигренью, был сделан вывод, что прием препаратов, содержащих анальгетики, приводит к повторному возникновению мигрени и повышению риска развития трансформированной мигрени (ТМ).
Проблема цервикогенной головной боли освещалась в докладе доцента ХМАПО к.м.н. А.А. Ярошевского.
Понятие цервикогенной головной боли (ЦГБ) впервые было сформулировано О. Sjaastad и T. Fredriksen в 1990 году. В последней версии МКГБ (
В МКГБ изложены следующие диагностические критерии и клинические особенности ЦГБ:
А — боль, исходящая из источника в области шеи и ощущаемая в одной или нескольких зонах головы и/или лица;
В — клинические, лабораторные и/или нейровизуализационные признаки нарушения или повреждения в области шейного отдела позвоночника или мягких тканей шеи, которые являются достоверной или возможной причиной головной боли;
С — причинная связь головной боли с патологией шейной области основывается по меньшей мере на одном из следующих симптомов:
Д — головная боль прекращается в течение 3 мес. после успешного лечения нарушения или повреждения, вызвавшего болевой синдром.
В настоящее время ЦГБ (цервикокраниалгию) следует рассматривать не как самостоятельную нозологию, а как симптомокомплекс, этиологически и патогенетически связанный с нарушениями в шейном регионе. Соответственно, понятие ЦГБ объединяет различные по механизму типы головной боли, связанные с заболеваниями и патологическим состоянием шейного отдела позвоночника и других структурных образований шеи.
Хорошо известно, что наиболее частыми структурами, участвующими в формировании шейной головной боли, являются верхние шейные синовиальные сочленения, верхние шейные мышцы, межпозвоночный диск С2-С3, позвоночная и внутренняя сонная артерии, твердая мозговая оболочка верхнего отдела спинного мозга, а также структуры, иннервируемые С1-С3 спинальными нервами.
Анатомической и физиологической базой формирования ЦГБ служит наличие конвергенции между афферентами тройничного нерва и трех верхних затылочных нервов (тригеминоцервикальная система).
Из клинических особенностей ЦГБ следует отметить развитие симптомокомплекса на фоне поражения позвоночника, суставов и мышечно-скелетных структур. Провоцирующими факторами являются резкое движение головой, длительное пребывание в неудобной позе, длительное изометрическое напряжение, а также психоэмоциональное перенапряжение. Нередко ЦГБ сочетается с латерализацией и головокружением.
В целом клинические проявления определяются механизмами развития ЦГБ. В зависимости от патогенеза различают цервикогенную сосудистую головную боль, невралгическую цервикокраниалгию и головную боль напряжения (рефлекторную мышечно-тоническую).
Среди причин развития цервикогенной цефалгии с сосудистым механизмом различают вертеброгенные, которые включают ирритацию симпатического сплетения позвоночной артерии при унковертебральном артрозе или гиперэкстензионном подвывихе позвонков, ирритацию ветвей афферентного симпатического нерва в заднем корешке при заднебоковой грыже диска и спондилезе, функциональное блокирование в верхнешейных дугоотростчатых суставах С0-С1, С1-С2, С2-С3, артрозы унковертебральных сочленений, нестабильность двигательных сегментов шейного отдела, краниальные патобиомеханические нарушения (компрессия затылочно-сосцевидного шва, сфенобазилярный синхондроз и др.), а также травматический атланто-аксиальный подвывих.
Важное значение в развитии цервикогенной сосудистой головной боли имеет миофасциальная дисфункция, заключающаяся в ирритации проприорецепторов в спазмированных позных мышцах, мышечно-сухожильной компрессии позвоночной артерии, ирритации спазмированными мышцами постганглионарных симпатических волокон позвоночной и подключичной артерий со спазмом ПА, а также заднешейный симпатический синдром.
В патогенезе невралгической цервикокраниалгии различают два механизма — компрессионный (туннельный) и/или ирритативный.
Невралгическая цервикокраниалгия развивается при вовлечении в патологический процесс большого затылочного нерва, который проходит между атлантом и полуостистой или нижней косой мышцей. Большой затылочный нерв С2 вовлекается в патологический процесс при тонических и дистрофических изменениях в полуостистой и нижней косой мышцах головы (в верхне- и среднешейной областях).
В диагностике ЦГБ необходимо проводить оценку биомеханических и миофасциальных нарушений, а также тревожных и вегетативных нарушений. Данные дополнительных методов обследования играют важную роль в постановке диагноза, однако первое место в диагностике принадлежит клинической симптоматике. Недооценка клинических проявлений и переоценка рентгенографических методов исследования являются частыми причинами гипердиагностики остеохондроза позвоночника. Следует учитывать, что признаки остеохондроза на рентгенограммах после 25-летнего возраста обнаруживаются почти всегда, но это не означает, что имеющиеся у пациента боли во всех случаях связаны с этими находками. Поэтому только сопоставление клинических проявлений с результатами специальных методов диагностики и их логическое соответствие друг другу способствуют установлению правильного диагноза.
Во время проведения визуальной диагностики оценивают произвольные движения в шейном отделе позвоночника, положение плеч, головы, контуры шеи при осмотре сбоку, состояние позвоночника в целом.
При осмотре пациента особое внимание обращают на аномалии развития, асимметрии тела, особенности осанки, специфику ходьбы, выраженность физиологических изгибов позвоночника, наличие анталгического сколиоза.
Лечение ЦГБ заключается в проведении немедикаментозной коррекции МФД и назначении медикаментозных средств. Немедикаментозная коррекция МФД включает биомеханическую коррекцию позвоночника, применение мягких техник мануальной терапии, акупрессуры, вакуумрефлексотерапии, классической акупунктуры и лечебной гимнастики. Из медикаментозных средств — назначение НПВП, как неселективных, так и селективных, но предпочтение отдается мелоксикамам (Ревмоксикам®), миорелаксантам. При мигренозноподобной ЦГБ препаратом выбора является Золмигрен®.
Таким образом, лечение ЦГБ предполагает дифференцированный подход с учетом механизмов ее развития. Приоритетными в устранении рефлекторно-мышечных механизмов цефалгии являются методы мануальной терапии и рефлексотерапии. Применение анальгетиков должно быть разумным, но предпочтительно назначение селективных НПВП (Ревмоксикам®). При мигренозноподобном механизме ЦГБ показано назначение препарата Золмигрен®.
С докладом «Лечение головной боли. Инструментальная дифференциация. Пример из практики» выступил профессор К.Ф. Тринус, НМАПО им. П.Л. Шупика, г. Киев.
Он отметил, что сегодня определение головной боли находится в диапазоне субъективных ощущений, поскольку нет такого метода, как инструментальная документация головной боли. Это натолкнуло на поиск возможности осуществления регистрации боли. Проведено исследование с участием 180 пациентов с наиболее типичными головными болями — мигренью, кластерными головными болями, головной болью напряжения, а также пациенты без головной боли, но имеющие головокружение. Использовали различные методы, основным из которых было измерение диаметра зрачка. В ходе исследования у больных с различными типами головной боли определялись различные изменения диаметра зрачка. Кроме того, у всех исследуемых отмечались вестибулярные нарушения.
В лечении вестибулярных нарушений, в том числе головокружения, широко применяют вестибулолитические препараты. У пациентов с головокружением на фоне головной боли препаратом выбора является Вестинорм®. На базе кафедры бетагистином пролечены 47 больных. Положительная динамика отмечена у 80 % больных, у которых в течение одного месяца достигнуто практически полное купирование симптомов мигрени. У 30 % пациентов на фоне лечения бетагистином отмечены рецидивы заболевания, поэтому им препарат был назначен курсом в течение 3 месяцев.
В докладе доцента Ю.И. Горанского (Одесский государственный медицинский университет) рассмотрены вопросы нейропатической боли.
Нейропатическая боль возникает как патология периферической нервной системы. По данным популяционных исследований, распространенность невропатических болей достигает 8 %. Основными причинами развития нейропатических болей являются:
Основные направления лечения нейропатической боли заключаются в назначении этиотропной и патогенетической терапии. Отдельно следует выделить такое направление, как борьба с болевым синдромом как с помощью фармакотерапии, так и немедикаментозными методами.
Основные трудности в лечении нейропатической боли связаны с тем, что эффективность анальгетиков и НПВП крайне низкая. Поэтому первое место в лечении нейропатических болей занимают антиконвульсанты, антагонисты рецепторов ГАМК, центральные блокаторы кальциевых каналов и др.
Группа антиконвульсантов достаточно разнородна по механизму антиболевого эффекта в связи с различным воздействием на механизмы электрогенеза. Антиконвульсанты достаточно часто назначаются при различных периферических нейропатиях, поражении корешков спинного мозга, центральных постинсультных болях и др. Поскольку к этим препаратам у пациентов развивается привыкание, рекомендуется каждые 6 мес. назначать другой антиконвульсант.
В связи с этим интерес представляет механизм действия препарата Эпилептал® (ламотриджин). Благодаря отсутствию влияния на уровень глутамата на фоне его применения не отмечается ухудшение когнитивных функций в отличие от большинства антиконвульсантов. Более того, в исследованиях показано, что применение препарата Эпилептал® сопровождается улучшением некоторых когнитивных функций, в том числе обучаемости пациентов. Кроме противоболевого, этот препарат обладает антидепрессивным и нормотимическим эффектами.
В исследованиях, в которых изучалась эффективность Эпилептала® у больных с синдромом диабетической стопы, показана его эффективность в возрастающих дозах начиная с 25 мг в течение 2 недель с последующим повышением дозы до 50 мг в сутки в течение 2 недель, затем дозу повышают до 100–400 мг в сутки на протяжении одной недели. Благодаря такой схеме лечения отмечается меньшая частота привыкания к препарату, что позволяет сохранить приемлемый терапевтический эффект.
Современные аспекты головокружения стали темой рассмотрения на сателлитном симпозиуме компании Фармак®.
Результаты количественной оценки эффективности бетагистина (Вестинорм®) в реабилитации больных с инсультом впервые представлены в докладе к.м.н. Д.В. Шульженко, ГУ «Институт геронтологии АМН Украины», г. Киев.
Принято считать, что бетагистин применяется при головокружениях на фоне поражения вестибулярного аппарата. Однако у больных, перенесших инсульт, двигательные нарушения нередко сопровождаются выраженными вестибулярными расстройствами. Это определяет целесообразность применения препарата Вестинорм® у больных, перенесших инсульт. Как известно, он является агонистом Н1-рецепторов постсинаптических мембран и антагонистом Н3-рецепторов пресинаптических мембран внутреннего уха и вестибулярных ядер ЦНС. Благодаря такому действию на фоне этого препарата отмечено следующее:
Таким образом, механизм действия исследуемого препарата, а также проведенные зарубежными авторами исследования, посвященные применению бетагистина при нарушениях мозгового кровообращения, показали, что бетагистин увеличивает регионарный кровоток в задних и передних отделах полушарий головного мозга, улучшает когнитивную функцию, усиливает кровоснабжение сосудов вертебробазилярного и каротидного бассейнов.
Это обусловило целесообразность изучения влияния препарата Вестинорм® не только на функцию вестибулярного анализатора, но и на функциональное состояние ЦНС у больных, перенесших ишемический инсульт.
В продолжающемся пилотном исследовании продемонстрировано улучшение функции равновесия, устойчивости.
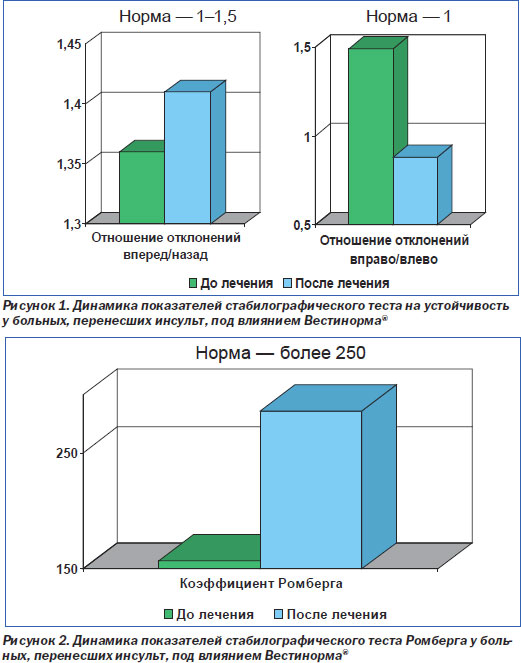
Также в данном исследовании изучалось влияние на показатели церебральной гемодинамики (рис. 1, 2). Следует отметить, что после лечения препаратом Вестинорм® увеличилась линейная систолическая скорость кровотока в вертебробазилярном бассейне и внутренних сонных артериях, а также снизилось общее периферическое сосудистое сопротивление в сонных артериях. В исследовании продемонстрировано симметричное равномерное влияние препарата на интактные каротидные и вертебробазилярные сосуды.
Вестинорм® также оказывает гармонизирующее влияние на показатели электроэнцефалограммы: снижается медленная активность и несколько увеличивается быстрая активность.
Таким образом, применение препарата Вестинорм® в дозе 48 мг в сутки на протяжении 20 дней стационарного лечения и 2 месяца амбулаторно у больных, перенесших ишемический инсульт, позволяет улучшить качество движений, равновесия и когнитивных функций.
Тему эффективности препарата Вестинорм® в реабилитации больных, перенесших инсульт, продолжила д.м.н., профессор С.М. Кузнецова (ГУ «Институт геронтологии АМН Украины»).
Двигательные нарушения при ишемическом инсульте сопровождаются асимметрией вертикальной позы, вызванной смещением центра давления тела в сторону здоровой ноги, что приводит к неустойчивости больных как при стоянии, так и при ходьбе, повышает опасность падения, снижает качество походки и скорость перемещения.
У больных, перенесших ишемический инсульт, в зависимости от локализации очага выводится из строя тот или иной уровень построения движения, который является ведущим или фоновым в выполнении конкретной поставленной задачи. Центральная нервная система не получает должной афферентации с периферии, в связи с чем не может адекватно координировать функцию ходьбы и равновесия.
В реализации двигательных актов важное значение отводится нейромедиаторным системам, баланс которых нарушается при инсульте.
Гистамин является биогенным соединением, образующимся в организме при декарбоксилировании аминокислоты гистидина.
Высокая плотность гистаминергических нейронов отмечается в области сосудистой полоски во внутреннем ухе и туберомамиллярных ядрах задней части гипоталамуса. Их эфферентные волокна обнаружены по всему веществу головного мозга.
Препарат Вестинорм® является агонистом Н1- и антагонистом Н3-рецепторов, расположенных во внутреннем ухе и вестибулярных ядрах ЦНС. Стимулируя постсинаптические Н1-рецепторы, он увеличивает выброс гистамина, а благодаря блокированию Н3-рецепторов угнетается захват гистамина, в результате чего его действие продлевается. Кроме того, активация постсинаптических Н1-рецепторов сопровождается расширением сосудов, улучшением микроциркуляции и метаболического обмена, увеличением проницаемости капилляров, уменьшением эндолимфатического отека, нормализацией давления эндолимфы в лабиринте и улитке, усилением кровотока в базилярной артерии. Действие на постсинаптические Н3-рецепторы оказывает регулирующий эффект на высвобождение самого гистамина и некоторых других нейромодуляторов из нервных клеток:
Целесообразность применения бетагистина при недостаточности мозгового кровообращения обоснована исследованиями:
Таким образом, терапевтический эффект бетагистина (Вестинорм®) у больных с инсультом базируется на нормализации возбудимости вестибулярных ядер ствола головного мозга путем ингибирования спонтанной и вызванной импульсации от Н3-рецепторов нейронов центральной и периферической вестибулярной систем, т.е. препарат обладает нейромодулирующим действием.
Влияние препарата Вестинорм® на функциональное состояние ЦНС проявляется увеличением линейной систолической скорости кровотока в экстракраниальных сосудах каротидного и вертебробазилярного бассейнов и гармонизацией биоэлектрической активности головного мозга.
По данным компьютерной стабилографии, под влиянием приема препарата Вестинорм® у больных, перенесших инсульт, улучшается качество функции равновесия (рис. 1, 2).
Поэтому оправдано назначение препарата Вестинорм® в комплексной терапии в постинсультной реабилитации, что обеспечивает положительное влияние на скорость и качество реабилитации больных, перенесших инсульт.
В докладе «Вегетососудистая дистония. Причины, клиника, диагностика» профессор О.Г. Морозова (ХМАПО, г. Харьков) осветила взаимосвязь вегетососудистой дистонии с вестибулярными нарушениями.
Головокружение входит в число наиболее частых жалоб, предъявляемых больными с вегетативными расстройствами. При вегетососудистой дистонии оно отличается от всех известных типов головокружения, является функциональным и не воспроизводится при провокационных пробах. Головокружение при синдроме вегетативной дистонии сопровождается выраженными аффективными (страх, тревога) и вегетативными (сердечными и дыхательными) феноменами. К наиболее широко распространенным формам функционального головокружения относятся:
— психогенное головокружение.
Характер головокружения может быть разным — от легкого покачивания при ходьбе до внезапных приступов с иллюзорным вращением окружающих предметов, но всегда при вегетососудистой дистонии оно сочетается с вегетативными симптомами: бледностью, тошнотой, снижением уровня артериального давления и т.д. Очень сложно выделить первопричину эмоционально-вегетативных дисфункций, поэтому функциональное головокружение является сложным для диагностики и лечения. Таким образом, головокружение — один из самых распространенных симптомов у больных с вегетативными расстройствами.
Далее О.Г. Морозова рассказала о результатах пилотного исследования, в котором приняли участие пациенты с вегетососудистой дистонией и симптомами вестибулярных расстройств, которым назначали Вестинорм® в дозе 24 мг 2 раза в сутки в течение 3 месяцев. В исследовании оценивалось влияние препарата на выраженность головокружения, а также его возможные воздействия на вегетативные функции.
Доказанные функции гистамина:
Предполагаются с большой вероятностью:
Продемонстрированы:
Был сделан вывод, что назначение препарата Вестинорм® по 16 мг 2–3 раза, 24 мг 2 раза на протяжении 2–4 мес. у пациентов с вегетативной дисфункцией и вестибулярными расстройствами является оправданным.
Подготовила Галина Бут
