Газета «Новости медицины и фармации» 10(326) 2010
Вернуться к номеру
Диагностика венозной тромбоэмболии: что нового?
Авторы: Prof. Haim Bitterman, Carmel Medical Centre, Faculty of Medicine, Technion–Israel Institute of Technology, Haifa, Israel
Версия для печати
Венозный тромбоз и его катастрофическое осложнение — тромбоэмболия легочной артерии (ТЭЛА) — остаются сложными и нередко несвоевременно распознанными заболеваниями, а проблема их возникновения, профилактики и лечения, на протяжении полутора веков привлекающая внимание исследователей, все еще не решена и дискуссионна во многих аспектах. Диагностические ошибки, возникающие при установлении диагноза венозной тромбоэмболии (ВТЭ), являются скорее правилом, нежели исключением. Диагностика ТЭЛА — трудная задача для практикующих врачей в связи с тем, что клиническая картина ассоциируется с обострением основного заболевания (ИБС, ХСН, ХЗЛ) или является одним из осложнений онкологических заболеваний, травм, обширных хирургических вмешательств, а специфические методы диагностики, такие как ангиопульмонография, сцинтиграфия, перфузионно-вентиляционные исследования с изотопами, спиральная компьютерная и магнитно-резонансная томография, осуществимы в единичных научно-медицинских центрах. Ситуация осложняется тем, что ТЭЛА далеко не всегда можно легко заподозрить и подтвердить, надежные диагностические методы требуют времени и финансовых затрат, в то время как тромбоэмболия во многих случаях развивается стремительно и ведет к жизнеугрожающему состоянию. Тромбоэмболия легочной артерии — это окклюзия просвета основного ствола или ветвей легочной артерии частичками тромба, сформировавшегося в венах большого круга кровообращения или полостях правого сердца, переносимыми в малый круг кровообращения с током крови. Тромбоз легочной артерии (ЛА) — локальное тромбообразование в системе легочных артерий [15]. Тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии являются разными проявлениями одной патологии — венозной тромбоэмболии [7]. В 70–90 % случаев причиной ТЭЛА является тромбоз глубоких вен, и наоборот — у половины пациентов с тромбозом глубоких вен нижних конечностей имеются тромбоэмболические поражения легочных сосудов (чаще асимптомные). ТЭЛА — третий по распространенности вид патологии сердечно-сосудистой системы после ИБС и инсульта. Ежегодно от ТЭЛА умирает 0,1 % населения земного шара [15]. ТЭЛА — причина гибели 1 из 1000 пациентов с ВТЭ, 8 % пациентов с тромбозами глубоких вен умирают на протяжении месяца. Точные статистические данные по заболеваемости и смертности от ТЭЛА на сегодняшний день неизвестны, однако примерно распространенность ТЭЛА, по данным 25-летнего популяционного исследования M.D. Silverstein et al. (1998), проведенного в штате Миннесота (США), оценивается как 1 случай на тысячу населения в год. Разные исследования показывают разные результаты — от 0,5 до 2 на тысячу населения в год. Однако риск ТЭЛА резко возрастает у лиц, находящихся на стационарном лечении (независимо от диагноза). P.D. Stein et al. (2004) показали, что среди госпитализированных пациентов распространенность ТЭЛА в США достигает 0,4 %. Наряду с этим количество нефатальных асимптомных тромбоэмболий легочного русла определить пока не удается. Ежегодная частота развития ВТЭ в общей популяции колеблется от 107 до 160 случаев на 100 000 населения.
В США ежегодно регистрируется около 450 000 случаев ТГВ и 650 000 случаев ТЭЛА. И хотя чаще всего ВТЭ развивается на фоне предрасполагающих состояний, в частности длительной иммобилизации, после ортопедических вмешательств или операций на органах брюшной полости, при опухолях, однако примерно в 50 % случаев ВТЭ могут носить идиопатический характер.
По данным Европейского общества кардиологов, во Франции ежегодно регистрируют до 100 тыс. случаев ТЭЛА, в Англии и Шотландии — 5 тыс., в Италии — 60 тыс., а в США — около 650 тыс. [15]. К сожалению, в Украине на сегодняшний день нет такой статистики, но, без сомнения, реальное количество диагностируемых тромбоэмболий в нашей стране намного меньше. Вероятная частота ТЭЛА в Украине составляет примерно 50 тыс. случаев в год, в т.ч. с летальным исходом — более 10 тыс. В Украине ТЭЛА осложняет 0,1–0,3 % хирургических оперативных вмешательств и диагностируется в 12 % всех случаев аутопсий, а у больных пожилого и старческого возраста по причине сердечно-сосудистых заболеваний — более чем в 20 % случаев. Среди госпитализированных пациентов 70 % приходится на долю терапевтических больных [15]. Распространенность ТЭЛА у умерших пациентов в больницах составляет примерно 12–15 %, по данным аутопсий, и этот показатель остается стабильным на протяжении, по крайней мере, последних четырех десятилетий. При этом своевременное лечение ТЭЛА может быть очень эффективным. Именно поэтому более чем 90 % больных, умерших от ТЭЛА, относятся к тем, у кого не был установлен правильный диагноз и, соответственно, кому не было назначено адекватное лечение. По данным Фремингемского исследования, ТЭЛА составляет 15,6 % от всей внутригоспитальной летальности, причем на хирургических больных приходилось 18 %, а 82 % составили больные с терапевтической патологией. A. Planes с сотрудниками (1996) указывают, что ТЭЛА является причиной 5 % летальных исходов после общехирургических и 23,7 % — после ортопедических операций. Легочная эмболия занимает одно из ведущих мест в акушерской практике: смертность от этого осложнения колеблется от 1,5 до 2,7 % на 10 000 родов, а в структуре материнской смертности составляет 2,8–9,2 %. Среди пациентов терапевтического профиля наиболее часто ТЭЛА развивается при инсульте (56 %), инфаркте миокарда (22 %), острых терапевтических заболеваниях (16 %), новообразованиях (15 %), а также у лиц преклонного возраста (9 %) [15]. При общей хирургической патологии частота тромбоза глубоких вен составляет 32 %, при переломах головки бедренной кости — 45 %, множественных травмах — 50 %, при гинекологических операциях по поводу злокачественных образований — 22 %, доброкачественных — 14 %. При наличии тромбоза глубоких вен нижних конечностей риск ТЭЛА составляет не менее 5–10 %. Венозный тромбоз, выявляемый методами радиометрии с фибриногеном, меченным 125I, и флебографии, диагностируется при инфаркте миокарда у 5–20 % больных, инсульте — у 60–70 %, заболеваниях внутренних органов — у 10–15 %, после ортопедических операций — у 50–75 %, простатэктомии — у 40 %, в абдоминальной и торакальной хирургии — у 30 % пациентов. По данным Европейского общества кардиологов, прижизненно ТЭЛА диагностируют приблизительно в 25 % случаев. Уровень смертности при нелеченной ТЭЛА достигает 30 %, но проведение адекватной антикоагулянтной терапии позволяет снизить эти цифры до 2–8 % [13]. Вероятность рецидивов ТЭЛА у нелеченных больных составляет около 50 %, половина из которых также имеет неблагоприятный прогноз. Примерно у трети больных, перенесших венозную тромбоэмболию, в течение 10 лет развиваются рецидивы заболевания (J.A. Heit, 2002). Каждый пятый из умерших от ТЭЛА больных погиб в течение первого часа от начала заболевания, не дождавшись какой-либо медицинской помощи (J.A. Heit, 2002).
В большинстве случаев (70–90 %) причиной развития ТЭЛА является ТГВ. Значительно реже (3–10 %) источники ТЭЛА локализуются в верхней полой вене и ее притоках, а также в полостях правого сердца. Кроме того, причиной ТЭЛА бывают тромбы с локализацией в правом предсердии при условии его дилатации или мерцательной аритмии.
В последнее время появились сообщения об учащении случаев ТЭЛА из бассейна верхней полой вены (до 3,5 %) в результате постановки венозных катетеров в отделениях реанимации и блоках интенсивной терапии. Тромбофлебиты поверхностных вен почти никогда не осложняются ТЭЛА! ТГВ обычно развивается в сосудах нижних конечностей в условиях замедления кровотока, повышения свертываемости крови либо повреждения сосудистой стенки. ТЭЛА, как правило, обусловлена эмболизацией тромбов из проксимальных вен нижних или, гораздо реже, верхних конечностей. Установлено, что 20 % ТГВ голени распространяются проксимально и без лечения могут привести к развитию ТЭЛА. Более активное применение постоянных катетеров и других инвазивных процедур привело к тому, что ТГВ верхних конечностей стали более частым явлением, а их доля в возникновении ТЭЛА возросла до 40 % случаев. Размеры тромбоэмболов определяют их локализацию в сосудах легочной артерии, обычно они фиксируются в местах деления сосудов легкого. По данным различных авторов, эмболизация ствола и главных ветвей легочной артерии имеет место в 50 %, долевых и сегментарных — в 22 %, мелких ветвей — в 30 % случаев. Одновременное поражение артерий обоих легких достигает 65 % всех случаев ТЭЛА, в 20 % — поражается только правое, в 10 % — только левое легкое, нижние доли поражаются в 4 раза чаще, чем верхние доли [15]. Первичный тромботический процесс может локализоваться в глубоких венах голени (венозные синусы камбаловидной мышцы, передняя и задняя большеберцовые вены), бедра и таза (подвздошные вены). При тромбозе подвздошно-бедренного венозного сегмента риск ТЭЛА составляет 40–50 %, вен голени — 1–5 %. Наибольшую угрозу представляют так называемые флотирующие тромбы, которые имеют единственную точку фиксации в дистальном отделе, а длина их иногда достигает 15–20 см. Возникновение флотирующих тромбов часто обусловлено распространением процесса из вен небольшого калибра в крупные вены. При окклюзивном флеботромбозе флотирующая верхушка тромба может стать потенциальным эмболом. Важно отметить, что при наличии флотирующего тромба клинические проявления отсутствуют, так как сохраняется кровоток в пораженной вене. Около 70 % случаев ТЭЛА связаны с наличием флотирующего тромба в глубоких венах илеофеморального сегмента. Оторвавшись от венозной стенки у места образования, тромбы с потоком крови переносятся к ЛА. Локализация тромбо-эмболов в сосудистом русле легких во многом зависит от их размеров. Обычно эмболы задерживаются в местах деления артерий, вызывая частичную или, реже, полную окклюзию дистальных ветвей. Существенную роль в развитии ВТЭ имеют факторы риска, которые способствуют реализации триады Вирхова — повреждение стенки вены, венозный стаз, гиперкоагуляция.
 Факторы риска венозного тромбоэмболизма, и ТЭЛА в частности, многообразны: пожилой возраст, длительная обездвиженность (вследствие паралича конечностей, после травм, в послеоперационном периоде, при частых и продолжительных перелетах в самолетах или поездках в автомобилях и т.д.), онкологические заболевания (рис. 1), травмы (особенно переломы крупных костей), хирургические вмешательства (оперативные вмешательства на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно при наличии гнойно-септических осложнений и внутрисосудистых инвазивных манипуляций (подключичный катетер и др.), прием некоторых лекарственных препаратов (заместительная гормональная терапия (ЗГТ), использование оральных контрацептивов, химиотерапия), хроническая сердечная или дыхательная недостаточность, беременность и послеродовой период (риск ВТЭ повышается в 5 раз), тромбофилия, гепарин-индуцированная тромбоцитопения, лечение диуретиками, нефротический синдром, системная красная волчанка, пароксизмальная ночная гемоглобинурия, варикозное расширение вен нижних конечностей, ожирение, сепсис. Ключевыми предрасполагающими факторами ВТЭ со стороны пациента являются: тромбофилические расстройства (например, резистентность к активированному протеину С, антифосфолипидный синдром). Частота тромбофилии у больных с ТГВ составляет около 8 %. Ее клиническими признаками являются: эпизод идиопатического ТГВ без видимых факторов риска; семейный тромбоэмболический анамнез (1–2 случая во II поколении, чаще наследование по аутосомно-доминантному типу); ТГВ у лиц моложе 50 лет; атипичная локализация венозных тромбозов (мезентериальные, каротидные, церебральные сосуды); ранние инфаркт миокарда и инсульт; рецидивирующие тромбозы. Кроме того, к факторам риска относят наличие ВТЭ в анамнезе, возраст старше 65 лет, беременность, прием эстрогенных препаратов (заместительная гормональная терапия после менопаузы приводит к повышению риска тромбозов и эмболии в 3 раза). Интересно отметить, что в
Факторы риска венозного тромбоэмболизма, и ТЭЛА в частности, многообразны: пожилой возраст, длительная обездвиженность (вследствие паралича конечностей, после травм, в послеоперационном периоде, при частых и продолжительных перелетах в самолетах или поездках в автомобилях и т.д.), онкологические заболевания (рис. 1), травмы (особенно переломы крупных костей), хирургические вмешательства (оперативные вмешательства на матке, яичниках, предстательной железе, мочевом пузыре, желудке, толстой кишке и т.д.), особенно при наличии гнойно-септических осложнений и внутрисосудистых инвазивных манипуляций (подключичный катетер и др.), прием некоторых лекарственных препаратов (заместительная гормональная терапия (ЗГТ), использование оральных контрацептивов, химиотерапия), хроническая сердечная или дыхательная недостаточность, беременность и послеродовой период (риск ВТЭ повышается в 5 раз), тромбофилия, гепарин-индуцированная тромбоцитопения, лечение диуретиками, нефротический синдром, системная красная волчанка, пароксизмальная ночная гемоглобинурия, варикозное расширение вен нижних конечностей, ожирение, сепсис. Ключевыми предрасполагающими факторами ВТЭ со стороны пациента являются: тромбофилические расстройства (например, резистентность к активированному протеину С, антифосфолипидный синдром). Частота тромбофилии у больных с ТГВ составляет около 8 %. Ее клиническими признаками являются: эпизод идиопатического ТГВ без видимых факторов риска; семейный тромбоэмболический анамнез (1–2 случая во II поколении, чаще наследование по аутосомно-доминантному типу); ТГВ у лиц моложе 50 лет; атипичная локализация венозных тромбозов (мезентериальные, каротидные, церебральные сосуды); ранние инфаркт миокарда и инсульт; рецидивирующие тромбозы. Кроме того, к факторам риска относят наличие ВТЭ в анамнезе, возраст старше 65 лет, беременность, прием эстрогенных препаратов (заместительная гормональная терапия после менопаузы приводит к повышению риска тромбозов и эмболии в 3 раза). Интересно отметить, что в
Кроме того, на сегодня доказано, что влияние прогестерона на сердечно-сосудистую систему также зависит от вида прогестинов и минимально в случае применения синтетических прогестинов и их микронизированных форм. Неудивительно, что в таких развитых странах, как Франция и Италия, ЗГТ назначают преимущественно не гинекологи, а кардиологи. Мы также должны об этом помнить и тщательно взвешивать риски и пользу от применения ЗГТ, прежде всего относительно кардиоваскулярной заболеваемости и смертности. Даже у здоровых людей без каких-либо факторов риска может возникать идиопатическая ТЭЛА. Имеются данные о возникновении ТЭЛА даже у новорожденных. Существует и такое понятие, как тромбоэмболическая болезнь, когда у человека имеются генетически обусловленные нарушения синтеза определенных факторов свертывания (рис. 2).
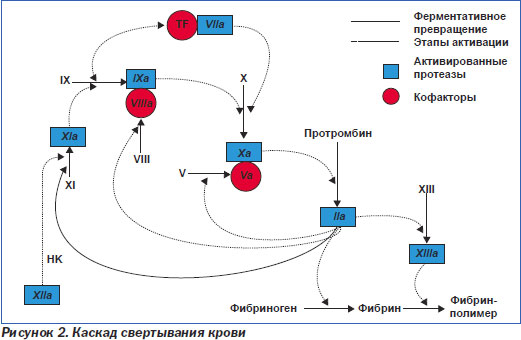
ТЭЛА может развиваться у абсолютно здоровых людей вследствие тромбоза подключичной вены, связанного с длительным вынужденным положением руки, например при продолжительном держании за верхний поручень в транспорте. Причиной ТЭЛА может быть правожелудочковый инфекционный эндокардит, зачастую развивающийся вследствие инвазивных внутрисосудистых процедур, а также у инъекционных наркоманов. У молодых людей к ТЭЛА могут привести воспаление и тромбоз внутренней яремной вены, обусловленные орофарингеальной инфекцией. Имеются данные о том, что ТЭЛА ассоциируется также с такими проблемами, как ожирение, метаболический синдром, артериальная гипертензия, курение, сердечно-сосудистые события (инфаркт миокарда, инсульт). Так, тромбоэмболические осложнения, по данным разных авторов, встречаются у 30–60 % больных с инсультами, обусловившими паралич нижних конечностей, у 5–35 % пациентов после перенесенного инфаркта миокарда, более чем у 12 % лиц с застойной сердечной недостаточностью. Разумеется, серьезным фактором риска является наличие заболеваний вен нижних конечностей в анамнезе, особенно тромбоз глубоких вен, а также вынужденная гиподинамия. Так, при длительности полетов более 6 часов всем пассажирам рекомендуется избегать пережатия одеждой нижних конечностей и развития дегидратации, а при наличии дополнительных факторов риска ТЭЛА — производить профилактическую компрессию ног с помощью медицинских трикотажных изделий или эластичного бинта. Альтернативный метод — однократное введение перед полетом низкомолекулярного гепарина в профилактической дозе. Профилактическое использование ацетилсалициловой кислоты не рекомендуется [15].
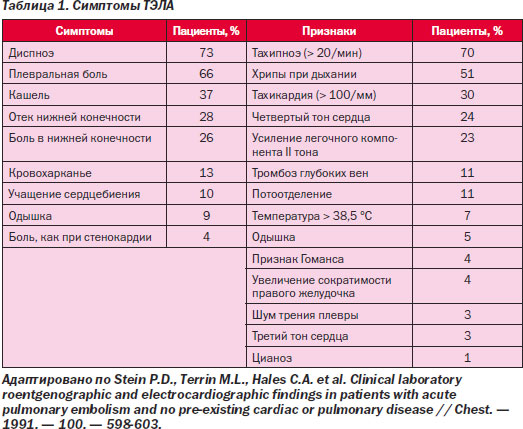
Патогенез ТГВ определяется триадой Вирхова: 1) повреждение эндотелия; 2) замедление венозного кровотока; 3) повышение свертываемости крови (рис. 2) и включает два звена — «механическую» обструкцию легочного сосудистого русла и гуморальные нарушения. Важное значение имеют реакции легких и системы кровообращения на сам эмбол и продуцирование им и агрегатами клеток крови биологически активных веществ (БАВ) — серотонина, гистамина, простагландинов, эйкозаноидов. В ответ на это возникает генерализованный артериолоспазм в малом кругу кровообращения и коллапс сосудов большого круга. Клиническими признаками этого является повышение давления в легочной артерии на фоне снижения системного АД. Непосредственной реакцией на БАВ является формирование бронхилоспазма — рефлекс Эйлера — Лильестранда, который приводит к ДН обструктивного типа. Распространенная тромбоэмболическая окклюзия артериального русла легких ведет к увеличению легочного сосудистого сопротивления, что препятствует выбросу крови из правого желудочка и недостаточному наполнению левого желудочка, развивается легочная гипертензия, острая правожелудочковая недостаточность и тахикардия, снижаются сердечный выброс и АД. Это становится причиной коллаптоидного состояния, уменьшения коронарного кровотока, что может проявиться тяжелой ишемией миокарда, вплоть до возникновения фибрилляции желудочков [9]. Клиническая картина ТЭЛА определяется количеством и калибром обтурированных легочных сосудов, темпами развития эмболического процесса и степенью возникших при этом гемодинамических расстройств. В большинстве случаев имеет место множественная окклюзия нескольких ветвей легочной артерии разного калибра, часто двусторонняя (немассивная ТЭЛА). В более редких случаях происходит массивная тромбоэмболия главных ветвей или ствола легочной артерии. При субмассивной ТЭЛА эмболизируются долевые и сегментарные ветви легочной артерии. В Рекомендациях Европейского общества кардиологов по ТЭЛА (2008) термины «массивная», «субмассивная» и «немассивная» ТЭЛА признаны «вводящими в заблуждение», некорректными. Авторы документа предлагают использовать стратификацию больных на группы высокого и невысокого риска, а среди последних выделять подгруппы умеренного и низкого риска. Высоким риском считается риск ранней смерти (смерти в стационаре или в течение 30 суток после ТЭЛА), превышающий 15 %; умеренным — до 15 %; низким — менее 1 %. Для определения риска Европейское общество кардиологов рекомендует ориентироваться на три группы маркеров — клинические маркеры, маркеры дисфункции ПЖ и маркеры повреждения миокарда. Во многих исследованиях показано, что примерно в 90 % случаев симптоматические ТЭЛА манифестируют с диспноэ, болью в груди или синкопе (P.D. Stein et al., 1991; P.D. Stein et al., 1991; The PIOPED Investigators, 1990; M. Meignan et al., 2000; J.H. Ryu et al., 1998). Безусловно, у всех больных с такой манифестацией заболевания опытный клиницист должен проводить дифференциальную диагностику ТЭЛА. Однако все три симптома (диспноэ, боли в груди, синкопе) имеют низкую специфичность, что и ведет к большому количеству диагностических ошибок. Клиника ТЭЛА включает широкий диапазон состояний: от почти бессимптомного течения до внезапной смерти. В качестве классических вариантов течения заболевания в клинике ТЭЛА выделяют пять клинических синдромов (табл. 1).
1. Легочно-плевральный — «пепельный» оттенок кожных покровов, при массивной ТЭЛА — выраженный «чугунный» цианоз области шеи и верхней половины туловища, бронхоспазм, диспноэ — возникает внезапно в состоянии покоя, имеет инспираторный характер (ортопноэ не характерно!), кашель, кровохарканье, притупление перкуторного звука, усиление голосового дрожания, влажные хрипы, крепитация, шум трения плевры, боль в грудной клетке плеврального характера, плевральный выпот — при инфаркте легких и инфарктной пневмонии, повышение температуры тела, рентгенологические изменения.
2. Кардиальный — кардиалгия с загрудинной локализацией, тахикардия, гипотензия (коллапс, шок), набухание и/или пульсация вен шеи, «бледный» цианоз, расширение правой границы сердца, систолический шум над мечевидным отростком или в IV межреберье по левому краю грудины, акцент II тона над ЛА, правожелудочковый «ритм галопа» в V межреберье по левому краю грудины, повышение ЦВД, ЭКГ-признак Мак-Джина — Уайта — QIII–TIII–SI, правограмма, острая блокада правой ножки пучка Гиса, перегрузка правых отделов сердца (P-pulmonale).
3. Абдоминальный — боль и/или тяжесть в правом подреберье.
4. Церебральный — синкопальные состояния, судороги, рвота, кома вследствие гипоксии головного мозга.
5. Почечный — олиго-, анурия (шоковая почка).
Обычно ТЭЛА манифестирует одним из трех клинических вариантов:
1. Внезапная одышка неизвестного генеза — если обнаруживаются тахипноэ, тахикардия при отсутствии патологии со стороны дыхательной системы, признаки острой правожелудочковой недостаточности при этом отсутствуют.
2. Острое легочное сердце — если есть признаки острой правожелудочковой недостаточности, артериальная гипотензия, тахипноэ, тахикардия.
3. Инфаркт легкого — клинический вариант течения ТЭЛА. Возникает в 10–30 % случаев ТЭЛА и чаще наблюдается при сопутствующих застойной сердечной недостаточности, митральном стенозе, ХОБЛ, пневмонии. Клинически у больных инфарктом легкого возникают боли в грудной клетке, кровохарканье, одышка, тахикардия, крепитация, влажные хрипы над соответствующим участком легкого, повышается температура тела. Боль в грудной клетке появляется на 2-е—3-и сутки после развития ТЭЛА, она обусловлена реактивным плевритом над некротизированным участком легкого, усиливается в случае глубокого дыхания, кашля, при наклонах туловища. В случае разрешения фибринозного плеврита или накопления жидкости в плевральной полости боль в грудной клетке уменьшается или исчезает. При вовлечении в патологический процесс диафрагмальной плевры могут наблюдаться симптомы «острого живота». Кровохарканье при инфаркте легкого возникает на 2-е—3-и сутки у 10–56 % больных, преимущественно в небольшом количестве, продолжается от нескольких дней до 2–4 недель. Гипертермию, как правило, регистрируют с 1–2-го дня заболевания, она длится от нескольких дней до 1–3 недель, с субфебрилитетом, в случае развития инфаркт-пневмонии — до 39 °С. Притупление перкуторного звука, усиление голосового дрожания, влажные хрипы и крепитация наблюдаются лишь при массивных инфарктах легкого и инфаркт-пневмониях.
В последние годы в Европе нередко используется так называемая Женевская шкала (G. le Gal et al., 2006):
— возраст > 65 лет — 1 балл.
Важной задачей клинического и инструментального исследования больных ТЭЛА является установление источника тромбоэмболии. Однако отчетливые признаки тромбоза глубоких вен нижних конечностей — наиболее частой причины ТЭЛА — обнаруживают лишь в 1/3 случаев. К числу ранних признаков флеботромбоза глубоких вен относятся: спонтанные боли в области стопы и голени, усиливающиеся при ходьбе, появление боли в икроножных мышцах при тыльном сгибании стопы (симптом Хоманса), локальная болезненность при пальпации по ходу вен, односторонний отек голени, стопы и бедра, выявляемый при осмотре в горизонтальном и вертикальном положении пациента. Рецидивирующее течение ТЭЛА отмечают у 9,4–34,6 % больных с ТЭЛА. Риск рецидива в 2,5 раза выше у мужчин и в 2 раза выше у женщин, принимающих гормональные контрацептивы, и у пациентов с идиопатической формой заболевания. Рецидивирующее течение ТЭЛА может манифестировать (В.Б. Яковлев):
Диагностика
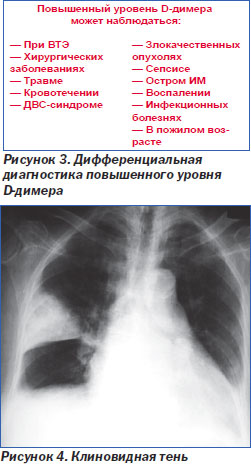
1. Определение D-димера в плазме крови. Метод характеризуется высокой чувствительностью (96–99 %), но низкой специфичностью (50 %). Этот метод обследования имеет высокую отрицательную диагностическую ценность, то есть позволяет достоверно исключить у пациента ТЭЛА при нормальном содержании D-димера (< 500 мкг/л) (I, A) [30]. Однако повышенный уровень D-димера неспецифичен для ТЭЛА (может быть обусловлен и другими причинами — сепсисом, острым ИМ, злокачественными новобразованиями, воспалением, оперативными вмешательствами, некоторыми системными заболеваниями, беременностью (рис. 3), поэтому положительная диагностическая ценность этого метода невысока (III, C), и в этом случае больному требуется дообследование для подтверждения наличия тромба в легочных сосудах.
 Несмотря на это, такой алгоритм позволяет на этом этапе исключить ТЭЛА без дальнейшего обследования у трети больных, поэтому определение D-димера имеет большое значение для сортировки пациентов с подозрением на тромбоэмболию.
Несмотря на это, такой алгоритм позволяет на этом этапе исключить ТЭЛА без дальнейшего обследования у трети больных, поэтому определение D-димера имеет большое значение для сортировки пациентов с подозрением на тромбоэмболию.
У многих пациентов после перенесенной ТЭЛА уровень D-димера остается повышенным в течение нескольких месяцев, несмотря на антикоагулянтную терапию [15]. Поэтому при рецидивирующей ТЭЛА повышение уровня D-димера не является маркером повторного тромбообразования, хотя нормальные значения показателя позволяют исключить рецидив заболевания (чувствительность около 100 %).
2. Электрокардиография. ЭКГ-признаки ТЭЛА: в 60–70 % случаев на ЭКГ регистрируется появление «триады» — S1–Q3–T3 (отрицательный зубец) — синдром Мак-Джина — Уайта: появление зубца Q в III отведении, одновременное увеличение амплитуды зубца S в I отведении и отрицательного зубца T в III отведении. Появляются отрицательные симметричные зубцы Т в отведениях V1–V3, подъем сегмента ST в отведениях III, aVF, aVR и V1–V3, блокада правой ножки пучка Гиса, P-pulmonale, смещение переходной зоны влево к отведениям V5–V6, синусовая тахикардия и/или другие нарушения ритма (фибрилляция/трепетание предсердий, экстрасистолия). Важно отметить, что у 20–25 % больных с ТЭЛА изменения на ЭКГ могут отсутствовать. Характерна быстрая динамика ЭКГ, уже через 48 часов ЭКГ принимает исходную форму. Указанные ЭКГ-признаки не являются строго специфичными для ТЭЛА, они могут регистрироваться при заболеваниях, сопровождающихся острой гемодинамической перегрузкой ПЖ [13, 15, 21].
3. Рентгенография грудной клетки. Рентгенографические признаки ТЭЛА, которые были описаны Fleichner, непостоянны и малоспецифичны:
I. Высокое и малоподвижное стояние купола диафрагмы в области поражения легкого имеет место в 40 % случаев и возникает вследствие уменьшения легочного объема в результате появления ателектазов и воспалительных инфильтратов.
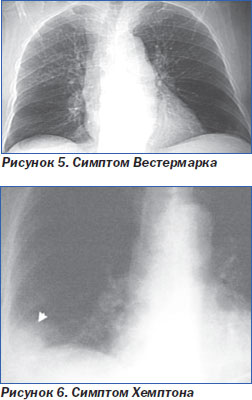 II. Обеднение легочного рисунка (симптом Вестермарка) — специфичный, но относительно редкий признак ТЭЛА (5 % случаев) (рис. 5).
II. Обеднение легочного рисунка (симптом Вестермарка) — специфичный, но относительно редкий признак ТЭЛА (5 % случаев) (рис. 5).
III. Дисковидные ателектазы.
IV. Инфильтраты легочной ткани — характерно для инфарктной пневмонии.
V. Симптом Хемптона — клиновидная тень в легочном поле, основанием обращенная к плевре (рис. 4, 6).
VI. Расширение тени верхней полой вены вследствие повышения давления наполнения правых отделов сердца.
VII. Выбухание второй дуги (легочного конуса) по левому контуру сердечной тени [13].
4. Эхокардиография. ЭхоКГ предпочтительна как один из первоочередных методов диагностики для пациентов высокого риска. Как и уровень D-димера у больных невысокого риска, ЭхоКГ выполняет роль «сортировочного» метода обследования: она не дает возможности подтвердить диагноз ТЭЛА, однако достоверно позволяет исключить ее и своевременно направить диагностический поиск в другом направлении. Однако у нестабильных пациентов высокого риска, которым невозможно подтвердить диагноз такими методами обследования, как КТ или вентиляционно-перфузионная сцинтиграфия, положительные результаты ЭхоКГ могут расцениваться как непрямое доказательство ТЭЛА и позволяют немедленно начать специфическое лечение (I, C); но после стабилизации пациента следует все же дообследовать его для окончательного подтверждения диагноза. У больных невысокого риска ЭхоКГ также широко используется: она играет важную роль в дифференциальной диагностике и стратификации риска. Исследование дает возможность обнаружить признаки перегрузки правых отделов сердца, возможную патологию клапанов или миокарда, иногда — визуализировать тромб в полости сердца. Однако рутинное использование ЭхоКГ у гемодинамически стабильных, нормотензивных пациентов невысокого риска не рекомендуется (III, C). Если это возможно, у некоторых больных рекомендуется проведение трансэзофагеальной ЭхоКГ, которая позволяет непосредственно визуализировать тромбы в легочных сосудах.
ЭхоКГ-признаками ТЭЛА являются:
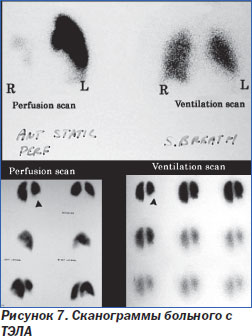
5. Вентиляционно-перфузионная сцинтиграфия с использованием меченых микроагрегатов альбумина преимущественно используется тогда, когда противопоказана КТ. Наиболее достоверный признак ТЭЛА — наличие выраженного локального снижения перфузии участка легкого при отсутствии здесь сколько-нибудь значительных вентиляционных расстройств и изменений на обычной рентгенограмме [13]. При негативных результатах сцинтиграфии у пациентов с низкой вероятностью ТЭЛА можно исключить диагноз тромбоэмболии (I, A). Положительные результаты сканирования у пациентов с высокой вероятностью ТЭЛА подтверждают диагноз, но у пациентов с низкой вероятностью ТЭЛА для уточнения диагноза могут потребоваться дополнительные методы обследования (IIb, B) (рис. 7) [30].
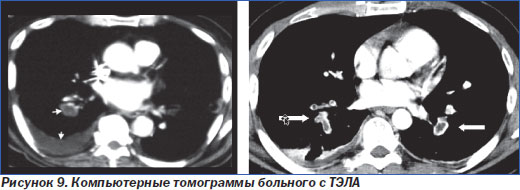
7. Спиральная компьютерная томография (рис. 9) с внутривенным введением рентгеноконтрастного препарата на сегодняшний день признана экспертами Европейского общества кардиологов наиболее приемлемым методом подтверждения наличия тромба в легочных сосудах, рекомендованным для рутинной клинической практики. У больных высокого риска достаточно обычной (однодетекторной) КТ, чтобы подтвердить или исключить ТЭЛА (I, C), однако у больных невысокого риска рекомендуется использовать мультидетекторную КТ — она позволяет более четко визуализировать сегментарные и субсегментарные ветви легочной артерии и достоверно подтвердить или исключить ТЭЛА (I, A).
 Если мультидетекторную КТ нет возможности использовать, у таких пациентов либо устанавливается диагноз ТЭЛА при положительных результатах однодетекторной КТ (I, A), либо требуется двойной контроль для исключения ТЭЛА — негативные результаты однодетекторной КТ сопоставляются с данными венозной компрессионной ультрасонографии, и если оба метода обследования не обнаружат тромбов, только тогда диагноз ТЭЛА можно снять (I, A) [30]. Чувствительность КТ — 100 %, специфичность — 96 %, а отрицательная предсказательная ценность — 99 %. Если раньше считали, что КТ полезна только для диагностики тромбоэмболии центральных и долевых артерий, то с помощью мультидатчиков последних поколений можно выявлять структуры размером от
Если мультидетекторную КТ нет возможности использовать, у таких пациентов либо устанавливается диагноз ТЭЛА при положительных результатах однодетекторной КТ (I, A), либо требуется двойной контроль для исключения ТЭЛА — негативные результаты однодетекторной КТ сопоставляются с данными венозной компрессионной ультрасонографии, и если оба метода обследования не обнаружат тромбов, только тогда диагноз ТЭЛА можно снять (I, A) [30]. Чувствительность КТ — 100 %, специфичность — 96 %, а отрицательная предсказательная ценность — 99 %. Если раньше считали, что КТ полезна только для диагностики тромбоэмболии центральных и долевых артерий, то с помощью мультидатчиков последних поколений можно выявлять структуры размером от
8. Магнитно-резонансная ангиография. Этот метод имеет ряд преимуществ перед ангиографией и КТ: обеспечивает лучшую визуализацию сосудов, проводится без облучения пациентов и введения контрастного вещества, практически не вызывает осложнений, позволяет оценить размеры и функцию желудочков сердца [15].
9. Венозная компрессионная ультрасонография позволяет обнаружить тромбоз глубоких вен нижних конечностей и тем самым подтвердить ТЭЛА в случае ложноотрицательных результатов, которые могут быть получены при однодетекторной КТ. Этот метод обследования показан также в тех случаях, когда пациентам не может быть проведена КТ, ангиография или другие методы визуализации тромба в легочных артериях, — характерная клиника ТЭЛА в сочетании с подтвержденным источником тромбов в проксимальных отделах глубоких вен нижних конечностей позволяет диагностировать ТЭЛА (I, B). Однако наличие тромбов в дистальных отделах глубоких вен нижних конечностей требует дополнительных методов обследования для подтверждения диагноза ТЭЛА (IIa, B) [30].
10. Рентгеноконтрастная флебография является эталоном диагностики венозного тромбоза и редко вызывает осложнения. Ее используют при сомнительных результатах неинвазивных исследований вен нижних конечностей, а также при распространении тромбоза выше проекции паховой связки, когда точному определению локализации верхушки тромба с помощью ультразвукового ангиосканирования препятствует наличие газа в кишечнике. Чувствительность и специфичность метода приближаются к 100 % [15].
Дифференциальная диагностика ТЭЛА:
Подготовили:
1. Александер Дж.К. Тромбоэмболия легочной артерии: Руководство по медицине. Диагностика и терапия: В 2 т. / Под ред. Р. Беркоу, Э. Флетчера: Пер. с англ. — М.: Мир, 1997. — 1. — 460-5.
2. Guidelines for the management of suspected acute pulmonary еmbolism. British Thoracic Society Standads of Care Committee Pulmonary Embolism Guideline Development Group // Thorax. — 2003. — 58(6). — 470-83.
3. Fraisse F., Holzapfel L., Coulaud J.-M. et al. Nadroparin in the prevention of deep vein thrombosis in acute decompensated COPD // Am. J. Respir Cnt Care Med. — 2000. — 161. — 1109-14.
4. Ferrari E., Baudouy M., Cerboni P. et al. Clinical epidemiology of venous thromboembolic disease. Results of a French Multicentre Registry // Eur. Heart J. — 1997. — 18. — 685-691.
5. Гагарина Н.В., Синицын В.Е., Веселова Т.Н., Терновой С.К. Современные методы диагностики тромбоэмболии легочной артерии // Кардиология. — 2003. — 5. — 77-81.
6. Heit J.A. Venous thromboembolism epidemiology: implications for prevention and management. Semin. Thromb. Hemost. 2002. — 28 (suppl 238). Pulmonary Embolism — New Paradigms in Diagnosis and Therapy // Chest. — 2001. — Vol. 120. — P. 1556-1561 : 3-13
7. Kearon C., Salzman E.W., Hirsh J. Epidemiology, pathogenesis, and natural history of venous thrombosis / George J.N., ed. Hemostasis and Thrombosis. Basic Principles and Clinical Practice. 4th ed.
8. Kucher N., Goldhaber S.Z. Cardiac biomarkers for risk stratification of patients with acute pulmonary embolism // Circulation. — 2003. — 108. — 2191-2194.
9. Лекції з госпітальної хірургії / За ред. В.Г. Мішалова. — К., 2007. — Т. 1. — С. 24-50.
10. Martin J.F. Autopsy proven pulmonary embolism in hospital patients: are we detecting enough deep vein thrombosis? // J. R. Soc. Med. — 1989. — 82. — 203-5.
11. Pineo G.F., Hull R.D. Heparin and low-molecular-weight heparin in the treatment of venous thromboembolism // Baillieres Clin. Haematol. — 1998. — 11. — 621-637.
12. Rodger M., Wells P.S. Diagnosis of Pulmonary Embolism // Thromb. Res. — 2001. — Vol. 103. — P. 225-238.
13. Ройтберг Г.Е., Струтынский А.В. Внутренние болезни. Сердечно-сосудистая система. — М.: БИНОМ, 2007. — С. 839-856.
14. Roy P.M.,
15. Руководство по кардиологии / Под ред. В.Н. Коваленко. — К.: Морион, 2008. — С. 850-892.
16. Савельев В.С. Роль хирурга в профилактике и лечении венозного тромбоза и легочной эмболии: 50 лекций по хирургии. — М.: Медиа Медика, 2003; 92-9.
17. Samama M.M., Cohen A.T., Darmon J.-Y. et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients // N. Engl. J. Med. — 1999. — 341. — 793-800.
18. Segal J.B., EngJ., Tamariz L.J., Bass E.B. Review of the evidence on diagnosis of deep venous thrombosis and pulmonary embolism // Ann. Fam. Med. — 2007. — 5. — 63-73.
19. Segal J.B., Streiff M.B., Hoffman L.V. et al. Management of venous thromboembolism: a systematic review for a practice guideline // Ann. Intern. Med. — 2007. — 146. — 211-22.
20. Snow V., Qaseem A., Barry P. et al. and the Joint American Academy of Family Physicians / American College of Physicians Panel on Deep Venous Thrombosis/Pulmonary Embolism. Management of Venous Thromboembolism: A Clinical Practice Guideline from the
21. Справочник по кардиологии / Под ред. В.И. Целуйко. — К., 2009. — С. 217-222.
22. Tapson V.F. Acute Pulmonary Embolism //
23. Task Force Report. Guidelines on diagnosis and management of acute pulmonary embolism. European Society of Cardiology // Europ. Heart J. — 2000. — Vol. 21. — P. 1301-1336.
24. Thromboembolic Risk Factors (THRIFT) Consensus Group Risk of and prophylaxis for venous thromboembolism in hospital patients // BMJ. — 1992. — 305. — 567-74.
25. Torbicki A., Perrier A., Konstantinides S. et al. Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) // European Heart Journal. — 2008. — 29(18). — 2276-2315.
26. Torbicki A., Van Beek E.J.R., Charbonnier B. et al. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force on Pulmonary Embolism, European Society of Cardiology // European Heart Journal. — 2000. — 21. — 1301-1336.
27. Van Erkel A.R., Van Rossum A.B., Bloem J.L. et al.
28. Wells P.S.,
29. Яковлев В.Б., Яковлева М.В. Тромбоэмболия легочной артерии: патофизиология, диагностика, лечебная тактика // Consilium Medicum. — 2005. — № 6. — C. 493-499.
30. Рекомендации Европейского общества кардиологов по лечению тромбоэмболии легочной артерии. — 2008.
