Газета «Новости медицины и фармации» 9(325) 2010
Вернуться к номеру
Фитогепатопатии. Наблюдение и обзор литературы
Авторы: В.В. Василенко, С.Е. Тимофеев, Н.И. Фролова. ММА им. Сеченова, г. Москва
Версия для печати
 Женщина 43 лет, бухгалтер. Не курит, алкогольные напитки, по ее утверждению, употребляет 1–2 раза в месяц в количестве не более 250 мл вина. Считая себя практически здоровой, в течение последних 5 лет к врачам не обращалась, не принимала лекарств и биологически активных добавок. Отмечает аллергические реакции в виде крапивницы на некоторые средства парафармацевтики. Мать пациентки страдала бронхиальной астмой.
Женщина 43 лет, бухгалтер. Не курит, алкогольные напитки, по ее утверждению, употребляет 1–2 раза в месяц в количестве не более 250 мл вина. Считая себя практически здоровой, в течение последних 5 лет к врачам не обращалась, не принимала лекарств и биологически активных добавок. Отмечает аллергические реакции в виде крапивницы на некоторые средства парафармацевтики. Мать пациентки страдала бронхиальной астмой.
В возрасте 20 лет перенесла радикальную экстирпацию матки по поводу цистаденокарциномы. После операции в течение двух лет осуществлялась химиотерапия. Заместительная гормональная терапия не проводилась и не проводится.
17.06.2009 г., через 3 дня после пищевого эксцесса, появились неинтенсивные, не иррадиирующие боли, локализованные в левой подвздошной области, и общая слабость. Пациентка обратилась к врачу, было проведено разностороннее обследование, которое затем повторялось. На 20.06.2009 г. обнаружено повышение γ-ГТП до 79 Ед/л (при верхней границе нормы 32), АлАТ до 37 Ед/л (при лабораторной норме до 31). HbsAg и HCVAb отрицательны. Определение α-амилазы (диастазы) в моче и в крови не обнаруживало отклонений от референсных значений.
За период болезни был повторно проведен также ряд других исследований, показавших нормальные результаты: трижды — общеклинический анализ крови с лейкоцитарной формулой и СОЭ, определение общего белка и фракций α1-, α2-, β- и γ-глобулинов, глюкозы, мочевины и креатинина, электролитов (K, Na, Cl); дважды — тиреотропного гормона.
Пациентке был установлен диагноз панкреатита и назначено соответствующее лечение, однако строгое соблюдение в течение двух месяцев панкреатической диеты (№ 5п) и приема панкреатических ферментов и спазмолитиков самочувствия больной не улучшило.
18.08.2009 г. проведена компьютерная томография брюшной полости с пероральным и внутривенным контрастированием. Получено следующее заключение: «КТ-признаки панкреатита с формированием единичных псевдокист головки и тела и остаточными проявлениями перипанкреатита. КТ-признаки очагового стеатоза S4b сегмента левой доли печени; гемохроматоза печени, вероятнее на фоне приема препаратов железа (требует уточнения!). Значимый перегиб шейки и протока желчного пузыря с КТ-признаками гипокинезии, застоя желчи, хронического холецистита. Рекомендован КТ-контроль через 3 месяца».
Встревоженная результатами КТ, пациентка обратилась к нам за помощью в конце августа 2009 г. При обращении имелись жалобы на периодические боли в правом подреберье и более продолжительные в левой подвздошной и боковой областях, несколько усиливающиеся при наклонах влево и положении лежа на левом боку.
При расспросе выяснилось, что пациентка ежегодно на протяжении 22 лет «для профилактики рака» в течение месяца осенью пила настой сухой травы чистотела, которую приобретала на рынках. Летом 2009 г. начала заготавливать траву чистотела самостоятельно. Способ приготовления настоя: 1 ст. л. свежевысушенного измельченного сырья на 1 стакан кипятка настаивается сутки. Курс приема настоя по 1/2 стакана 2 раза в день за 1 час до еды продолжался в течение месяца, дата последнего приема 05.06.2009 г.
Общее состояние удовлетворительное, индекс массы тела 21.5, стабильный. Стул в норме. Глубокая методическая пальпация органов брюшной полости не выявила локальной болезненности и патологических образований; печень не увеличена, с закругленным краем мягко-эластической консистенции. Указание на возможность гемохроматоза обязало нас провести исследование обмена железа (25.08.2009 г.): содержания железа, ферритина и трансферрина в сыворотке крови, латентную железосвязывающую способность сыворотки, % насыщения трансферрина. Было выявлено лишь двукратное повышение ферритина (237 мкг/л при норме для женщин до 120).
Отклонения в биохимических показателях, в том числе и уровня ферритина, трактовали как цитолитический синдром, вызванный приемом внутрь препарата чистотела. Алиментарно-алкогольный эксцесс спровоцировал появление клинической симптоматики. Клиника соответствовала формирующейся билиарной дисфункции преимущественно по панкреатическому типу, закрепляющейся под мощным ятрогенным воздействием и влиянием ипохондрического расстройства. Субъективные проявления гепатита в целом были типичными: астенический, болевой и диспептический синдромы (снижение аппетита, тошнота, непереносимость жирной пищи). Лекарственная терапия была заменена на прием индифферентных безрецептурных средств, разрешено отправиться в отпуск на море. Самочувствие пациентки в течение последующих двух месяцев улучшилось. К декабрю 2009 г. сохраняется эпизодический дискомфорт в брюшной полости, который не беспокоит по ночам и не сказывается на выполнении повседневной работы, как домашней, так и профессиональной.
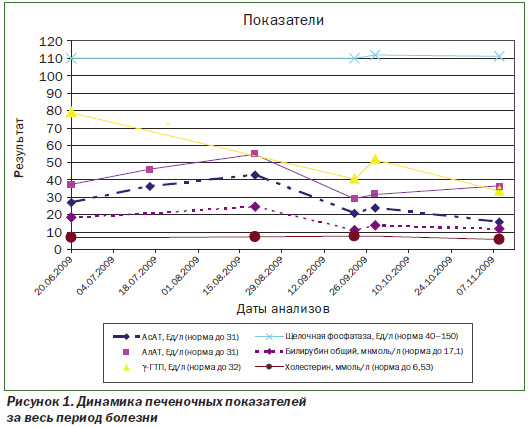
Динамика печеночных показателей за весь период болезни представлена на рис. 1. Концентрация γ-ГТП повышалась максимально в 2,5 раза (при первом определении), АсАТ и АлАТ — в полтора раза (при третьем определении); соотношение АсАТ/АлАТ ≈ 0,73–0,78. Повышение уровня АлАТ по сравнению с АсАТ более специфично для повреждений печени и является очень чувствительным показателем гепатоцеллюлярного некроза [1]. Концентрация билирубина нормальная, однократно превысила верхнюю границу в 1,4 раза. Активность щелочной фосфатазы стабильно нормальная. Уровень холестерина общего менялся несущественно (максимально превысил норму в 1,16 раза) и нормализовался.
Контрольное рентгеновское исследование, как  и было рекомендовано, проведено через три месяца, 03.11.2009 г., высококвалифицированным специалистом. Результаты этого компьютерно-томографического с контрастированием исследования (объемно-динамическая МСКТ) брюшной полости, забрюшинного пространства и органов малого таза таковы: «Печень не увеличена, контур ровный, структура гомогенная. Вне- и внутрипеченочные протоки не расширены. Очаговых изменений в паренхиме печени не обнаружено. Желчный пузырь обычно расположен, нормальной величины, с перетяжкой, без рентгеноконтрастных конкрементов. Поджелудочная железа обычно расположена, нормальной величины и зернистой структуры. Отмечается спаечный процесс между поджелудочной железой и двенадцатиперстной кишкой. В малом тазу матка и яичники не визуализируются, дополнительных объемных образований не выявлено. Других особенностей не выявлено».
и было рекомендовано, проведено через три месяца, 03.11.2009 г., высококвалифицированным специалистом. Результаты этого компьютерно-томографического с контрастированием исследования (объемно-динамическая МСКТ) брюшной полости, забрюшинного пространства и органов малого таза таковы: «Печень не увеличена, контур ровный, структура гомогенная. Вне- и внутрипеченочные протоки не расширены. Очаговых изменений в паренхиме печени не обнаружено. Желчный пузырь обычно расположен, нормальной величины, с перетяжкой, без рентгеноконтрастных конкрементов. Поджелудочная железа обычно расположена, нормальной величины и зернистой структуры. Отмечается спаечный процесс между поджелудочной железой и двенадцатиперстной кишкой. В малом тазу матка и яичники не визуализируются, дополнительных объемных образований не выявлено. Других особенностей не выявлено».
Таким образом, объективного подтверждения повреждения поджелудочной железы получено не было, наличие признаков спаечного процесса можно рассматривать как следствие перенесенной обширной операции с последовавшей химиотерапией. Истинный хронический панкреатит реально наблюдается очень редко. Так, согласно медицинской статистике, в Великобритании он встречается с частотой 3 случая на 100 тыс. населения, причем преимущественно у мужчин 40–50 лет [2]. Данные о наличии гемохроматоза печени также не подтвердились.
Наше наблюдение показывает, что фитогепатопатии могут протекать без симптомов холестаза и встречаются, по-видимому, чаще, чем ранее предполагалось. Расширенное обследование, особенно когда оно недостаточно продумано и не учитывает анамнез, обычно ведет к большим моральным издержкам и материальным затратам, фактически противореча принципу «не навреди».
Интерпретация умеренного (до троекратного) повышения активности аминотрасфераз и гамма-глютамилтранспептидазы сыворотки крови иногда вызывает затруднения. Практически, в отсутствие признаков хронических диффузных заболеваний печени, обычно ответственны за подобные лабораторные отклонения следующие факторы или их сочетание: этанол, лекарства и БАДы, непривычная пища, наличие неалкогольного стеатогепатоза, причем чаще это отмечают у женщин [3, 4]. Целесообразной в подобных случаях представляется тактика выжидательная: клиническое наблюдение и повторение минимума печеночных лабораторных тестов не ранее чем через три месяца [5]; при развитии лекарственного гепатита с аутоиммунным компонентом нормализация показателей может произойти гораздо позже.
Для получения лекарственного сырья используют сухую траву ЧБ (Herba Сhelidonii), которую заготавливают во время цветения растения. Для получения галеновых, фитохимических и полусинтетических средств на основе отдельных алкалоидов, помимо сухой травы, используют корневища с корнями (Rhizoma cum Radicibus Chelidonii), которые заготовляют после окончания цветения растения. В некоторых случаях используют свежевыдавленный или ферментированный сок свежей травы (Succus Chelidonii), который получают в период массового цветения. Наиболее популярным за рубежом гомеопатическим средством на основе чистотела является Greater Celandine.
В Российской Федерации зарегистрировано растительное сырье «Чистотела трава» (Chelidonii herba). Фармакологическая активность ЧБ к настоящему времени изучена довольно полно [6]. Она обусловлена преимущественно алкалоидами хелидонином (основной), гомохелидонином, протопином, сангвиритрином (сумма алкалоидов сангвинарина и хелеретрина). В аптечной сети доступны трава чистотела в коробках, пачках и фильтр-пакетах, ряд гомеопатических препаратов разной степени разведения для лечения преимущественно патологии гепатобилиарной системы, наружные средства парафармацевтики.
В 1896 г. брянский врач Н. Денисенко опубликовал в журнале «Врач» сообщение о нескольких случаях успешного применения вытяжки из ЧБ внутрь и в виде инъекций в опухоль при наружных опухолях (препараты ему поставляла аптечная фирма «Феррейн»). Однако препараты ЧБ не отличались постоянством действия, объяснения этому не находили и постепенно энтузиазм врачей угас [7]. Масштабные исследования лечебных свойств ЧБ сейчас осуществляют в Украине [8]. Проводятся клинические испытания препарата Ukrain (NSC-631570) для приема внутрь с целью лечения злокачественных новообразований разной локализации [9–11].
Свежий документ Всемирной организации здравоохранения [12] рекомендует на упаковках медикаментов на основе ЧБ для приема внутрь писать предупреждение о том, что лекарство может применяться только по назначению врача. Европейская организация, занимающаяся безопасностью косметических средств, также предупреждает о рисках приема препаратов ЧБ внутрь [13]. В 2003 г. CMEC (China National Machinery & Equipment Import & Export Corporation) обязала включать в инструкции к препаратам ЧБ соответствующее предупреждение [14]. Токсичность ЧБ подчеркивается и в современных руководстве по опасным растениям [15] и руководстве по гепатологии [16].
Повышенное внимание к ЧБ возникло после того как J. Benninger и соавт. описали серию из 10 случаев хелидониевого острого гепатита, которые они наблюдали в период с 1997 по 1999 г. [17]. Выраженность гепатита была умеренной, результаты биопсии печени, произведенной в ряде случаев, напоминали таковые при медикаментозном повреждении паренхимы органа по типу холестаза. Пациенты обращались к врачу в связи с изменением цвета кожи и появлением зуда; имело место среднетяжелое течение заболевания с умеренным повышением активности печеночных ферментов в крови; полное выздоровление после отмены препарата через 2–6 месяцев. Показательно, что повторение употребления ЧБ одним из пациентов привело к рецидиву гепатита. Это сообщение является первым детальным описанием гепатотоксичности травы C. majus, использовавшейся, как это ни парадоксально, в качестве гепатопротекторного средства. В сообщении F. Stickel и соавт. также отмечен рецидив гепатита после случайного возобновления приема препарата ЧБ [18]. Затем последовали другие описания случаев гепатита, вызванного употреблением ЧБ [19–27]. В отечественной медицинской литературе мы подобных публикаций не встретили. Отметим, что все случаи гепатита, вызванного употреблением препаратов чистотела, были диагностированы благодаря наличию у пациентов холестатического синдрома (желтуха, кожный зуд).
P. Bergner [28] предположил следующий механизм гепатотоксического эффекта. ЧБ оказывает двойное действие: является холеретиком и холекинетиком. Но его холекинетический эффект значительно снижается при хранении и полностью исчезает через 6 мес., тогда как воздействие на секрецию остается неизменным. Поскольку большая часть препаратов изготавливается из сырья, хранившегося продолжительное время, то индуцирование секреции значительно преобладает над спазмолитическим эффектом. На фоне предполагаемого наличия у пациентов идиосинкразии к активным веществам ЧБ развивается холестатический гепатит. В описанном P. Bergner случае гепатит также рецидивировал после возобновления пациентом приема ЧБ, а первичная биопсия печени выявила умеренное воспаление портальных трактов и очаги умеренного стеатоза, баллонной дистрофии, гиперплазии клеток Купфера.
Следует добавить, что в опытах на первичных культурах гепатоцитов человека, крысы, собаки и обезьяны был установлен гепатотоксический потенциал ЧБ [29]. Растворимые в воде экстракты добавляли к культурам гепатоцитов. Гепатоциты человека, как оказалось, более чувствительны к экстракту C. majus, чем клетки животных; у крысы гепатоцит наименее чувствителен. Это демонстрирует необходимость использования человеческих гепатоцитов для токсикологической оценки возможных негативных эффектов экстрактов растений у людей.
В России сложилось противоречивое положение. В Государственной фармакопее трава чистотела обозначена как наружное противовоспалительное средство [30]. Согласно нормативному документу 1999 г. [31] она должна была отпускаться только по рецепту врача, но в 2005 г. [32] это растительное сырье отнесено к разряду средств безрецептурного отпуска; ЧБ обозначен только как антисептическое средство, а способ применения (наружно, внутрь) не указан.
С ростом популярности траволечения случаи фитогепатита будут наблюдаться чаще, причем эта тенденция повсеместная [33]. Гепатотоксичность особенно характерна для растений, содержащих пирролизидиновые алкалоиды, таких как окопник лекарственный (Symphytum officinale сем. бурачниковых), крестовник плосколистный (Senetio platyphylloides сем. сложноцветных), растения рода кроталария (Crotalaria, сем. бобовых), дубровник, гелиотропы (сем. бурачниковых). Известны случаи массового заболевания гелиотропным гепатитом, или morbus heliotropicus, вследствие употребления в пищу хлеба, изготовленного из зерна с примесью семян сорняка гелиотропа опушенноплодного (Heliotropium ellipticum Ldb.). Токсическое действие растительных пирролизидинов может проявиться даже развитием вено-окклюзивной болезни печени [34].
 Эффективность и безопасность лекарственных растений активно исследуются фармакологами и аспект токсичности широко применяемых растений хорошо известен [35]. Общепринятый взгляд на патогенез индуцированных лечебными средствами повреждений печени предполагает, что некоторые компоненты растения превращаются в гепатотоксичные в процессе метаболизма, осуществляемого главным образом системой P-450 печени (более 50 изоферментов, кодируемых отдельными генами), на них развивается индивидуальная реакция идиосинкразии; определенное значение придают также нарушению целостности мембраны митохондрий, что запускает реакции апоптоза. Медикаментозные гепатопатии развиваются непредсказуемо вследствие индивидуальных особенностей фармакокинетики и не являются дозозависимыми. Так, известна предрасположенность к гепатотоксическому эффекту от применения флуклоксациллина: у обладателей гаплотипа HLA B*5701 риск повреждения печени этим полусинтетическим пенициллином повышен в 80 (!) раз [36]. Сходным образом объясняются гепатотоксические реакции, которые возникают даже на гомеопатические препараты.
Эффективность и безопасность лекарственных растений активно исследуются фармакологами и аспект токсичности широко применяемых растений хорошо известен [35]. Общепринятый взгляд на патогенез индуцированных лечебными средствами повреждений печени предполагает, что некоторые компоненты растения превращаются в гепатотоксичные в процессе метаболизма, осуществляемого главным образом системой P-450 печени (более 50 изоферментов, кодируемых отдельными генами), на них развивается индивидуальная реакция идиосинкразии; определенное значение придают также нарушению целостности мембраны митохондрий, что запускает реакции апоптоза. Медикаментозные гепатопатии развиваются непредсказуемо вследствие индивидуальных особенностей фармакокинетики и не являются дозозависимыми. Так, известна предрасположенность к гепатотоксическому эффекту от применения флуклоксациллина: у обладателей гаплотипа HLA B*5701 риск повреждения печени этим полусинтетическим пенициллином повышен в 80 (!) раз [36]. Сходным образом объясняются гепатотоксические реакции, которые возникают даже на гомеопатические препараты.
Лекарственные гепатопатии чаще встречаются у лиц в возрасте старше 40 лет [37], чаще у женщин [38], чаще при наличии ожирения [39]. Тревожен факт, что БАДы, рекламируемые как средства для похудения, содержат потенциально гепатотоксичные субстанции. Это дубровник обыкновенный (Teucrium chamaedrys сем. губоцветных) [40], чаппараль (Larrea tridentata сем. парнолистниковых) [41], кава-кава (Rhizoma Kawa-Kawa), высушенные корневища с корнем перца опьяняющего (Piper methysticum сем. перечных) — в одной работе описаны 30 случаев подобной фитогепатопатии [42], ма хуанг — экстракт эфедры по рецепту традиционной китайской медицины [43]. Зарегистрированы семь случаев фитогепатита при употреблении микстуры, содержащей сочетание валерианы и шлемника (Scutellaria lateriflora сем. губоцветных) [44], в связи с чем продажи этой микстуры были в США в 2001 г. запрещены.
Поражения печени могут возникать и при употреблении витаминов, среди которых лидирует витамин А. Так, опубликована серия из 41 случая гепатита вследствие применения этого витамина [45].
Любопытно, что в одном исследовании тщательный расспрос выявил, что 39 % пациентов с уже имеющимися хроническими болезнями печени применяли те или иные фитопрепараты с лечебной целью.
1. Green R.M., Flamm S. AGA technical review on the evaluation of liver chemistry tests // Gastroenterology. 2002; 123(4): 1367-1384.
2. Bornman P.C., Beckingham I.J. Chronic pancreatitis // ABC of liver, pancreas and gall bladder / Ed. by I.J. Beckingham. — BMJ Books, 2001.
3. Bjornsson E., Kalaitzakis E., Klinteberg A.A. et al. Long-term follow-up of patients with mild to moderate drug-induced liver injury // Aliment Pharmacol Ther. 2007; 26: 79-85.
4. Donnan P.T., McLernon D., Dillon J.F. et al. Development of a decision support tool for primary care management of patients with abnormal liver function tests without clinically apparent liver disease: a record-linkage population cohort study and decision analysis (ALFIE) // Health Technol Assess. 2009; 13: 1-134.
5. Limdi J.K., Hyde G.M. Evaluation of abnormal liver function tests // Postgrad. Med. J. 2003; 79: 307-312.
6. Colombo M.L., Bosisio E. Pharmacological activities of Chelidonium manjus L. (Papaveraceae). Pharmacological Research, 1996; 33(2): 127-134.
7. Кузнецова М.А., Резникова А.С. Сказания о лекарственных растениях. — М.: Высш. школа, 1992. — 272 с.
8. Потопальский А.И. Препараты чистотела в биологии и медицине. — Киев.: Наукова думка, 1992.
9. Lohninger A., Hamler F. Chelidonium majus L. (Ukrain) in the treatment of cancer patients // Drugs under Experimental and Clinical Research. 1992; 18(Suppl.): 73-77.
10. Musianowycz J., Judmajer F. et al. Clinical studies of Ukrain in terminal cancer patients (Phase II) // Drugs under Experimental and Clinical Research. 1992; 18(Suppl.): 45-50.
11. Panzer A., Joubert A.M. et al. The antimitotic effects of UkrainTM, a Chelidonium majus alkaloid derivative, are reversible in vitro // Cancer Letters. March 2000; 150(1): 85-92.
12. Chelidonium Majus — Statement to advise use under supervision // WHO Pharmaceuticals Newsletter No. 4, 2003, p 4.
13. Active ingredients used in cosmetics: safety survey. — Council of Europe Publishing, 2008; р. 92.
14. TGA (Therapeutic Goods Administration) News Issue 41 (July 2003) — Medicines. Concerns about the herb Greater celandine.
15. Nelson L.S., Shih R.D., Balick M.J. New York Botanical Handbook of poisonous and injurious plants // Second edition. Springer, 2007; p. 120-121.
16. Kuntz H.-D. Hepatology: principles and practice. 2nd Edition // Springer Medizin Verlag Heidelberg, 2006; p. 231.
17. Benninger J., Schneider H.T. et al. Acute hepatitis induced by greater celandine (Chelidonium majus). Gastroenterology, 1999. Nov. 117(5): 1234-1237.
18. Stickel F., Poschl G. et al. Acute hepatitis induced by greater celadine (Chelidonium majus) // Scand. J. Gastroenterol. 2003; 38: 565-8.
19. Chelidonium majus: Hepatitis in an elderly patient: case report. Source: Reactions, Volume 1, Number 1264, 2009-08-08, p. 11-11(1).
20. Crijns A.P., de Smet P.A. et al. Acute hepatitis after use of a herbal preparation with greater celandine (Chelidonium majus) // Ned Tijdschr Geneeskd. 19 Jan 2002; 146(3): 124-8.
21. Geubel A.P., Sempoux Ch.L. Drug and toxin-induced bile duct disorders. Review // Journal of Gastroenterology & Hepatology. November 2000; 15(11): 1232-1238.
22. Greving I., Meister V. et al. (). Chelidonium majus: A rare reason for severe hepatotoxic reaction // Pharmacoepidemiology and Drug Safety. 1998; 7(Suppl. 1): S66-S69.
23. Hardeman E., Van Overbeke L. et al. Acute hepatitis induced by Greater Celandine (Chelidonium majus) // Acta gastro-enterologica Belgica. 2008; 71(2): 281-2.
24. Moro P.A., Cassetti F. et al. Hepatitis from Greater celandine (Chelidonium majus L.): review of literature and report of a new case // J. Ethnopharmacol. 24 Apr 2009.
25. Murray K.F., Hadzic N. et al. Drug-related Hepatotoxicity and Acute Liver Failure // Journal of Pediatric Gastroenterology and Nutrition. — October 2008. — Vol. 47. — Issue 4. — P. 395-405.
26. Rifai K., Flemming P. et al. Severe drug hepatitis caused by Chelidonium // Internist (Berl). Jul 2006; 47(7): 749-51.
27. De Smet Peter A.G.M. A letter to The Lancet. Safety concerns about kava not unique // Lancet. — 26 October 2002. — Vol. 360. — Is. 9342. — P. 1336.
28. Bergner P. Chelidonium: Hepatotoxicity associated with herbal tablets // Medical Herbalism. 10-31-96; 8(3): 13.
29. Rudolf1 H., Ullrich1 L.K., Runge D. Toxicity caused by Chelidonium majus in primary human, canine, monkey, and rat hepatocytes // The FASEB Journal. — April, 2009.— Vol. 23.
30. Государственная фармакопея СССР. — Изд. XI. — Вып. 2. — Статья 47. — С. 309.
31. Перечень лекарственных средств, отпускаемых без рецепта врача (Утв. приказом Минздрава РФ от 19 июля 1999 г. № 287).
32. Приложение к приказу Минздравсоцразвития России от 13 сентября 2005 г. № 578 «Об утверждении Перечня лекарственных средств, отпускаемых без рецепта врача».
33. Gunawan B., Kaplowitz N. Clinical perspectives on xenobiotic-induced hepatotoxicity // Drug. Metab. Rev. 2004; 36: 301-312.
34. Whiting P.W., Clouston A., Kerlin P. Black cohosh and other herbal remedies associated with acute hepatitis // Med. J. Aust 2002; 177: 440-443.
35. Furbee R.B., Barlotta K.S., Allen M.K., Holstege C.P. Hepatotoxicity associated with herbal products // Clin. Lab. Med. 2006; 26: 227-241.
36. Daly A.K., Donaldson P.T., Bhatnagar P. et al. DILIGEN Study; International SAE Consortium. HLA-B*5701 genotype is a major determinant of drug-induced liver injury due to flucloxacillin // Nat. Genet. 2009; 41(7): 816-819.
37. Marti L., Del Olmo J.A., Tosca J., Ornia E., Garcia-Torres M.L., Serra M.A., Rodriguez F., Lluch P., Escudero A., Rodrigo J.M. Clinical evaluation of drug-induced hepatitis // Rev. Esp. Enferm. Dig. 2005; 97: 258-265.
38. De Valle M.B., Av Klinteberg V., Alem N., Olsson R., Bjornsson E. Drug-induced liver injury in a Swedish University hospital out-patient hepatology clinic // Aliment. Pharmacol. Ther. 2006; 24: 1187-1195.
39. Gtarantino G., Di Minno M.N.D., Capone D. Drug-induced liver injury: Is it somehow foreseeable? World. J. Gastroenterol. 21 June 2009; 15(23): 2817-2833
40. Stickel F., Egerer G., Seitz H.K. Hepatotoxicity of botanicals // Public. Health. Nutr. 2000; 3: 113-124.
41. Gordon D.W., Rosenthal G., Hart J., Sirota R., Baker A.L. Chaparral ingestion. The broadening spectrum of liver injury caused by herbal medications // JAMA. 1995; 273: 489-490.
42. Russmann S., Lauterburg B.H., Helbling A. Kava hepatotoxicity // Ann. Intern. Med. 2001; 135: 68-69.
43. Lee M.K., Cheng B.W., Che C.T., Hsieh D.P. Cytotoxicity assessment of Ma-huang (Ephedra) under different conditions of preparation // Toxicol. Sci. 2000; 56: 424-430.
44. Lake C.R., Gallant S., Masson E., Miller P. Adverse drug effects attributed to phenylpropanolamine: a review of 142 case reports // Am. J. Med. 1990; 89: 195-208.
45. Geubel A.P., De Galocsy C., Alves N., Rahier J., Dive C. Liver damage caused by therapeutic vitamin A administration: estimate of dose-related toxicity in 41 cases // Gastroenterology. 1991; 100: 1701-1709.
46. Ahn B.M. Herbal preparation-induced liver injury // Korean. J. Gastroenterol. 2004; 44: 113-125
