Газета «Новости медицины и фармации» Офтальмология (324) 2010 (тематический номер)
Вернуться к номеру
Сучасні методи хірургічного лікування рефрактерних глауком
Авторы: С.А. Якименко, д.м.н., проф., П.О. Костенко, лікар. ДУ Інститут очних хвороб і тканинної терапії ім. В.П. Філатова АМН України, м. Одеса
Версия для печати
Вступ
Успіхи медикаментозного, лазерного і хірургічного лікування первинної глаукоми, досягнуті в останні роки, дозволяють у більшості випадків цієї патології не вважати її складною проблемою. Проте залишається велика група найбільш тяжких нозологічних форм глаукоми, що об''єднані терміном «рефрактерна глаукома» (франц. refractaire — несприйнятливий) [5]. До найбільш тяжких видів рефрактерних глауком зараховують вторинну післяопікову глаукому (РПГ), що зумовлено неспроможністю в більшості випадків нормалізувати внутрішньоочний тиск (ВОТ) шляхом використання традиційних антиглаукоматозних фістулізуючих операцій, мета яких є утворення субкон''юнктивальних або інтрасклеральних додаткових шляхів відтоку внутрішньоочної рідини (ВОР). При РПГ, як і при всіх видах рефрактерних глауком, основною проблемою залишається надлишкове рубцювання шляхів відтоку ВОР, створених завдяки антиглаукоматозній операції. В рубцево зміненій після опіку склері та кон''юнктиві, сформованій за допомогою цих втручань, шляхи відтоку внаслідок вираженої фібропластичної активності тканин ока швидко рубцюються і облітеруються [2, 10]. У той же час хірургічне лікування залишається основним методом, що дозволяє запобігти прогресуванню глаукоматозного процесу та необоротній втраті зору. Складності ефективного лікування РПГ також зумовлені часто безсимптомним її перебігом, труднощами діагностики, майже непридатністю медикаментозних середників зниження ВОТ.
Підхід, що вже давно привертає увагу офтальмологів при пошуку нових дієвих засобів зниження ВОТ при рефрактерних глаукомах, це у першу чергу застосування різних дренажів з авто-, ало- і ксенотканини або синтетичних матеріалів, призначених для створення нових шляхів відтоку ВОР. Позитивними властивостями всіх автодренажів є відсутність імунної реакції і притаманна їм ідеальна біологічна сумісність [32]. Алодренажі (із тканин донора) і ксенотрансплантати (із тканин тварин) викликають місцеву запальну реакцію тканин ока, обумовлену імуноалергізуючою дією чужорідної тканини, і схильні до дезорганізації з подальшою облітерацією створених шляхів відтоку [9]. В останні три десятиліття у випадках рефрактерної глаукоми різної етіології застосовуються шунтуючі чи клапанні дренажні імплантати з синтетичних матеріалів, такі як «Крабик», Ahmed (AGV), Molteno (MSPI), Krupin-Denver, Baerveldt, Еx-PRESS mini glaucoma shunt, SOLX gold shunt, von Denffer [11, 12, 16, 37, 38], при яких створюються додаткові підкон''юнктивальні, інтрасклеральні або супрахоріоїдальні шляхи відтоку. Але використання цих дренуючих пристроїв також нерідко викликає ряд ускладнень: при використані шунтів та клапанів основною проблемою стала надлишкова фільтрація в ранньому післяопераційному періоді, а при використанні дренажів — зупинка відтоку камерної вологи у віддаленні строки після втручання, внаслідок рубцевої облітерації сформованого інтрасклерального щілиновидного простору, довготривала післяопераційна гіпотонія, мілка передня камера, макулярний набряк, формування сполучнотканинної капсули навколо зовнішнього кінця дренажу, блокада трубки, ризик контакту з зоровим нервом [29]. Також нерідко виникають косоокість, увеїт, набряк і дистрофія рогівки, хоріоїдальні кровотечі, субатрофія очного яблука, відшарування сітківки, ерозія кон''юнктиви над пластиною чи трубкою з можливим подальшим оголенням чи відторгненням імплантату, що призводило до ендофтальміту [13, 17, 30, 36].
У той же час їх використання, безумовно, виправдане і є практично єдиним засобом досягнення успіху хірургічного лікування рефрактерних глауком. Так, Г.Д. Жабоєдов та співавт. провели ретроспективний аналіз результатів використання вітчизняного дренажного пристрою «Крабик» у 35 хворих із неоваскулярною глаукомою. Серед ускладнень у післяопераційному періоді вони відмічали гіфему у 58,9 % випадків, синдром мілкої камери — у 46,5 %, ексудативну реакцію — у 5,8 %. У 75 % хворих у строки до 2 років ВОТ становив 17,30 ± 0,25 мм рт.ст., що є добрим результатом [3].
I.S. Yalvac (2007) та співавт. показали, що імпланти Ahmed та Molteno дозволяють успішно нормалізувати ВОТ у ранньому та відстроченому післяопераційному періоді, однак при більш довготривалих строках спостережень обидва клапани виявились нездатними нормалізувати ВОТ у хворих із неоваскулярною глаукомою, а саме: загальна вірогідність успіху становила 63,2 % в кінці першого року, досягаючи в кінці п''ятого року для групи з Ahmed 25,2 %, а для групи з Molteno загальна вірогідність успіху становила в кінці першого року 37,0 %, досягаючи в кінці п''ятого року 29,6 %.
Зустрічаються дуже цікаві рішення проблеми утворення щільної капсули навколо пластини дренажних пристроїв після стандартної шунтуючої хірургії, що утруднює відтік ВОР і викликає підйом ВОТ. Dohlman та співавт. навіть повідомили про додаткове приєднання до клапана Ahmed силіконової трубки, кінець якої досягав віддалених епітелізованих порожнин, де менш імовірне формування капсули. Клапан Ahmed був імплантований у 34 ока з рефрактерною глаукомою (у 31 око був імплантований кератопротез). Потік ВОР був направлений до слізного мішечка (2 випадки), до етмоїдальних пазух (6 випадків), до гайморової пазухи (16 випадків) і до нижнього кон''юнктивального склепіння (10 випадків). Середній термін спостереження становив 4 роки і 3 місяці. Лише в 1 випадку спостерігався гострий бактеріальний ендофтальміт у перший рік після шунтуючої операції. Автори роблять висновки, що шунтування, яке сполучає передню камеру з потенційно населеними мікробами порожнинами або нижнім кон''юнктивальним склепінням з його флорою, можна підозрювати як причину створення швидкого ретроградного вторгнення інфекційних агентів і ендофтальміту [19].
Існує ряд робіт, у яких автори намагаються нормалізувати ВОТ після невдалої імплантації дренажного пристрою шляхом додаткової імплантації ще одного дренажного пристрою. Так, A. Anand і співавт., щоб оцінити ефективність додаткової імплантації, проаналізували ретроспективні дані 43 пацієнтів (43 ока) із вторинною глаукомою, яким був повторно імплантований ще один дренажний пристрій (Baerveldt або Ahmed імплант). Успіх визначався при досягненні ВОТ < 21 мм рт.ст та був досягнутий у 93, 89 і 83 % очей у строки 1, 2 і 3 роки відповідно. Автори дійшли висновку, що додаткова імплантація була ефективна для досягнення нормалізації ВОТ та збереження зорових функцій [15].
Останнім часом в офтальмологічній літературі з''явились повідомлення про вживання металевих дренажів, виготовлених із благородних металів — із золота (SOLX gold shunt) (GMS, SOLX, Бостон) [20] або з неіржавіючої сталі (Еx-PRESS mini glaucoma shunt). Золотий дренаж біологічно інертний, але через дорожнечу менш доступний для широкого вживання в практиці. За своєю біологічною інертністю дренаж, виготовлений з неіржавіючої сталі, нічим не поступається золотому дренажу, крім того, процедура імплантації Ex-PRESS™ подібна до стандартної трабекулектомії. Дослідники, вивчаючи GMS, повідомляють про результати, порівнянні з трабекулектомією і клапаном Ahmed.
Найбільш поширеним методом попередження надлишкового рубцювання після антиглаукоматозних операцій є використання цитостатиків (5-фторурацил, мітоміцин С) або антиметаболітів. Але останнім часом з''явились повідомлення про серйозні пізні ускладнення, пов''язані з їх використанням: бульозна кератопатія (48 %), розходження країв кон''юнктивальної рани (10 %), циліохоріоїдальне відшарування (14 %), ендо-фтальміт (3,8–25 %), затяжна гіпотонія (2,9–17 %), іридоцикліт (8,6 %) та ін. [22].
Ряд авторів у своїх публікаціях намагались підвищити ефективність антиглаукоматозних операцій не тільки за рахунок використання цитостатиків або антиметаболітів, а й за рахунок використання гормонів кори надниркових залоз та їх синтетичних аналогів. Так, Y. Kenya зі співавт., намагаючись підвищити ефективність трабекулектомії для лікування вторинної глаукоми, вводили під час операції в субтеноновий простір тріамцинолон ацетонід (ТА). Але автори зробили висновки, що ін''єкція ТА під час операції не збільшує шанс на успіх, а також не зменшує кількість операційних та післяопераційних ускладнень [42].
Увагу дослідників в останні роки привернула амніотична мембрана. Встановлено, що амніон прискорює епітелізацію, знижує запалення, пригнічує надлишкове рубцювання, зменшує адгезивні процеси у тканинах і васкуляризацію. Так, ряд авторів показали у своїх дослідженнях, що застосування трабекулектомії, комбінованої з використанням мітоміцина C (MMC) і одночасною імплантацією амніотичної мембрани, порівняно з трабекулектомією, виконаною в комбінації лише з використанням MMC, дає вищу вірогідність успіху, більш низький післяопераційний середній ВОТ і меншу кількість післяопераційних ускладнень. Так, H. Sheha і співавт. повідомляють, що у строки до 12 місяців після операції компенсація ВОТ спостерігалась на 80 % очей після трабекулектомії, виконаної в комбінації з імплантацією амніотичної мембрани та використанням MMC і лише на 40 % очей у групі з трабекулектомією, виконаною в комбінації з використанням тільки MMC [31, 39].
Циклодеструктивні втручання, направлені на зниження продукції внутрішньоочної рідини, як правило, є другим етапом хірургічного лікування рефрактерних глауком та проводяться, коли фістулізуючі операції навіть при багатократному виконанні не сприяють стабільній нормалізації ВОТ, а також при термінальній болючій глаукомі для зниження ВОТ та купірування болючого синдрому. Але дані про ефективність цих операцій дуже суперечливі. Для циклодеструкції використовують різні процедури: кріодеструкції циліарного тіла [33] за допомогою діодного й ІАГ-лазера [35], сфокусованого ультразвуку [4], ендоскопічної циклокоагуляції [1, 14]. Циклодеструктивні втручання різняться між собою за своєю ефективністю. Так, G.W. Zaidman і T. Wandel, порівнюючи ефективність кріоциклокоагуації та транссклеральної циклокоагуляції діодним лазером (TSYLC), у хворих із РПГ, дійшли висновку, що TSYLC є більш ефективним методом і може слугувати альтернативою кріоциклокоагуації у випадках відсутності ефекту від медикаментозної гіпотензивної терапії [43]. E. Francisco та спів-авт. провели ретроспективний аналіз спостережень 539 очей (539 хворих) із рефрактерною глаукомою, яким була виконана ендоскопічна циклофотокоагуляція. До оперативного втручання ВОТ у середньому становив 38,1 ± 6,5 мм рт.ст., після — 12,1 ± 3,4 мм рт.ст., з гіпотензивною терапією або без неї у строки спостереження — 88,9 ± ± 10,3 місяця. Ці результати, на думку авторів, свідчать, що ендоскопічна циклофотокоагуляція — безпечна й ефективна для лікування хворих із рефрактерною глаукомою [21].
В останні роки запропоновано цілий ряд нових операцій, направлених на збільшення або відновлення увеосклерального відтоку ВОР шляхом його дренування, на який у нормі припадає від 25,0 до 54 % відтоку [8, 34]. Супрахоріо-їдальний простір є вузькою щілиною між судинною оболонкою і склерою, що доходить спереду до склеральної шпори, позаду — до зорового нерва. Однією з передумов для вживання циклодіалізу як антиглаукоматозного компонента при комбінованих втручаннях послужили дані про особливості будови капілярів циліарного тіла й судинної оболонки ока. В ендотелії їх стінок знаходиться безліч фенестр, що обумовлюють високу проникність цих капілярів для рідини. Така структура капілярів поряд із колоїдно-осмотичним тиском плазми крові сприяє резорбції камерної вологи. Супрахоріоїдальний простір перетинають судини, нервові стовбури, пучки волокнистої тканини [7]. Встановлено, що увеосклеральний шлях відтоку проходить прямо через циліарне тіло по інтерстиціальних просторах поздовжніх м''язових волокон у супрахоріоїдальний простір, а далі по периваскулярних і периневральних просторах частка рідини фільтрується через склеру в орбіту. Інтрасклеральні венозні сплетіння і шлеммів канал пов''язані прямими анастомозами з венами циліарного тіла. Таким чином, частка рідини через венозну мережу в зовнішньому відділі циліарного тіла по анастомозах відтікала у шлеммів канал і в інтрасклеральне венозне сплетіння [26, 28]. Слід зазначити, що супрахоріоїдальна щілина підтримується у відкритому стані за рахунок постійного надходження внутрішньоочної рідини з передньої камери через склеральну шпору й нижню частку циліарного тіла [8]. Основоположником операцій, що формують шляхи відтоку ВОР до циліарного тіла й активують задній — увеосклеральний відтік, є L. Heine, який у 1905 році запропонував циклодіаліз; на думку автора, при цьому не виключається і зменшення секреції водянистої вологи [24]. Операція давала виражений гіпотензивний ефект, але через швидку облітерацію циклодіалізної щілини ефект був короткочасним.
З огляду на те що при фістулізуючих антиглаукоматозних операціях проблема рубцювання підкон''юнктивальної фільтраційної подушечки все ще задовільно не вирішена, дренування ВОТ у супрахоріоїдальний простір є альтернативним вибором при лікуванні рефрактерних глауком [23, 27].
В останні роки з''явились публікації, у котрих автори намагались комбінувати циклодіаліз із різноманітними антиглаукоматозними операціями. J.F. Jordan зі співавт. описують нову хірургічну техніку, при якій використовується імплантація силіконової трубки, що дозволяє направити потік ВОР від передньої камери до супрахоріоїдального простору, техніка операції мала елементи класичної трабекулектомії. Через 52 тижні успіх визначався в 60 %, але через 76 тижнів тільки у 40 % очей. Автори зазначають, що цей новий хірургічний підхід з імплантацією силіконової трубки має декілька переваг: його інтрасклеральна імплантація мінімізує ризик кон''юнктивальної ерозії і пов''язаний із цим ризик розвинення інфекційних ускладнень. Єдиним чинником, що обмежує функціонування дренажу, є реакція фібробластів, що призводить до його інкапсуляції з подальшим припиненням фільтрації ВОР по ньому [27].
R. Sihota зі співавт., оцінивши ефективність циклодіалізу, виконаного одночасно з трабекулектомією, що комбінувалась з використанням MMC, зробили висновки, що втручання є безпечним і ефективним методом зниження ВОТ у випадках рефрактерної глаукоми [39].
Е.І. Клюцевою запропоновано дренування супрахоріоїдального простору авторайдужкою — операція іридентазис [6]. Компенсація офтальмотонусу у віддалені строки зберігалась у 75,0 % хворих із вторинною післяопіковою глаукомою. Але у більшості випадків у зв''язку з атрофічними змінами чи втратою належної структури райдужкою проведення цієї операції значно ускладнене чи взагалі неможливе.
Проведений огляд літератури свідчить про недостатню ефективність запропонованих різноманітних хірургічних методик лікування рефрактерних видів глауком взагалі та вторинної післяопікової глаукоми зокрема. Тому подальший пошук нових ефективних методів лікування рефрактерних глауком залишається актуальною задачею офтальмології.
Мета — розробити нові методи хірургічного лікування вторинної післяопікової глаукоми та інших видів рефрактерних видів глауком, вивчити їх ефективність.
Матеріали і методи
В опіковому відділенні Інституту ім. В.П. Філатова для хірургічного лікування вторинної глаукоми на очах із тяжкими наслідками опіків багато років застосовувалась методика операції, що була запропонована С.А. Якименко (1979), а саме автосклеральне циклогоніодренування (СЦГД), що добре себе зарекомендувало в клініці та лягло в основу різних варіантів операції [10]. Ідея операції полягає у створенні умов для відтоку ВОР у супрахоріоїдальний простір шляхом дренування його і кута передньої камери автосклеральною смужкою.
В останні роки нами запропоновані її нові модифікації, сутність яких полягає у створенні шляхів для відтоку ВОР у супрахоріоїдальний простір шляхом дилатації та дренування кута передньої камери та супрахоріоїдального простору дублікатурою автосклеральної смужки, що дозволило збільшити об''єм відтікаючої ВОР, забезпечуючи постійне функціонування дренажу.
Техніка операції
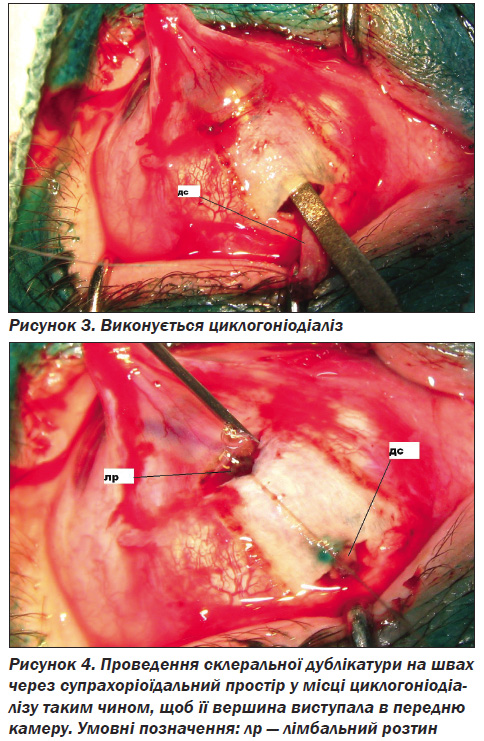
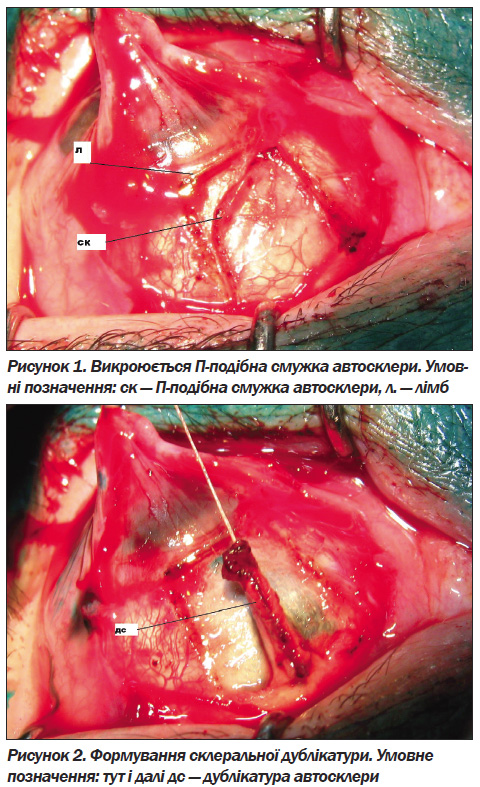 Повіки фіксували блефаростатом. Після ін''єкції 2,0 мл 2% р-ну лідокаїну під кон''юнктиву (чи слизову, що попередньо трансплантувалась із губи для усунення зрощень очного яблука з повіками) в одному з квадрантів очного яблука проводився розтин кон''юнктиви (чи слизової) на відстані 8–10 мм від лімбу й відсепаровка її до лімбу. Викроюється зі склери П-образна смужка шириною 3–5 мм із вершиною на лімбі, і з основою на 5–6 мм від лімбу, на 2/3 товщини склери (рис. 1). При використанні склеральної дублікатури проводиться її формування швом по довжині смужки (рис. 2). Під основою склеральної дублікатури (смужки) розтинаються глибокі шари склери до судинної оболонки і через утворений розтин відповідно до склеральної смужки проводиться циклогоніодіаліз (рис. 3).
Повіки фіксували блефаростатом. Після ін''єкції 2,0 мл 2% р-ну лідокаїну під кон''юнктиву (чи слизову, що попередньо трансплантувалась із губи для усунення зрощень очного яблука з повіками) в одному з квадрантів очного яблука проводився розтин кон''юнктиви (чи слизової) на відстані 8–10 мм від лімбу й відсепаровка її до лімбу. Викроюється зі склери П-образна смужка шириною 3–5 мм із вершиною на лімбі, і з основою на 5–6 мм від лімбу, на 2/3 товщини склери (рис. 1). При використанні склеральної дублікатури проводиться її формування швом по довжині смужки (рис. 2). Під основою склеральної дублікатури (смужки) розтинаються глибокі шари склери до судинної оболонки і через утворений розтин відповідно до склеральної смужки проводиться циклогоніодіаліз (рис. 3).
Після цього в місці відсепарованої вершини смужки виконується лімбальний розтин і проводиться іридектомія. Склеральна дублікатура (смужка) на швах, накладених із відступом на 1 мм від її вершини, через розтин глибоких шарів склери в основи дублікатури проводиться через супрахоріоїдальний простір у місці циклогоніодіалізу в такий спосіб, щоб її вершина виступала в передню камеру (рис. 4). Кінці швів проводять через краї лімбального розтину і зав''язують. Таким чином, шви виконують подвійне завдання: утримують вершину дублікатури в куті передньої камери і використовуються для адаптації країв лімбального розтину. Накладається шов на розтин кон''юнктиви.
Був проведений аналіз ефективності запропонованих нами антиглаукоматозних операцій: СЦГД(С) — 30 очей (32 операції) і її модифікації СЦГД(Д) — 67 очей (74 операції), виконаних з 1996 по 2010 рік. Операції проводились на очах із грубими рубцевими змінами повік, кон''юнктиви та рогівки (щільне васкуляризироване більмо, наявність симблефарону, анкілосимблефарону) і діагностованою вторинною глаукомою. У всіх хворих до операції офтальмотонус був підвищений — 31,0–54,0 мм рт.ст. Гострота зору на всіх очах дорівнювала світловідчуттю. У більшості хворих раніше проводились різні антиглаукомні операції, але безуспішно. Критерієм ефективності служила компенсація ВОТ у ранньому й віддаленому післяопераційному періоді.
Результати досліджень і їх обговорення
При аналізі ефективності запропонованих нами антиглаукоматозних операцій було встановлено, що в післяопераційному періоді нормалізація ВОТ була досягнута у всіх хворих. Був проведений аналіз ефективності застосованих методик операції у строки до 6 місяців, до 1 року і до 2 років (табл. 1).
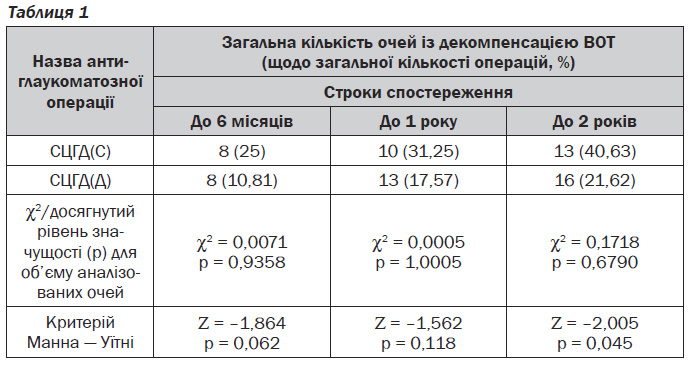
Як видно з табл. 1, в усі строки спостережень статистично значимих відмінностей за об''ємами аналізованих вибірок очей за різними модифікаціями СЦГД не спостерігалось (p = 0,9358–1,0005).
 Аналіз результатів операцій показав, що у строки до 6 місяців після СЦГД(С) у 25 % випадків відбулась декомпенсація ВОТ, після СЦГД(Д) — у 10,81 %, досягнутий рівень значущості p = 0,062, трохи перевищуючи заданий, що пояснюється невеликою кількістю аналізованих очей із декомпенсацією в ці строки. У термін до 1 року декомпенсація ВОТ настала: при СЦГД(С) — на 10 із 32 очей (31,25 %), при СЦГД(Д) — на 13 із 74 очей (17,57 %), p = 0,118. У віддалені строки (до 2 років) декомпенсація ВОТ настала: при СЦГД(С) — на 13 із 32 очей (40,63 %), при СЦГД(Д) — на 17 із 74 очей (22,98 %), p = 0,045. На останніх очах у ці строки зберігалась компенсація ВОТ, досягнута завдяки проведеним операціям. Наведений аналіз дозволив статистично значимо підтвердити, що у віддалені строки СЦГД(Д) порівняно з СЦГД(С) дозволяє більш ефективно знижувати ВОТ на очах із грубими рубцевими післяопіковими змінами переднього відділу.
Аналіз результатів операцій показав, що у строки до 6 місяців після СЦГД(С) у 25 % випадків відбулась декомпенсація ВОТ, після СЦГД(Д) — у 10,81 %, досягнутий рівень значущості p = 0,062, трохи перевищуючи заданий, що пояснюється невеликою кількістю аналізованих очей із декомпенсацією в ці строки. У термін до 1 року декомпенсація ВОТ настала: при СЦГД(С) — на 10 із 32 очей (31,25 %), при СЦГД(Д) — на 13 із 74 очей (17,57 %), p = 0,118. У віддалені строки (до 2 років) декомпенсація ВОТ настала: при СЦГД(С) — на 13 із 32 очей (40,63 %), при СЦГД(Д) — на 17 із 74 очей (22,98 %), p = 0,045. На останніх очах у ці строки зберігалась компенсація ВОТ, досягнута завдяки проведеним операціям. Наведений аналіз дозволив статистично значимо підтвердити, що у віддалені строки СЦГД(Д) порівняно з СЦГД(С) дозволяє більш ефективно знижувати ВОТ на очах із грубими рубцевими післяопіковими змінами переднього відділу.
У всіх хворих із компенсованим ВОТ збереглось світловідчуття, був усунений больовий симптом, у частини з них були проведені операції з метою відновлення зору (кератопластика або кератопротезування).
В останні роки для лікування вторинної післяопікової глаукоми та інших рефрактерних видів глауком (неоваскулярна, післятравматична, післяувеальна), а також при термінальній болючій глаукомі ми застосовуємо власну модифікацію автосклерального циклогоніодренування в комбінації з клапаном Ahmed, прооперовані 24 хворі. Спостереження за прооперованими хворими протягом понад 2 роки показали, що така комбінація підвищує сумарну ефективність цих операцій.
Висновки
Використання запропонованих нами антиглаукоматозних операцій — автосклерального циклогоніодренування смужкою автосклери і її модифікації автосклерального циклогоніодренування дублікатурою автосклери дозволило завдяки створенню додаткових шляхів відтоку внутрішньоочної рідини в супрахоріоїдальний простір у більшості хворих із рефрактерною післяопіковою глаукомою досягти нормалізації ВОТ упродовж багатьох років, усунути больовий симптом, зберегти світловідчуття. Це свідчить про те, що запропоновані нами операції є патогенетично обгрунтованими для застосування у хворих з ознаками органічного блоку шляхів відтоку внутрішньоочної рідини на всіх їх рівнях (склерального, кута передньої камери та зіничного блоку).

Вищезазначене дозволяє рекомендувати їх до широкого застосування не тільки при вторинній рефрактерній післяопіковій глаукомі, а й при інших різноманітних формах рефрактерних глауком.
1. Азнабаев М.Т. и соавт. Повторная эндоскопическая циклолазеркоагуляция // Актуальные вопросы офтальмологи. Часть 1. — М., 2000. — С. 97-98.
2. Войно-Ясенецкий В.В. Разрастание и изменчивость тканей глаза при его заболеваниях и травмах. — Киев: Вища школа, 1979. — 224 с.
3. Жабоедов Г.Д., Курилина Е.И., Чурюмов Д.С. Хирургия тяжелых форм рефрактерной глаукомы: применение дренирующих устройств // Проблемы, достижения и перспективы развития медико-биологических наук и практического зравоохранения. — Симферополь, 2008. — Том 144, часть 2. — С. 37-39.
4. Еричев В.П. Хирургическое и ультразвуковое лечение основных форм рефрактерной глаукомы: Дис... д-ра мед. наук. — М., 1998. — 172 с.
5. Еричев В.П. Рефрактерная глаукома: особенности лечения // Вестн. офтальмол. — 2000. — № 5. — С. 8-10.
6. Клюцевая Е.И. Вторичная глаукома. — Минск: Беларусь, 1979. — 143 с.
7. Нестеров А.П., Бунин А.Я., Кацнельсон Л.А. Внутриглазное давление // Физиология и патология. — М.: Наука, 1974. — 380 с.
8. Нестеров А.П. Глаукома. — М.: Медицина, 1995. — 255 с.
9. Посаженников А.П. Способ дренажа передней камеры яичной пленкой при тяжелых формах глауком // Актуальные проблемы офтальмологии: Тез. докл. научно-практ. конф. — Киров, 1996. — С. 59-61.
10. Пучковская Н.А., Якименко С.А., Непомящая В.М. Ожоги глаз. — М.: Медицина, 2001. — 272 с.
11. Тахчиди Х.П., Метаев С.А., Чеглаков П.Ю. Сравнительная оценка шунтовых дренажей, доступных в России, в лечении рефрактерной глаукомы // Глаукома. — 2008. — 1. — С. 52-54.
12. Ayyala R.S., Layden W.E., Slonim C.B. et al. Anatomic and histopathologic findings following a failed Ahmed glaucoma valve device // Ophthalmic Surg. Lasers. — 2001. — 32. — 248-9.
13. Al-Torbak A.A., Al-Shahwan S., Al-Jadaan I. et al. Endophthalmitis associated with the Ahmed glaucoma valve implant // Br. J. Ophthalmol. —2005 Apr. — 89(4). — 454-8.
14. Ansori E., Gandehewar J. Long-term efficacy and visual acuity followin transscleral diode laser photocoagulation in cases of refractory and non- refractory glaucoma // Eye. — 2007. — Vol. 21. — № 7. — Р. 936-940.
15. Anand A., Tello C., Sidoti P.A., Ritch R., Liebmann J.M. Sequential glaucoma implants in refractory glaucoma // Am. J. Ophthalmol. — 2010 Jan. — 149(1). — 95-101. Epub 2009 Oct 17.
16. Carlos Souzaab, Duc H. Trana, Jane Lomana, Simon K. Law, Anne L. Colemana Long-term Outcomes of Ahmed Glaucoma Valve Implantation in Refractory Glaucomas // Am. J. Ophth. — 2007 December. — Vol. 144. — Issue 6. — P. 893-900.
17. Deokule S.P., Molteno A.C., Be-vin T.H., Herbison P. Long-term results of Molteno implant insertion in cases of chronic angle closure glaucoma // Clin. Experiment. Ophthalmol. — 2007 Aug. — 35(6). — 514-910.
18. Gedde S.J., Scott I.U., Tabandeh H. et al. Late endophthalmitis associated with glaucoma drainage implants // Ophthalmology. — 2001. — 108. — 1323-1327.
19. Dohlman Claes H., Grosskreutz Cynthia L., Chen Teresa C., Pasquale Louis R., Rubin Peter A.D., Kim Eva C., Durand Marlene. Shunts to Divert Aqueous Humor to Distant Epithelialized Cavities After Keratoprosthesis Surgery // Journal of Glaucoma. — 2010 February. — 19(2). — 111-115.
20. Erin L. Boyle. Glaucoma surgical innovations explore new pathways for aqueous outflow // Ocular Surgery News. — 2008. — 5. — 10. The Solx Gold Micro-shunt (GMS) Treatment, Solx clinical literature hand-out // Industry Show. —2006 Feb. SOLX Launches. New Glaucoma System // FDAnews Device Daily Bulletin. — March 1, 2005. — Vol. 2, № 42.
21. Francisco Eduardo Lima, José Beniz Neto, Daniela Toscano, Durval Moraes de Carvalho Marcos Pereira de Ávila. Endoscopic cyclophotocoagulation in refractory glaucomas: a long term study // Revista Brasileira de Oftalmologia. — 2009 May/June. — Vol. 68, № 3.
22. Greenfield D., Suner I., Miller M. Endophtalmitis after filtering surgery with mitomycin C // Arch. Ophthalmol. — 1996. — Vol. 114, № 7. — P. 943-949.
23. Guthoff R.F., Schmidt W., Buss D., Schultze C., Ruppin U., Stachs O., Sternberg K., Klee D., Chichkov B., Schmitz K.-P. Development of a glaucoma microstent with drainage into the suprachoroidal space: fluid mechanical model approach // Der Ophthalmologe Zeitschrift der Deutschen Ophthalmologischen Gesellschaft. — 2009. — Vol. 106, Issue 9. — P. 805-812.
24. Heine L. Die Cyclodialyse, eine neue Glaukomoperation // Dtsch. Med. Wschr. — 1905. — 824-826.
25. Hurvitz L.M. Corneal opacification after 5-fluorouracil injections // Ophthalmic. Surg. — 1994. — Vol. 25, № 2. — P. 130.
26. Joo S.H., Ko M.K., Choe J.K. Outflow of aqueous humor following cyclodialysis or ciliochoroidal detachment in rabbit // Korean J. Ophthalmol. — 1989 Dec. — 3(2). — 65-9.
27. Jordan J.F., Engels B.F., Dinslage S., Dietlein T.S., Ayertey H.D., Roters S., Esser P., Konen W., Krieglstein G.K. A novel approach to suprachoroidal drainage for the surgical treatment of intractable glaucoma // J. Glaucoma. — 2006 Jun. — 15(3). — 200-5.
28. Krohn J., Bertelsen T. Light micro-scopy of uveoscleral drainage routes after gelatine injections into the suprachoroidal space // Acta Ophthalmologica Scandinavica. — 1998. — Vol. 76, Issue 5. — P. 521-527.
29. Kahook M.Y., Noecker R.J., Pantcheva M.B., Schuman J.S. Location of glaucoma drainage devices relative to the optic nerve // British Journal of Ophthalmology. — 2006. — 90. — 1010-1013; Published Online First — 13 April 2006. doi:10.1136/bjo.2006.091272.
30. Lama P.J., Fechtner R.D. Tube erosion following insertion of a glaucoma drainage device with a pericardial patch graft // Arch. Ophthalmol. — 1999. — 117. — 1243-1244.
31. Liv Drolsum, Christian Willoch and Bjørn Nicolaisse. Use of amniotic membrane as an adjuvant in refractory glaucoma // Acta Ophthalmologica Scandinavica. — 2006 Dec. — Vol. 84. — Issue 6. — P. 786-789.
32. Murata M. An experimental study of the outflow pathway of the aqueous humor after glaucoma surgery // Acta Soc. Ophthalmol. Jap. — 1980. — Vol. 84, № 9. — Р. 329-335.
33. Otto P., Harnisch J.P. Results of cyclo-cryocoagulation of the ciliary body with probe temperatures of –70 degrees C and –82 degrees C in glaucoma // Ophthalmologe. — 1993 Dec. — 90(6). — 588-93.
34. Ozdamar, Akif MD; Aras, Cengiz MD; Karacorlu, Murat MD. Suprachoroidal Seton Implantation in Refractory Glaucoma: A Novel Surgical Technique // Journal of Glaucoma. — August 2003. — Vol. 12. — Issue 4. — Р. 354-359.
35. Schlote Torsten, Derse Matthias, Zierhut Manfred. Transscleral diode laser cyclophotocoagulation for the treatment of refractory glaucoma secondary to inflammatory eye diseases // British Journal of Ophthalmology. — 2000 September 1. — 84(9). — 999-1003.
36. Sait Egrilmez, MD; Ayse Yagci, MD; Halil Ates, MD; S. Sertac Azarsiz, MD; Kutay Andac, MD. Glaucoma Implant Surgery With Autogenous Fascia Lata in Scleromalacia Perforans // Ophthalmic Surgery, Lasers and Imaging. — 2004 July/August. — Vol. 35, № 4.
37. Spiegel D., Wetzel W., Haffner D.S. et al. Gold drainage device in glaucoma patients // EyeWorld. — April 2007.
38. Spiegel D., Wetzel W., Haffner D.S. et al. Initial clinical experience with the trabecular micro-bypass stent in patients with glaucoma // Adv. Ther. — 2007. — 24(1). — 161-70.
39. Sheha H., Kheirkhah A., Taha H. Amniotic membrane transplantation in trabeculectomy with mitomycin C for refractory glaucoma // J. Glaucoma. — 2008 Jun-Jul. — 17(4). — 303-7.
40. Sihota R., Srinivasan G., Gupta V. Ab-externo cyclodialysis enhanced trabeculectomy for intractable post-penetrating keratoplasty glaucoma // Eye. — 2009, 11 December. doi:10.1038/eye.2009.282
41. Tsai J.С., Grajewski A.L., Parrish R.K. 2nd. Surgical revision of glaucoma shunt implants // Ophthalmic Surg. Lasers. — 1999. — Vol. 30, № 1. — P. 41-46.
42. Kenya Yukia, Daisuke Shibaa, Itaru Kimuraab, Yuichiro Ohtakea, Kazuo Tsubo-
taa.Trabeculectomy With or Without Intraoperative Sub-Tenon Injection of Triamcinolone Acetonide in Treating Secondary Glaucoma // Am. J. Ophthalmol. — 2009 Jun. — 147(6). — 1055-60, 1060.e1-2. Epub 2009 Mar 27
43. Zaidman G.W., Wandel T. Transscleral YAG laser photocoagulation for uncontrollable glaucoma in corneal patients // Cornea. — 1988. — 7(2). — 112-4.
