Газета «Новости медицины и фармации» Гастроэнтерология (323) 2010 (тематический номер)
Вернуться к номеру
Гепатотоксичность в онкологии
Авторы: И.Л. Кляритская, д.м.н., професcор, зав. кафедрой; Е.В. Максимова. Кафедра терапии и семейной медицины факультета последипломного образования Крымский государственный медицинский университет им. С.И. Георгиевского, г. Симферополь
Версия для печати
Проблема онкологических заболеваний очень актуальна для современного общества. Статистика говорит о том, что за последние 100 лет по уровню заболеваемости и смертности онкопатология переместилась с десятого места на второе, уступая лишь болезням сердечно-сосудистой системы. По прогнозам Всемирной организации здравоохранения (ВОЗ), к 2020 году онкопатология выйдет на первое место, а по данным Американской ассоциации госпиталей, это произойдет уже через 5 лет. Кроме того, по прогнозам ВОЗ, заболеваемость и смертность от онкологических заболеваний во всем мире возрастет в 2 раза за период с 1999 года по 2020 год: с 10 до 20 млн новых случаев и с 6 до 12 млн регистрируемых смертей [1].
По данным ВОЗ, каждый год заболевают 10 млн человек. По данным статистики, в Украине за последние десять лет количество больных возросло на 25 %, общая численность населения сократилась на 4 млн человек. Онкологическая заболеваемость стабильно возрастает на 2,6–3 % в год, и рак продолжает «молодеть».
В Украине каждый год обнаруживается более 160 тыс. новых случаев злокачественных новообразований, почти 100 тыс. жителей умирают от рака, причем 35 % умерших — лица трудоспособного возраста. Каждый час регистрируется более 20 новых случаев заболевания, а 10 жителей Украины умирают от рака. По расчетам специалистов, до 2020 года количество впервые заболевших раком в Украине превысит 200 тыс. в год [1].
В современной терапии онкологических больных ведущее место занимает химиотерапия. Химиотерапия — это метод лечения злокачественных новообразований с помощью цитотоксических (токсичных для клеток, угнетающих жизнедеятельность клеток) лекарственных веществ. Полихимиотерапия (ПХТ) наиболее распространена. Она может применяться в качестве единственного метода лечения или в комбинации с другими методами — хирургическим и лучевым. В случае комбинированного лечения химиотерапия может как предшествовать другим методам, так и завершать лечение.
Достижения современной химиотерапии позволили добиться успехов в излечении многих злокачественных новообразований, считавшихся ранее фатальными. Повышение эффективности лечения достигнуто благодаря интенсификации режимов химиотерапии. Однако негативной стороной ПХТ являются побочные эффекты противоопухолевых лекарственных средств, обусловленные низкой селективностью большинства цитостатиков, что служит серьезным ограничением в достижении максимального лечебного действия. В связи с этим разработка и использование в клинической практике лекарственных средств, которые уменьшают токсичность цитостатиков на организм без снижения их противоопухолевого эффекта, являются актуальной проблемой современной онкологии.
Противоопухолевая терапия уничтожает опухолевые клетки, но одновременно повреждает и нормальные быстро делящиеся клетки, к которым относятся костный мозг, слизистая оболочка полости рта и желудочно-кишечного тракта (ЖКТ), волосяные фолликулы. Возникновение побочных эффектов при проведении химиотерапии онкологических больных связано со спецификой противоопухолевого эффекта препаратов, их низкой избирательностью, а также необходимостью поддерживать достаточно высокую терапевтическую дозу. Выраженность побочных эффектов зависит от типа, общей и суммарной дозы препарата, а также длительности химиотерапии.
В настоящее время известны следующие побочные эффекты со стороны ЖКТ при проведении химиотерапии: поражение печени, стоматит, эзофагит, гастрит, энтероколит, тошнота, анорексия. Поражение печени, возникающее в результате приема медикаментов, является одной из самых животрепещущих проблем фармакотерапии. Учитывая роль печени в метаболизме химических веществ, можно априори утверждать, что не существует лекарств, которые в определенных условиях не вызывали бы повреждения печени. Многочисленные сведения о гепатотоксическом действии многих лекарственных препаратов (ЛП) позволяют сделать вывод, что медикаментозные поражения печени — одна из важнейших проблем гепатологии. Средства противоопухолевой химиотерапии занимают лидирующие позиции по частоте и тяжести вызываемых ими гепатотоксических реакций. Хотя все врачи осведомлены о возможности развития гепатотоксических реакций на разнообразные препараты, в клинической практике этот диагноз формулируется неоправданно редко. Статистика медикаментозных гепатитов в настоящее время изучена недостаточно, это в значительной степени обусловлено тем, что непросто отличить симптомы собственно заболевания от побочных эффектов лечения. По данным литературы, частота лекарственных гепатитов составляет от 1 до 28 % от всех побочных действий, связанных с медикаментозной терапией. Согласно данным клиники Мейо (США), побочные эффекты лекарственных средств выступают в роли причинного фактора желтухи у 2–5 % госпитализированных больных. Это обусловлено не столько частотой возникновения таких реакций (лекарственные вещества являются причиной развития паренхиматозной желтухи лишь в 5 % случаев), сколько довольно большой вероятностью их неблагоприятных исходов. По этим же данным, 40 % гепатитов у пациентов старше 40 лет и 25 % случаев фульминантной печеночной недостаточности (ФПН) обусловлены лекарственной гепатотоксичностью. В Западной Европе острые лекарственные гепатиты (ОЛГ) составляют 15–20 % молниеносных гепатитов, в Японии — 10 %, в России — 5 % и менее (А.И. Хазанов, 2007). Соотношение острых вирусных гепатитов и ОЛГ составляет 4–6 : 1.
Установлено, что у 20 % больных ОЛГ с желтухой существует риск развития фульминантной формы гепатита (D. Larrey, 2000). Расширяется спектр лекарств, вызывающих поражение печени: в
Сегодня лекарственные поражения печени (ЛПП) — одна из серьезных проблем гепатологии. В экономически развитых странах ЛПП занимают существенное место в структуре заболеваемости и смертности населения. Из миллионов известных химических веществ более 63 тыс. широко используются, из них около 55 тыс. соединений — лекарства, представляющие опасность для человека. Ежегодно более 1 млн человек страдает от побочных эффектов фармакотерапии и около 180 тыс. умирают от них.
Экономический ущерб составляет более 136 млрд долларов в год. Истинная частота ЛПП неизвестна ввиду отсутствия широкомасштабных фармако-эпидемиологических исследований. Вместе с тем практически все исследователи подчеркивают, что истинную распространенность лекарственных поражений печени оценить весьма затруднительно. Это обусловлено, с одной стороны, нередкими случаями сокрытия побочных эффектов лекарств врачами, с другой — недостаточной осведомленностью об их клинических проявлениях.
Особо сложную задачу для врача представляет развитие лекарственной гепатотоксичности у пациентов, которым «причинный» препарат назначен по витальным показаниям, как в случае проведения полихимиотерапии у онкологических больных. С одной стороны, в этих ситуациях отмена лечения невозможна из-за опасности прогрессирования основного заболевания, с другой — продолжение его нежелательно ввиду риска развития тяжелого гепатита. Кроме того, многокомпонентная терапия, представляющая собой комплекс потенциально гепатотоксичных субстанций, нередко не позволяет конкретизировать вещество, вызвавшее патологическую реакцию. «Безболезненного» выхода из данной ситуации нет, но можно предпринять попытку уменьшить или даже минимизировать риск тяжелого повреждения печени.
Вследствие поражения печени тормозятся все ее функции, а особенно детоксикационная. Цитостатики блокируют функцию детоксикации и регенерации клеток, а это способствует накоплению лекарственного средства и усилению повреждающего действия на печень.
Особое внимание в плане гепатотоксичности необходимо обратить на 6-меркаптопурин, метотрексат, циклофосфан, адриамицин и другие противоопухолевые средства.
Поскольку характер патогенного влияния лекарств на печень может быть разнообразным и сопровождаться развитием различных патоморфологических изменений (от дистрофии и холестаза до фульминантного гепатита), всю группу лекарственных поражений печени обозначают общим термином «гепатопатии».
В зависимости от степени повышения уровня аланинаминотрансферазы (АЛТ) и щелочной фосфатазы (ЩФ) выделяют три типа медикаментозных поражений печени [4] (табл. 1).
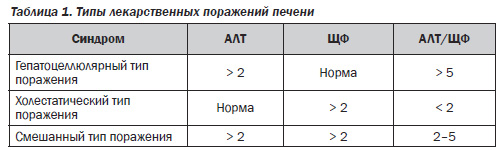
Терапия больных, нуждающихся в применении цитостатических препаратов, является значительной медико-социальной проблемой. Данная группа медикаментозных средств характеризуется большим потенциалом негативного влияния на структурно-функциональное состояние печени [5]. Так, метотрексат, азатиоприн и циклофосфамид могут обусловливать некроз гепатоцитов зоны III, фиброз, цирроз, а в ряде случаев — первичный рак печени. После лечения лейкоза цитостатиками может наблюдаться развитие умеренного склероза некоторых портальных зон, приводящего к возникновению картины идиопатической портальной гипертензии [6]. Лечение циклофосфамидом и бусульфаном в конечном итоге может приводить к возникновению веноокклюзионной болезни [7], ципротероном и этопозидом — к острому гепатиту [8]. Флутамид — антиандрогенный препарат, применяемый для лечения рака предстательной железы, может вызывать как гепатит, так и холестатическую желтуху [9]. При приеме цитарабина отмечается развитие холестаза. Лечение азатиоприном может осложниться развитием гепатоканаликулярного холестаза. При лечении половыми или анаболическими стероидными гормонами наблюдаются расширение синусоидов, пелиоз, развитие опухолей печени. Цитостатики в высоких дозах могут вызывать повышение уровня трансаминаз, длительный их прием приводит к хроническому гепатиту, фиброзу и портальной гипертензии [5, 7, 10]. При сочетанном применении лекарств их токсическое действие может усиливаться (например, эффекты 6-меркаптопурина усиливаются доксорубицином).
В зависимости от вида повреждения, продолжительности и интенсивности повреждающего воздействия выделены многочисленные морфологические варианты лекарственных поражений печени. Для препаратов, используемых в химиотерапии опухолей, характерны следующие из них [11, 12]:
1. Фиброз (цитостатики).
2. Стеатогепатит (синтетические эстрогены).
3. Поражение сосудов:
4. Острый гепатит (андрогены (флутамид)).
5. Канальцевый холестаз (андрогены, эстрогены).
6. Склерозирующий холангит (5-фтор-урацил, цисплатин).
Лекарственные поражения печени зависят от свойств лекарственного препарата, особенностей больного и прочих факторов. За последнее десятилетие выделены многие факторы риска ЛПП [2, 3, 13, 14]. Их можно разделить на две основные группы: генетические и факторы окружающей среды. Гепатотоксичность развивается преимущественно вследствие действия метаболитов, а не самого лекарственного препарата, поэтому факторам, влияющим на реакции метаболитов, уделяется особое внимание. К ним относят: генетический полиморфизм и индукцию (подавление) ферментов, метаболизирующих ЛП, а также факторы окружающей среды. Известно, что вероятность побочных реакций возрастает с увеличением количества одновременно принимаемых лекарств. Уставлено, что если больной принимает одновременно шесть или более препаратов, вероятность побочного действия у него достигает 80 %.
Факторы риска лекарственного поражения печени:
Генетическая предрасположенность определяется дефектами структуры или количеством ферментов, участвующих в метаболизме лекарственных средств, что приводит к особой биотрансформации лекарств у лиц с индивидуальной чувствительностью. Имеются данные о стойкой связи некоторых форм лекарственного поражения печени с определенными классами человеческого лейкоцитарного антигена (HLA).
Генетические дефекты, которые предрасполагают к развитию ОЛГ при приеме препаратов:
Фоновое заболевание печени. Наличие любого острого или хронического заболевания печени является фактором риска развития и лекарственного поражения печени. Зачастую присоединение лекарственного поражения остается нераспознанным и трактуется как обострение или декомпенсация основного заболевания, что связано с объективными трудностями в диагностике данного состояния.
Пол. Считается, что три четверти пациентов с лекарственно-индуцированной болезнью печени — женщины. Пол пациента может влиять как на выраженность прямого повреждающего действия ЛП на печень, так и на чувствительность к гепатотоксичным факторам. Женщины в большей степени предрасположены к развитию лекарственного гепатита. Одинаковое половое распределение наблюдается при медикаментозных холе-статических реакциях.
Возраст. Лекарственные поражения печени наиболее часто развиваются у детей младше трех лет и у взрослых старше 40 лет. С возрастом увеличивается не только частота встречаемости, но и тяжесть поражения печени. У пожилых людей выведение лекарственного средства из организма замедляется из-за уменьшения объема печеночной паренхимы и снижения в ней интенсивности кровотока. У детей реакции на лекарства встречаются преимущественно в случае передозировки.
Алкоголь. Хроническое злоупотребление алкоголем приводит к тому, что гепатотоксические реакции возникают при более низких дозах, а также увеличивают степень тяжести лекарственного поражения печени, вызванного, например, парацетамолом, изониазидом или никотинамидом.
Одновременное применение нескольких лекарственных препаратов. Поражение печени с большей вероятностью следует ожидать у пациентов, принимающих не один, а несколько фармакологических препаратов.
Предшествующий анамнез. Риск развития лекарственного поражения печени повышен у лиц, имеющих указания в анамнезе на побочные реакции от применения данного препарата или его аналога.
Трофологический статус. У пациентов, страдающих ожирением, повышен риск развития гепатита при применении галотана, а употребление метотрексата или тамоксифена является независимым фактором риска развития неалкогольного стеатогепатита и фиброза печени. В то же время голодание предрасполагает к развитию гепатотоксичности при приеме парацетамола и изониазида.
Другие заболевания. Среди прочих заболеваний, при которых повышен риск развития лекарственного поражения печени, выделяют ревматоидный артрит, диабет, ожирение, хроническую почечную недостаточность, ВИЧ-инфекцию и СПИД, трансплантированную почку и ряд других.
Беременность, стресс, бедное белками питание также увеличивают риск токсичности медикаментов. Медикаменты, которые являются энзиматическими индукторами, могут потенциировать действие другого препарата. Предрасполагающие метаболические и иммунологические факторы риска могут объяснять редкие реакции идиосинкразической гепатотоксичности [15].
У онкобольных выделены следующие факторы гепатотоксичности: основной злокачественный процесс, любая локализация; первичные и метастатические злокачественные процессы в печени; фоновые неопухолевые процессы общие; фоновые неопухолевые заболевания печени (циррозы, хронические гепатиты, синдром Жильбера); дозы химиопрепаратов; пол; возраст; этнос; химиотерапия (системная, регионарная, моно-, поли-); операционный стресс; поддерживающая терапия; лучевая терапия.
До настоящего времени отсутствуют четкие критерии клинико-лабораторной и морфологической диагностики лекарственных гепатитов, недостаточно выяснены вопросы патогенеза, отсутствует единая классификация и подходы к лечению. Кроме того, до сих пор не разработаны специфические диагностические тесты медикаментозного поражения печени.
Диагностика медикаментозных гепатитов представляет сложную проблему. Предлагается несколько критериев, позволяющих уточнить диагноз и подтвердить лекарственный характер гепатита:
Хронологический критерий очень показателен, хотя время появления осложнений после приема лекарства крайне разнообразно — от нескольких дней (иногда нескольких часов) до нескольких недель и месяцев. В случае полипрагмазии хронологический фактор очень трудно оценить. Регрессирование клинических признаков осложнения после отмены лечения — довольно четкий диагностический признак. Регрессирование может быть длительным (более месяца), при этом учитывается нормализация уровня аминотрансфераз. При повторном применении лекарства, ранее уже вызвавшего гепатит, рецидив осложнения рассматривается как результат действия данного лекарства. В ряде работ указывается на необходимость дифференциальной диагностики между медикаментозными гепатитами и вирусными гепатитами, первичным билиарным циррозом печени, алкогольным гепатитом. Кроме того, важно исключить поражение печени вследствие тяжелого инфекционного заболевания, шока, сердечно-сосудистой недостаточности, глистных инвазий, заболеваний желчных путей. К исследованиям, позволяющим проводить дифференциальную диагностику лекарственного гепатита с другой возможной патологией печени, относятся биохимические исследования сыворотки крови (спектр печеночных ферментов), иммуноферментный анализ (маркеры вирусных гепатитов и опухолевого процесса) и инструментальные методы исследования (ультразвуковое исследование, компьютерная томография, лапароскопия с биопсией печени, эндоскопическая ретроградная холангиопанкреатография). Интенсивная желтушная окраска кожи и слизистых оболочек является симптомом, требующим срочной госпитализации больного для выяснения причины желтухи. Необходимость точного этиологического диагноза объясняется большим диапазоном взаимоисключающих мероприятий при желтухах различного происхождения.
Использование противоопухолевых препаратов в 40–50 % случаев сопровождается развитием гепатотоксических реакций. Предполагая гепатотоксичность ЛС, необходимо прежде всего провести исследование функциональных проб печени и правильно их интерпретировать. Наиболее часто в диагностике ЛПП приходится обращать внимание на изменение таких показателей, как трансаминазы и билирубин, поскольку доказано, что если уровень трансминазы повышен на 2–3 %, то билирубин превышает 1,5N (Hy''s Law). Подтверждением печеночно-клеточной недостаточности также будет повышение уровней трансаминаз, нарушения экскреторной функции печени — уровня билирубина, билиарной обструкции — уровня щелочной фосфатазы. Повышение уровня трансаминаз (3N или выше), билирубина и ЩФ служит основанием при совокупности анамнестических данных предположить ЛПП. Следует отметить, что у некоторых пациентов данные о ЛПП могут включать только повышение уровня билирубина без признаков билиарной обструкции (повышение уровня ЩФ).
Оптимальным считается проводить мониторинг функциональных проб печени на протяжении 2–4 недель. Существенное повышение уровней трансаминаз (в 8–10 раз и выше) требует контроля всех параметров гемостаза [16, 17].
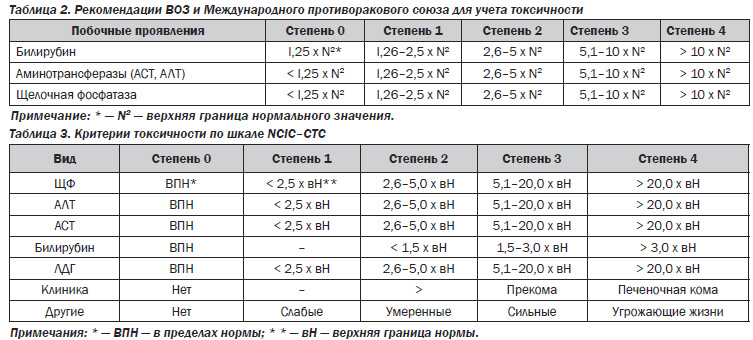
Оценка гепатотоксичности химиотерапии проводится по уровню печеночных трансаминаз, щелочной фосфатазы и билирубина в крови. Степень гепатотоксичности определяется согласно рекомендациям ВОЗ (табл. 2) и NCIC (табл. 3).
Существует совокупность критериев, руководствуясь которыми можно подтвердить медикаментозную природу нарушений функции печени. Повышение уровня трансаминаз в 3 и более раза свидетельствует о токсическом поражении печени. При лекарственном поражении печени, как правило, наблюдается соответствие временного интервала между приемом препарата и развитием гепатотоксической реакции. Длительность интервала от 5 до 90 дней с большой вероятностью указывает на лекарственную этиологию поражения. При сроке более 90 дней проявление токсичности медикаментозного происхождения сомнительно. Снижение уровня ферментов цитолиза на 50 % от исходного в течение 8 дней после отмены препарата свидетельствует в пользу возможного лекарственного повреждения печени. Снижение этого показателя в течение 30 дней характерно для гепатоцеллюлярного, 180 дней — холестатического поражения печени. Дву-кратное повышение трансаминаз в ответ на повторное введение препарата является аргументом в пользу гепатотоксичности применяемого лекарства. Повышение уровня билирубина и щелочной фосфатазы без признаков билиарной обструкции может свидетельствовать о наличии у препарата холестатического эффекта.
В России была разработана собственная шкала гепатотоксичности (А.В. Шапошников, 2004) (табл. 4).
Степень гепатотоксичности оценивалась в баллах: степень 0 = 0–3 балла; степень 1 = 3–8 баллов; степень 2 = 9–14 баллов; степень 3 = 15–20 баллов; степень 4 = 21–25 баллов.
Кроме того, существуют следующие критерии оценки лекарственных поражений печени (Guidelines in the Recognition and Prevention of Hepatotoxicity in Clinical Practic, 2001):
Установление диагноза ЛПП предполагает исключение любой другой причины, способной вызвать поражение печени (алкоголь, вирусы, аутоиммунные, холестатические, метаболические заболевания и гемодинамические расстройства). Биопсия печени не является обязательной в диагностике ЛПП, особенно тогда, когда доказана гепатотоксичность известного ранее ЛС. Однако в ситуациях, при которых имеются сомнения относительно диагноза или опасения относительно гепатотоксичности (ранее не установленной) предполагаемого ЛС, целесообразно проведение биопсии [14, 16].
Диагностика ЛПП в большинстве случаев затруднительна, особенно у пациентов, которые имеют диффузные заболевания печени. Наличие этого факта требует от врача необходимости тщательного сбора анамнеза пациента с развившимся заболеванием, хорошей ориентации в его клинических и морфологических проявлениях. При постановке диагноза ЛПП необходимо учитывать основные этапы:
Таким образом, диагноз ЛПП должен основываться на данных тщательно собранного анамнеза, результатах клинического, лабораторного и (при необходимости) морфологического исследования, однако наибольшее значение имеет положительная динамика клинических симптомов после отмены лекарственного препарата. В некоторых случаях лишь при повторном его применении удается установить лекарственную этиологию поражения печени.
В большинстве случаев острых лекарственных поражений печени отмена «причинного» препарата — достаточное условие для обратного развития патологических изменений. Однако в случае применения химиотерапии у онкологических больных отмена гепатотоксичного препарата невозможна без создания непосредственной или отсроченной угрозы для жизни пациента. В данных случаях целесообразным представляется назначение лекарственных средств, обладающих защитным действием на клетки печени.
Большое значение в решении проблемы гепатотоксичности также имеет разработка эффективных методов профилактики гепатотоксических реакций, к которым можно отнести такие:
Профилактика прогнозируемых гепатотоксических реакций должна проводиться путем дифференцированного назначения гепатопротекторных средств, что является эффективным методом снижения риска развития медикаментозных гепатитов.
Следует отметить, что даже при негативном сочетании факторов (например, пожилой возраст, наличие фоновых заболеваний печени, полифармакотерапия сопутствующей патологии, необходимость длительного назначения препаратов и т.д.) у онкологических больных остается реальная клиническая необходимость проведения адекватного лечения основного заболевания. В качестве выхода из ситуаций, когда невозможен отказ от необходимой потенциально гепатотоксической фармакотерапии, можно рассматривать сервисную гепатопротекцию. При этом гепатопротектор для сервисной терапии должен как влиять непосредственные механизмы гепатотоксического действия лекарств либо блокировать их, так и корригировать модифицируемые факторы человеческого организма, обусловливающие возникновение и степень выраженности лекарственных реакций печени.
Таким образом, возникновение побочных реакций при проведении химиотерапии у онкологических больных, в частности развитие токсического поражения печени, является актуальной проблемой как онкологии, так и гастроэнтерологии. Целью реабилитационных мероприятий при проведении химиотерапии является уменьшение токсического действия на организм химиотерапевтических препаратов при достаточной их эффективности. Исследования в этом направлении могут не только расширить границы толерантности организма к специальным методам лечения, повысить эффективность уже существующих методов химиотерапии, а также позволят при применении гепатопротекторов повысить разовые и суточные дозы химиопрепаратов с целью дальнейшего повышения эффективности лечения онкологических больных без развития побочных эффектов.
1. Peto R. The causes of cancer // European Journal of Cancer. — 1999. — Vol. 35, Suppl. 4. — Р. 125.
2. Лопаткина Т.Н., Бурневич Э.З. Лекарственные поражения печени // Врач. — 2003. — № 12. — С. 18-20.
3. Ларионова В.Б., Горожанская Э.Г., Коломейцев О.А. Гепатотоксичность лекарственных препаратов у онкологических больных // Вестн. интенсив. терапии. — 2004. — Т. 3. — С. 1-10.
4. Бабак О.Я. // Ліки України. — 2008. — № 2. — С. 96-99.
5. Городецкий В.М. Осложнения противоопухолевой терапии // Гематология и трансфузиология. — 1998. — № 1. — С. 11-15.
6. Shepherd P., Harrison D.J. Idiopathic portal hypertension associated with cytotoxic drugs // J. Clin. Pathol. — 1990. — Vol. 43. — P. 206.
7. Шерлок Ш., Дули Д. Заболевания печени и желчных путей / Под ред. З.Г. Апросиной, Н.А. Мухина. — М.: ГЭОТАР-МЕД, 2002. — С. 386-423.
8. Blake J.C., Sawyerr A.M., Dooley J.S. et al. Severe hepatitis caused by cyproterone acetate // Gut. — 1990. — Vol. 31. — P. 556.
9. Dourakis S.P., Alexopoulou A.A., Hadziyannis S.J. Fulminant hepatitis after flutamide treatment // Hepatology. — 1994. — Vol. 20. — P. 350.
10. Скрипник И.Н., Невойт А.В., Ворошилова Т.А. Медикаментозный гепатит у онкогематологических больных: патогенетические механизмы и корригирующая роль урсодезоксихолевой кислоты // Хвороби печінки в практиці клініциста: Матер. наук.-практ. конф. з міжнародною участю (Харків, 1–2.ІІІ.07). — Харків, 2007. — С. 272-273.
11. Ларионова В.Б., Горожанская Э.Г., Коломейцев О.А. Гепатотоксичность лекарственных препаратов у онкологических больных // Вестник интенсивной терапии. Интенсивная терапия в онкологии. — 2004. — №3.
12. Andrade R.J., Lucena M.I., Fernandez M.C. et al. Drug-induced liver injury: an analysis of 461 incidences submitted to the Spanish registry over a 10-year period // Gastroenterology. — 2005. — Vol. 129. — Р. 512-521.
13. Иванников И.О. Общая гепатология. — М.: Медпрактика, 2003. — 197 с.
14. Питер Р. Мак Нелли. Секреты гастроэнтерологии. — М.: ЗАО «Издательство БИНОМ»; СПб.: Невский диалект, 1999. — 1022 с.
15. Marino G., Limmerman H.J. Management of drug-induced liver disease // Cur. Gastr. Reports. — 2007. — Vol. 3. — P. 38-48.
16. McDonnell M.E., Braverman L.E., Patel K.P. et al. Drug-related hepato-toxicity // N. Engl. J. Med. — 2006. — № 354. — Р. 2191-2193.
17. Navarro V.J., Senior J.R. Drug-Related Hepatotoxicity // N. Engl. J. Med. — 2006. — № 354(7). — Р. 731-739.