Газета «Новости медицины и фармации» 7(320) 2010
Вернуться к номеру
Патогенетическое обоснование перспектив клинического использования альгинатсодержащего препарата Гавискон у пациентов с хроническим панкреатитом, сочетающимся с гастроэзофагеальной рефлюксной болезнью
Авторы: Ю.П. Успенский, И.Г. Пахомова, В.Н. Бубякина. Государственная медицинская академия им. И.И. Мечникова, г. Санкт-Петербург
Версия для печати
Широкая распространенность хронических кислотозависимых заболеваний (КЗЗ) органов пищеварения, несовершенство диагностических и лечебно-профилактических мероприятий, частое развитие серьезных осложнений, необходимость крупных финансовых ассигнований для реализации медицинских программ обусловливают актуальность данной проблемы для практического здравоохранения. Более того, феноменология данной группы заболеваний в настоящее время расширилась до качественно нового уровня, выходящего за рамки собственно гастроэнтерологии, привлекая специалистов различных направлений: кардиологов, пульмонологов, отоларингологов, хирургов и даже онкологов.
В настоящее время к КЗЗ относят сравнительно большое количество заболеваний пищеварительного тракта, в развитии и поддержании которых кислотно-пептический фактор имеет существенное значение. Среди данной группы заболеваний наиболее распространены в популяции гастроэзофагеальная рефлюксная болезнь (ГЭРБ), язвенная болезнь, неязвенная (функциональная) диспепсия, гастропатия, индуцированная приемом нестероидных противовоспалительных препаратов, синдром Золлингера — Эллисона.
Общность патогенетических механизмов формирования кислотозависимых форм патологии органов пищеварения вытекает из положения, выдвинутого известным австрийским ученым К. Schwarz (1910), которое гласит: «Без кислоты нет язвы», что с современных позиций развития гастроэнтерологии позволяет нам утверждать: «Без кислоты нет не только язвы, но и других КЗЗ». В связи с этим вполне обоснованно следует отнести к группе КЗЗ и хронический панкреатит (ХП). Теоретической базой для данного положения служат приоритетные в мировом отношении исследования сотрудников лаборатории И.П. Павлова, посвященные изучению функциональных взаимосвязей физиологической регуляции деятельности пищеварительной системы. Еще в конце XIX века И.Л. Долинским и Л.Д. Попельским была доказана тесная сопряженность между панкреатической секрецией и поступающей из желудка в двенадцатиперстную кишку (ДПК) соляной кислотой, которая является физиологическим стимулятором секреторной деятельности поджелудочной железы через образование таких гормональных субстанций, как секретин и холецистокинин [7]. Вместе с тем, несмотря на ведущую роль повреждающего действия собственно панкреатических ферментов в развитии воспалительно-дистрофических изменений pancreas, гиперсекреция соляной кислоты имеет также кардинальное значение в запуске данных патологических процессов.
Значительные успехи, достигнутые в современных диагностике и фармакотерапии, не решили проблему ХП, который остается одним из наиболее сложных разделов не только панкреатологии, но и клинической гастроэнтерологии в целом. ХП по распространенности, росту заболеваемости, временной нетрудоспособности и причине инвалидизации является актуальным как с социальной, так и с экономической позиции, что подтверждается данными эпидемиологического анализа. Так, в структуре патологии органов желудочно-кишечного тракта он занимает от 5,1 до 9 %, а в общей клинической практике — от 0,2 до 0,6 % [14]. Сохраняется общемировая тенденция к увеличению заболеваемости острым и хроническим панкреатитом, а в России драматичность ситуации обусловлена ростом распространенности ХП не только среди взрослых (27,4–50 случаев на 100 тысяч населения), но и среди подростков и лиц молодого возраста [16].
Вместе с тем клинико-социальная значимость прогредиентного течения данного страдания проявляется в его крайне негативном влиянии на качество жизни пациентов. Известно, что в большинстве случаев ХП имеет прогрессирующее течение с постепенным нарастанием внешнесекреторной недостаточности поджелудочной железы, стойкой персистенцией болей, когда больным необходимо строгое, зачастую пожизненное соблюдение диеты, постоянное медикаментозное лечение. Чрезвычайно высокое клиническое значение ХП неотъемлемым образом связано с риском развития осложнений, при которых летальность составляет до 5,5 % [17].
Особенности клинического течения хронического панкреатита часто определяются его сочетанием с другими заболеваниями в условиях полиморбидности современного пациента. Данного рода сочетания, как правило, способствуют большей торпидности клинического течения панкреатита и нередко — росту числа осложнений. Так, по данным проведенного нами исследования установлено, что ХП, сочетающийся с гипертонической болезнью (ГБ), по сравнению с изолированной формой заболевания характеризуется большей выраженностью болевого абдоминального и диспептического синдромов с тенденцией к более длительным обострениям и более низкой эффективностью базисной терапии [18]. Сопутствующие ХП обструктивные заболевания легких на фоне ухудшения вентиляции и газообмена, нарушения гемостаза также влияют на клиническое течение и рецидивы ХП [9]. Особенностью клинического течения ХП в сочетании с ИБС является синдром гипервязкости крови, который сопровождается систолодиастолической дисфункцией желудочков сердца, формированием умеренной легочной гипертензии и умеренным нарушением газового состава крови, что приводит к нарушениям в системе гемостаза и развитию ишемии и фиброза ткани ПЖ, ухудшению состояния больного и снижению его качества жизни [9].
Данный факт распространяется и на совместное течение заболеваний органов пищеварения. Так, в условиях сочетания ХП и язвенной болезни двенадцатиперстной кишки либо ХП и хронического холецистита (как калькулезного, так и бескаменного) существенно отягощается течение патологического процесса [1, 9]. При этом повышается риск развития осложнений (гастродуоденальное кровотечение и т.д.).
По данным исследований последних лет, нередко встречается сочетанное течение ХП и ГЭРБ [5, 8]. При этом на фоне обострения панкреатогенной патологии достаточно часто игнорируется симптоматика ГЭРБ, что, безусловно, не только отражается на качестве лечения данной категории больных, но и затрагивает социально-экономические аспекты проблемы сочетанных заболеваний. А между тем за последние десятилетия клинико-эпидемиологическая структура ГЭРБ приобрела актуальное широкомасштабное в мировом отношении значение, обусловленное не только расширением жалоб внепищеводного характера, но и ростом таких осложнений, как пищевод Барретта и аденокарцинома пищевода. Так, изжога, которая является наиболее часто встречающимся симптомом ГЭРБ, ухудшает качество жизни у 60 % европейских респондентов [12], при этом степень снижения качества жизни сопоставима с таковой у больных ишемической болезнью сердца, артериальной гипертензией и язвенной болезнью [11]. А по результатам российских исследований, проведенных в Новосибирске, Санкт-Петербурге и Красноярске, было отмечено, что от изжоги страдают около 60 % жителей Новосибирска и примерно 46 % жителей Санкт-Петербурга и Красноярска [12].
Вместе с тем наряду с высокой распространенностью ГЭРБ в российской популяции достаточно значимыми являются плохая осведомленность больных о наличии у них заболевания, неадекватное назначение лекарственной терапии и катастрофически низкая ее эффективность.
Учитывая вышеперечисленные клинико-эпидемиологические данные о заболеваемости ХП и ГЭРБ, можно сказать, что проблема сочетанного течения двух указанных заболеваний весьма актуальна как в плане ранней инвалидизации и снижения трудоспособности данной категории больных, так и возможной интерференции основных предикторов, отражающих риск фатальных исходов.
Среди возможных патогенетических аспектов формирования сочетанной патологии в рамках ХП и ГЭРБ, включающих дуоденостаз, нарушение моторики верхних отделов пищеварительного тракта и т.д., значительное место занимает состояние гиперацидности. Нами уже упоминалось, что и ГЭРБ, и ХП в настоящее время рассматриваются как кислотозависимые заболевания, при которых факторы агрессии желудочного содержимого, в частности соляная кислота, имеют важные, а в ряде случаев — приоритетные позиции. По данным Н.Б. Губергриц и соавт., практически у всех пациентов, страдающих ХП, выявляется эзофагит той или иной степени выраженности [8].
Учитывая кислотозависимый характер данных заболеваний, вполне логичным представляется использование препаратов, действие которых направлено на нейтрализацию или подавление выработки соляной кислоты париетальными клетками. Поэтому антисекреторные средства являются важной составляющей комплексной терапии пациентов с ХП, обеспечивая физиологический покой органа. Вместе с тем лечение ХП с проявлением абдоминальной боли и экзокринной недостаточности поджелудочной железы является нелегкой задачей как в силу объективных трудностей, связанных с многофакторностью патогенетических механизмов их формирования, так и вследствие широкого диапазона возможностей выбора оптимальной схемы лечения или наиболее эффективного препарата. Современные публикации отмечают, что «уменьшения... болевых ощущений можно достичь... опосредованно через ингибирование синтеза соляной кислоты» [15]. Кроме того, было отмечено повышение эффективности ферментных препаратов в лечении ХП при добавлении к стандартному лечению панкреатином антисекреторных средств [11].
Современные основные принципы лечения ГЭРБ были сформулированы в рекомендациях, разработанных на конгрессе в г. Генвале, основным направлением которых является использование препаратов антисекреторного действия по принципу терапии step down [21]. В настоящее время лидирующие позиции в терапии ГЭРБ независимо от клинико-эндоскопического варианта занимают ингибиторы протонного насоса, которые эффективно подавляют выработку хлористоводородной кислоты в желудке, способствуя тем самым поддержанию уровня интрапищеводного рН более 4 в течение длительного периода времени.
Однако, несмотря на доказанные возможности ингибиторов протонного насоса в достижении выраженной и длительной кислотосупрессии, способности ускорять консолидацию ремиссии при кислотозависимых заболеваниях, следует полагать, что мощное подавление секреции соляной кислоты не всегда целесообразно и обосновано, особенно при лечении пациентов с ХП. Известно, что длительное рецидивирующее течение ХП приводит к развитию дистрофических, а в дальнейшем и атрофических изменений слизистой двенадцатиперстной кишки, проявляющихся дефицитом выработки гастроинтестинальных гормонов (секретина и холецистокин-панкреозимина), обусловливая дуоденостаз, спастическую дисфункцию сфинктера Одди, увеличение давления в панкреатических протоках, снижение объема панкреатического сока за счет жидкой части и секреции бикарбонатов. В результате данного каскада реакций происходит закупорка различных отделов панкреатических протоков белковыми преципитатами, провоцируя обострение хронического панкреатита с развитием болевого абдоминального синдрома, а по мере прогрессирования патологического процесса — и экзокринной недостаточности поджелудочной железы [3].
В условиях интенсивной и особенно длительной кислотосупрессии (при лечении язвенной болезни или ГЭРБ) формирующаяся гипохлоргидрия уже на уровне желудка приводит к нарушению активации пепсиногена в пепсин (оптимальный рН = 1–3). В результате нарушается начальный этап переваривания белков — разрыв связей между ароматическими аминокислотами, что затрудняет дальнейший процесс протеолиза поли- и олигопептидов, поступивших в двенадцатиперстную кишку с неразрушенными пептидными связями, приводящий к большей стимуляции выработки секретина и холецистокинина и повышению вязкости панкреатического сока, снижению выработки ферментов pancreas и как следствие — к усилению болевого синдрома и усугублению панкреатической недостаточности.
Вместе с тем важно отметить, что выраженное подавление выработки соляной кислоты не только оказывает отрицательное влияние на желудочную фазу пищеварения и нормальное течение процессов интрагастрального протеолиза, но и вызывает при длительном использовании препаратов ряд нежелательных побочных эффектов в виде гиперплазии париетальных клеток, гистаминпродуцирующих клеток гастроинтестинальной APUD-системы, гипергастринемии, появления или усиления метеоризма и диареи и т.д. Усугубление последних актуально у пациентов, страдающих ХП, особенно при длительном течении и частых рецидивах заболевания.
Применение Н2-гистаминоблокаторов достаточно часто обусловливает такие побочные эффекты, как синдром рикошета или синдром отмены, что также ограничивает их использование для длительной терапии пациентов.
Антацидные средства на современном этапе развития гастроэнтерологии остаются в арсенале группы лекарств по требованию и почти не используются для систематического курсового лечения пациентов ввиду коротких временных рамок действия данных препаратов.
Что касается ГЭРБ, то наличие данного заболевания требует, согласно общепринятым стандартам лечения, длительного назначения антисекреторной терапии мощными кислотосупрессивными препататами. Однако и здесь все далеко не так однозначно, так как назначение, в частности, ингибиторов протонного насоса для лечения эндоскопически негативной ГЭРБ не всегда оправдано, поскольку наряду с кислотоагрессией забрасываемого в пищевод желудочного сока у пациентов может иметь ведущее значение нарушение кинетических свойств верхних отделов пищеварительной трубки, проявляющихся в расстройствах как первичной, так и вторичной (а порой и третичной) перистальтики пищевода [6]. Данный факт подтверждается положительной клинической динамикой на фоне лечения прокинетиками [13]. Динамика подобной направленности отмечается и при терапии внепищеводных проявлений ГЭРБ [2].
Кроме того, в ряде случаев ГЭРБ развивается на фоне патологического рефлюкса щелочного желудочного содержимого в пищевод, для уменьшения агрессивных свойств которого с целью связывания желчных кислот и лизолицетина необходимо назначение антацидов, энтеросорбентов либо препаратов урсодезоксихолевой кислоты [4].
Актуальность проблемы сочетанных заболеваний обусловлена определенными трудностями не только в диагностике, но и в подборе качественной и оправданной терапии, поскольку вероятность развития побочных эффектов зависит и от числа принимаемых лекарственных препаратов [20]. В связи с этим одним из наиболее важных вопросов лечения больных с сочетанием ХП и ГЭРБ является проблема преодоления полипрагмазии, особенно актуальной в терапии лиц пожилого возраста. При этом в условиях российской действительности необходимо принимать во внимание факт выбора лекарственных препаратов с учетом не только клиническо-патогенетических, но и социально-экономических факторов. Следовательно, речь должна идти о назначении препаратов с суммационным клиническим эффектом.
Примером такого подхода в гастроэнтерологии может являться новый для российского фармацевтического рынка препарат Гавискон, свойства которого многогранны и обусловлены наличием в его составе основного компонента — альгиновой кислоты, представленной в виде альгината натрия, а также гидрокарбоната калия, выполняющего роль связующего звена, и ряда вспомогательных компонентов.
Основной механизм действия Гавискона — антирефлюксный, который заключается в формировании барьера-плота, предупреждающего заброс содержимого желудка в пищевод. При этом гидрокарбонат калия, являясь источником СО2, придает плоту «плавучесть», тогда как карбонат кальция связывает друг с другом длинные молекулы альгината для укрепления образовавшегося защитного барьера. Антирефлюксные свойства Гавискона можно назвать в некотором роде универсальными не только по силе значимости и временному интервалу, но и по качественным характеристикам. Создавая защитный барьер на поверхности желудочного содержимого, Гавискон способен значительно и длительно (более 4,5 ч) уменьшать количество как патологических гастроэзофагеальных рефлюксов, так и дуоденогастроэзофагельных, создавая тем самым условия физиологического покоя для слизистой оболочки пищевода. Вместе с тем содержащийся в Гависконе альгинат обусловливает также сорбционные свойства в отношении желчных кислот и лизолецитина, что уменьшает риск развития и прогрессирования антрального рефлюкс-гастрита и обеспечивает протекцию щелочного рефлюкса дуоденального и желудочного содержимого в пищевод. Наш клинический опыт показал, что применение суспензии Гавискон форте в течение 14 дней значительно уменьшает процент времени с интрагастральным рН менее 2 в ночные часы у большинства пациентов с ГЭРБ (рис. 1).
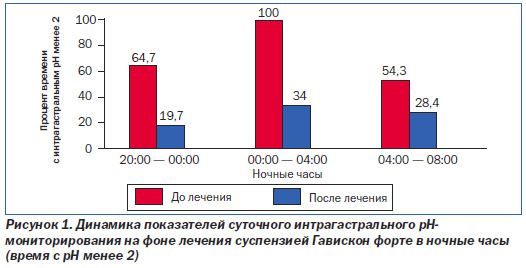
При оценке динамики показателей интрапищеводного рН на фоне лечения суспензией Гавискон форте антирефлюксные свойства последнего проявились в полной мере. Так, процент суточного времени с рН < 4 в пищеводе уменьшился с 12,7 до 4,3. Общее число рефлюксов со 161 сократилось до 52,2, а количество рефлюксов длительностью более 5 минут — с 5 до 1,8. Самый длинный рефлюкс при этом сократился вдвое.
Важно отметить значительное, вплоть до полного исчезновения, снижение частоты эпизодов изжоги, которое было зарегистрировано уже на 2-й день лечения, а концу терапии данный симптом был полностью купирован. Проявления желчного рефлюкса также регрессировали к окончанию терапии. Отдельно хотелось бы отметить почти полное купирование эпигастральных болей, которые имели место у ряда пациентов.
Однако перечисленные клинико-фармакологические возможности Гавискона были продемонстрированы в лечении больных с ГЭРБ. В связи с этим возникает вопрос: является ли данный препарат одним из средств выбора лекарственной терапии при сочетанном течении ГЭРБ и ХП?
Ответом может послужить тот факт, что, с одной стороны, Гавискон подобно антацидам не влияет на механизмы выработки соляной кислоты в желудке, обеспечивая лишь нейтрализацию последней. При этом образуется гель, который обволакивает слизистую оболочку желудка, предохраняя ее от дальнейшего воздействия соляной кислоты и пепсина. Однако, с другой стороны, согласно многочисленным литературным свидетельствам, данная группа альгинатсодержащих препаратов подобно секретолитическим средствам обладает существенными временными рамками для поддержания интрагастрального рН > 4 ед., что является неотъемлемым условием достижения клинико-эндоскопической ремиссии ХП.
Однако, кроме этого, существуют и другие перспективные, требующие дальнейшего изучения патогенетические обоснования использования Гавискона в лечении больных ХП в связи с облигатным развитием у них дисбиоза кишечника [10, 19]. О заселении у больных ХП верхних отделов желудочно-кишечного тракта различными микроорганизмами, в частности стрептококками, молочнокислыми и другими бактериями, было известно сравнительно давно [10, 22], как и о развитии признаков дисбиоза у больных с обострением ХП, которые характеризуются снижением бифидобактерий и лактобактерий, увеличением общего числа аэробной флоры, в том числе кишечной палочки с патогенными свойствами и энтерококков. Изменение состава нормальной кишечной микрофлоры ведет к размножению патогенных и гнилостных микробов, резко снижается витаминообразующая и ферментативная функция сапрофитной микрофлоры. С изменениями качественного и количественного состава микробиоценоза кишечника связаны нарушения моторики и пищеварения у больных ХП, развитие синдромов мальабсорбции и мальдигестии. Интерференция указанных проявлений с признаками внешнесекреторной недостаточности при ХП приводит к развитию кишечной диспепсии, иммунным нарушениям с появлением аутоантител к слизистой оболочке кишечника, прогрессированию и хронизации процесса расстройства обмена веществ. Изменения иммунитета при дисбактериозе вторично могут поддерживать основное заболевание, создается «порочный круг» с постоянной сменой причинно-следственных связей. Прогрессирование дисбиотических расстройств, как правило, связано с изменениями микробно-тканевого комплекса слизистой оболочки и вовлечением в патологический процесс не только толстой, но и тонкой кишки. Нарушение кишечного микробиоценоза развивается как за счет имеющейся внешнесекреторной недостаточности pancreas, изменяющей оптимальные для сапрофитной флоры условия эндоэкологии, так и вследствие развития моторно-эвакуаторных нарушений кишечника.
В связи с этим представляется актуальным отметить пребиотические свойства альгинатов, которые позволяют использовать их в целях коррекции различных нарушений микробиоценоза кишечника. Было установлено, что альгинаты способствуют поддержанию оптимального качественного и количественного состава кишечных микроорганизмов за счет увеличения содержания облигатных (бифидобактерии, лактобациллы) и уменьшения — условно-патогенных и патогенных бактерий, таких как стафилококки, грибы рода Candida и др. Кроме того, известно, что натриевая и кальциевая соли альгиновой кислоты уменьшают чрезмерную перистальтику кишечника.
Как известно, терапия пациентов, страдающих ХП, основана на комплексном лечебном подходе, включающем в большинстве случаев полиферментные препараты, а при необходимости — обезболивающие и спазмолитические средства. В связи с этим нельзя не отметить положительно и тот факт, что Гавискон не влияет на фармакокинетику совместно принимаемых лекарственных препаратов. Кроме того, хорошо доказанной является фармакологическая совместимость альгинатов с антисекреторными препаратами, в частности с ингибиторами протонной помпы, что создает реальные возможности для реализации их аддитивного эффекта, особенно в случаях необходимости выраженного подавления кислотопродукции в желудке (язвенная болезнь, эрадикация инфекции Н.pylori). В лечении ХП данные сочетания препаратов актуальны в случаях совместного течения более двух кислотозависимых заболеваний, например ХП, ГЭРБ и язвенной болезни.
Таким образом, все вышеизложенные обстоятельства позволяют сделать вывод о том, что препарат Гавискон, проявляя высокую эффективность в купировании симптомов ГЭРБ, способен также оказать положительное клиническое и метаболическое действие при сочетании ГЭРБ с ХП, что позволяет расценивать перспективы его использования у данной весьма распространенной категории пациентов как весьма заманчивые.
Впервые опубликовано в «Русском медицинском журнале», 2007, т. 15, № 28
1. Баранов С.А. Некоторые из основных механизмов патогенеза хронического панкреатита при желчнокаменной болезни // Клин. мед. — 1988. — Т. 66, № 6. — С. 26-29.
2. Белоусова Ю.Б., Леонова М.В. Основы клинической фармакологии и рациональной фармакотерапии: Руководство для практич. врачей. — М.: Бионика, 2002. — Т. 1. — 510 с.
3. Богер М.М. Панкреатиты. — Новосибирск: Наука, 1984. — 198 с.
4. Буеверов О.А., Лапина Т.А. Дуоденогастроэзофагеальный рефлюкс как причина рефлюкс-эзофагита // Фарматека. — 2006. — № 1. — С. 22-27.
5. Васильев Ю.В., Машарова А.А., Янова О.Б. Гастроэзофагеальная рефлюксная болезнь, сочетающаяся с хроническим панкреатитом и язвенной болезнью // Клинико-эпидемиологические и этно-экологические проблемы заболеваний органов пищеварения. — Красноярск, 2005. — С. 18-19.
6. Гриневич В.Б., Саблин О.А. Гастроэзофагеальная рефлюксная болезнь и ее внепищеводные проявления: современные представления о диагностике и лечении. — СПб.: Береста, 2004. — 170 с.
7. Гриневич В.Б., Успенский Ю.П., Ласый В.П., Пахомова И.Г. Клиническое обоснование применения и эффективность нексиума в комплексной терапии хронического панкреатита // Гастроэнтерология. — СПб., 2002. — № 1. — С. 20-22.
8. Губергриц Н.Б., Крюк Н.А. Особенности лечения больных хроническим панкреатитом в сочетании с гастроэзофагеальной рефлюксной болезнью // Гастоэнтерол. СПб. — 2007. — № 1–2. — С. 114.
9. Губергриц Н.Б., Христич Т.Н. Клиническая панкреатология. — Донецк: Лебедь, 2000. — 412 с.
10. Златкина А.Р. Современные подходы к коррекции дисбиоза кишечника // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 1999. — Т. 9, № 3. — С. 64-67.
11. Калинин А.В. Нарушение полостного пищеварения и его медикаментозная коррекция // Клинические перспективы гастроэнтерологии, гепатологии. — 2001. — № 3. — С. 13-17.
12. Маев И.В., Вьючнова Е.С., Щекина М.И. Гастроэзофагеальная рефлюксная болезнь // Лечащий врач. — 2004. — № 4. — С. 21-33.
13. Маев И.В., Балашова Н.Н. Современные аспекты терапии гастроэзофагеальной рефлюксной болезни // Экспер. и клин. гастроэнтерол. — 2003. — № 1. — С. 5-11.
14. Маев И.В., Казюлин А.Н., Кучерявый Ю.А. Хронический панкреатит. — М.: Медицина, 2005.
15. Маев И.В., Казюлин А.Н., Самсонов А.А., Кучерявый Ю.А. Хронический панкреатит (алгоритм диагностики и лечебной тактики): Пособие для врачей общей практики, терапевтов, гастроэнтерологов: Учебное пособие. М.: ГОУ ВУНМЦ МЗ и СР РФ, 2006. — 104 с.
16. Минушкин О.Н. Хронический панкреатит // Терапевт. архив. — 2001. — Т. 73, № 1. — С. 62-65.
17. Нестеренко Ю.А. Хронический панкреатит. — М.: Мокеев, 2000. — С. 5-20.
18. Пахомова И.Г. Клинико-психосоматические особенности и качество жизни больных рецидивирующей формой хронического панкреатита, сочетающегося с гипертонической болезнью: Автореф. дис... канд. мед. наук. — СПб., 2003. — 23 с.
19. Румянцев В.Г. Дисбактериоз кишечника: клиническое значение и принципы лечения // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 1999. — Т. 9, № 3. — С. 61-63.
20. Успенский Ю.П. Проблема сочетанной патологии в клинике гастроэнтерологии: возможности преодоления полипрагмазии // Гастроэнтерол. Спб. — 2005. — № 3–4. — С. 33-36.
21. Dent J., Brun J., Fendrick A. et al. An evidence-based appraisal of reflux disease management // Genval Workshop Report. — 1999. — Vol. 44, Suppl. 2. — Р. 1-16.
22. Pulverer G., Lioe Ko H., Beuth J. Mikroflora-associated defense stimulating factors // Scand. J. Gastroenterol. — 1997. — Vol. 32, Suppl. 222. — P. 107-111.
23. Wiklund I. Review of the quality of life and burden of illness in gastroesophageal reflux disease // Dig. Dis. — 2004. — Vol. 22. — P. 108-114.
