Газета «Новости медицины и фармации» Дерматология (319) 2010 (тематический номер)
Вернуться к номеру
Гуморальные факторы нейтрализации бактериальных липополисахаридов у больных псориазом с инсулинорезистентностью
Авторы: О.А. Притуло, Крымский государственный медицинский университет им. С.И. Георгиевского, г. Симферополь
Версия для печати
Актуальность темы
Являясь генетически детерминированным заболеванием, псориаз характеризуется гиперпролиферацией эпидермальных клеток, нарушением дифференцировки кератиноцитов, нарушением иммунной системы с образованием иммунозависимых цитокинов и медиаторов, индуцирующих воспалительную реакцию в дерме.
Одним из основных патогенетических звеньев в иммунных изменениях является девиация цитокинового профиля по пути Th1-типа, при этом наряду с повышением уровня IL-1α, IL-2, IL-6, IL-7, IL-8 и INF-γ ведущую роль играет повышение уровня TNF-α [2, 12]. Спровоцировать появление первых признаков псориаза и способствовать обострению заболевания может также наличие инфекционных заболеваний и очагов хронической инфекции [6, 20, 22], что связывают с дисбалансом гуморальных факторов нейтрализации бактериальных липополисахаридов (ЛПС) в организме, к которым относятся и антиэндотоксиновые антитела [13]. Особая роль в этом процессе принадлежит поливалентным низкоаффинным антителам класса М [5]. По уровню антител к ЛПС возможно судить, с одной стороны, о поступлении его во внутреннюю среду организма, с другой — о способности организма формировать адекватный иммунный ответ, направленный на элиминацию чужеродной субстанции экзогенного или эндогенного происхождения [15]. Указанные факты позволяют утверждать, что изучение дисбаланса цитокинового гомеостаза и содержания секреторных и сывороточных антител к ЛПС представляется важным шагом к пониманию патогенетической сущности псориаза. Еще одним существенным фактором, способствующим развитию дисбаланса противоинфекционного иммунитета, является метаболический синдром (МС), формирующий повышенный риск развития широкого спектра как инфекционных, так и дерматологических заболеваний, включая псориаз [19]. Вместе с тем подавляющее большинство научных публикаций не касаются патофизиологических аспектов ассоциации МС (инсулинорезистентности, ожирения) и псориаза, а представляют собой эпидемиологические исследования, указывающие на более высокий риск развития псориаза (и других заболеваний кожи) у больных с МС и ожирением [14, 17, 18, 21]. T. Henseler и E. Christophers (1998) постулируют генетическую детерминацию ассоциации переедания, ожирения, сахарного диабета, ишемической болезни сердца, иммунного дисбаланса, а также предрасположенности к псориазу и кожным инфекционным болезням [18]. Основной целью исследования явилось научное обоснование целесообразности коррекции иммунного дисбаланса в комплексном лечении псориаза у больных с инсулинорезистентностью (МС).
В настоящей работе нами предпринята попытка подойти к проблеме расшифровки патогенетических особенностей течения псориаза с позиции комплексной оценки особенностей системы гуморальных факторов нейтрализации бактериальных ЛПС и цитокинового профиля, протекающим в сочетании с МС.
Материал и методы
Под наблюдением состояло 94 больных псориазом, разделенных на 2 группы: 1-ю группу составили 38 больных псориазом без клинико-лабораторных симптомов МС, во 2-ю группу вошли 56 больных псориазом, протекающим на фоне МС. Группу контроля составили 28 здоровых доноров. Для диагностики МС использованы общепринятые критерии Международной диабетической федерации [7, 10]. Концентрацию цитокинов в сыворотке крови определяли иммуноферментным методом с использованием коммерческих наборов (ООО «Цитокины»); оценка результатов осуществлялась фотометрически. Для оценки общего гуморального антиэндотоксинового иммунитета [1, 8, 9, 11] определяли содержание сывороточных антиэндотоксиновых антител к ЛПС грамотрицательной энтеробактерии Escherichia coli K30 (О9 : К30 : Н12) и гликолипиду Salmonella minnesota Re595 методом тИФА [3, 4]. Оптическую плотность конечного продукта ферментативной реакции определяли иммуноферментным анализатором при длине волны 492 нм, уровни антиэндотоксиновых антител выражали в условных единицах оптической плотности.
Результаты и обсуждение
Результаты исследования уровня провоспалительных цитокинов в периферической крови у больных 1-й и 2-й групп представлены в табл. 1.
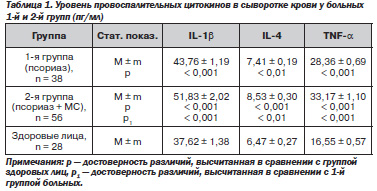
Анализ представленного в табл. 1 цифрового материала свидетельствует, что повышение уровней IL-1β в системном кровотоке выявлено у больных псориазом всех исследованных групп. При этом если у больных 1-й группы исследованный показатель повышен на 16,3 % (р < 0,001), то у больных 2-й группы — на 37,8 % (р и р1 < 0,001), что также статистически значимо выше, чем у больных 1-й группы. Уровень IL-4 в сыворотке крови у больных 1-й группы повышен на 14,5 % (р < 0,01), у больных 2-й группы — на 31,8 %
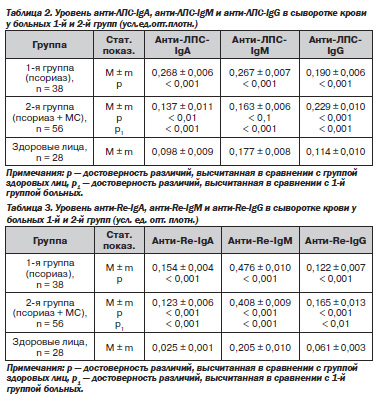
(р < 0,001), что также достоверно ниже (р1 < 0,01), чем у больных 1-й группы. У больных 1-й группы выявлено также повышение уровня цитокина TNF-α на 71,4 %, р<0,001), у больных 2-й группы — на 100,4 %, (р и р1 < 0,001). Результаты исследования уровня анти-ЛПС-IgА, анти-ЛПС-IgМ и Анти-ЛПС-IgG в сыворотке крови у больных 1-й и 2-й групп представлены в табл. 2.
Значение системной эндотоксинемии в патогенезе псориаза подчеркивается в работах начиная с 80-х годов ХХ века [16]. В последующие годы развитие концепции патогенетической роли бактериальных липополисахаридов при псориазе связано как с развитием идеи инфекционно-зависимого дебюта заболевания (прежде всего — при псориазе II типа), так и с разработкой научного направления, согласно которому кишечные эндотоксины выступают в роли системных стимуляторов синтеза цитокинов [2, 12]. Нами установлено, что у больных 1-й и 2-й групп имеет место статистически значимое повышение уровня анти-ЛПС-IgA в системном кровотоке. Вместе с тем у больных псориазом выявлено зависимое от наличия инсулинорезистентности снижение исследованного показателя: у больных 2-й группы — на 48,9 % (р1 < 0,001) ниже, чем у больных 1-й группы. Уровень анти-ЛПС-IgМ у больных 1-й группы на 50,8 % (р < 0,001) выше диапазона физиологических колебаний данного показателя. У больных 2-й группы выявлен относительный дефицит основного фактора нейтрализации ЛПС — анти-ЛПС-IgM: показатель существенно не отличается от соответствующего показателя в контрольной группе лиц. Течение псориаза характеризуется также возрастанием уровня анти-ЛПС-IgG в сыворотке крови на 66,7 % (р < 0,001) у больных 1-й группы и на 100,9 % (р < 0,001) у больных 2-й группы. Обращает на себя внимание, что наличие у больных псориазом инсулинорезистентности характеризуется возрастанием уровня анти-ЛПС-IgG в сыворотке крови на 20,5 % (р1 < 0,001) в сравнении с больными 1-й группы. Нами определялись также сывороточные антиэндотоксиновые антитела к гликолипиду Salmonella minnesota Re595. Результаты исследования уровней антител к Re-мутанта S.minnesota в общем кровотоке у больных 1-й и 2-й групп представлены в табл. 3.
При исследовании уровня анти-Re-антител класса А в кровотоке у больных псориазом установлено (табл. 3), что статистически значимое возрастание (в 6,2–4,9 раза, р < 0,001) указанного показателя является общей особенностью течения болезни и зависит от наличия инсулинорезистентности: при эндокринопатии показатель снижается на 20,1 % (р1 < 0,001). Уровень анти-Re-антител класса М в системном кровотоке у больных 1-й и 2-й групп повышен в 2,3–2,0 раза (р < 0,001). Также установлено, что обнаруженный нами у больных 2-й группы наиболее выраженный дефицит основного фактора нейтрализации ЛПС — анти-ЛПС-IgM сочетается с наиболее выраженным дисбалансом анти-Re-антител того же класса. Течение псориаза характеризуется статистически значимым возрастанием уровня анти-Re-антител класса G: у больных 1-й и 2-й групп — соответственно в 2,0 (р < 0,001) и 2,7 раза (р < 0,001). При этом у больных 2-й группы показатель на 35,2 % (р1 < 0,01) выше, чем у больных 1-й группы.
Выводы
Особенностью патогенеза псориаза является повышенный синтез провоспалительных цитокинов IL-1β, TNF-α и лимфокина IL-4. Наличие у больных псориазом метаболического синдрома характеризуется статистически значимым увеличением системного провоспалительного цитокинового потенциала. У больных псориазом обнаружен зависимый от наличия инсулинорезистентности дефицит основного фактора нейтрализации ЛПС — анти-ЛПС-IgM, сочетающийся с дисбалансом в системе анти-Re-антител того же класса, а также антител классов А и G.
1. Варбанец Л.Д. Эндотоксины грамотрицательных бактерий: структура и биологическая роль // Мікробіол. журнал. — 1994. — Т. 56, № 3. — С. 76-97.
2. Владимиров В.В., Меньшикова Л.В. Современные представления о псориазе и методы его лечения // Русский медицинский журнал. — 2001. — Т. 6, № 20. — С. 1318-1323.
3. Гордиенко А.И., Бакова А.А., Химич Н.В., Белоглазов В.А. Уровни естественных антител к липополисахаридам энтеробактерий у постоянных доноров республики Крым // Iмунологiя та алергологiя. — 2003. — № 4. — С. 31-36.
4. Гордиенко А.И., Чемоданова Е.И., Притуло О.А., Химич Н.В. Сравнительный анализ состояния антиэндотоксинового иммунитета и его взаимосвязи с уровнями аутоантител к однонитевой и двунитевой ДНК у больных красной волчанкой // Iмунологiя та алергологiя. — 2003. — № 3. — С. 41-48.
5. Дранник Г.Н. Клиническая иммунология и аллергология. — Одесса: Астроприн, 1999. — 604 с.
6. Олисова О.Ю. Современные подходы к ведению больных псориазом // Русский мед. журнал. — 2004. — Т. 12, № 4. — С. 65-69.
7. Чазова И.Е., Мычка В.Б. Метаболический синдром. — М.: Медиа Медика, 2004. — 168 с.
8. Шенкман Б.З., Грачева Н.В. Бактериальные эндотоксины и заболевания органов пищеварительной системы // Казанский мед. журнал. — 1989. — Т. 70, № 4. — С. 303-306.
9. Яковлев М.Ю., Лиходед В.Г., Аниховская И.А. Эндотоксининдуцированные повреждения эндотелия // Архив патологии. — 1996. — Т. 58, № 2. — С. 41-45.
10. Atkins J.D. Stress and metabolic syndrom. // British. Med. J. — 2006. — Vol. 4. — Р. 123-128.
11. Bayston E., Cohen J. Bacterial endotoxin and current concepts in the diagnosis and treatment of endotoxaemia // J. Med. Microbiol. — 1998. — Vol. 31, № 1. — P.73-83.
12. Bonifati C., Ameglio F. Cytokines in psoriasis // Int. J. Dermatol. — 1999. — Vol. 38. — P. 241-251.
13. Christophers E. Psoriasis — epidemiology and clinical spectrum // Clin. Exp. Dermatol. — 2001. — Vol. 26. — P. 314-320.
14. Ucak S., Ekmekci Tr., Basat O. et al. Comparison of various insulin sensivity indices in psoriatic patients and their relationship with type of psoriasis // J. European Acad. Dermatol. Venereol. — 2006. — Vol. 20(5). — P. 517-522.
15. Differential Release and Impact of Antibiotic-Induced Endotoxin // Ed. Eugen Faist. — New York: Raven-Press, 1995. — 336 р.
16. Belew P.W., Rosenberg E.W., Skinner R.B., Marley W.M. Endotoxemia in psoriasis // Arch. Dermatol. — 1982. — Vol. 118(3). — P. 142-145.
17. Hahler B. An overview of dermatological conditions commonly associated with the obese patient // Ostomy Wound Manage. — 2006. — Vol. 52(6). — P. 34-40.
18. Henseler T., Christophers E. Disease concomitance in psoriasis // J. Am. Acad. Dermatol. — 1995. –Vol. 32(6). — P. 982-986.
19. Sommer D.M., Jenisch S., Suchan M. et al. Increased prevalence of the metabolic syndrome in patients with moderate to severe psoriasis // Arch. Dermatol. Res. — 2006. — Vol. 298(7). — P. 321-328.
20. Rotsztejn H., Zalewska A., Trznadel-Budzko E., Lewkowicz P. et al. Influence of systemic photochemotherapy on regulatory T cells and selected cytokine production in psoriatic patients: a pilot study // Med. Sci. Monit. — 2005. — Vol. 11(12). — P. 594-598.
21. Romano G., Moretti G., Di Benedetto A. et al. Skin lesions in diabetes mellitus: prevalence and clinical correlations // Diabetes. Res. Clin. Pract. — 1998. — Vol. 39. — P. 101-106.
22. Austin L.M., Ozawa M., Kikuchi T., Walters I.B., Krueger J.G. The majority of epidermal T cells in Psoriasis vulgaris lesions can produce type 1 cytokines, interferon-gamma, interleukin-2, and tumor necrosis factor-alpha, defining TC1 (cytotoxic T lymphocyte) and Th1 effector populations: a type 1 differentiation bias is also measured in circulating blood T cells in psoriatic patients // J. Invest. Dermatol. — 1999. — Vol. 113(5). — P. 752-759.
