Газета «Новости медицины и фармации» Пульмонология (318) 2010 (тематический номер)
Вернуться к номеру
Остеопороз и хроническое обструктивное заболевание легких
Авторы: А.В. Глухов, Н.Е. Моногарова, Н.С. Кабанец, Т.В. Кугаевская, А.Т.А. Ле, И.Ю. Чибисова. Донецкий национальный медицинский университет им. Горького, кафедра внутренней медицины им. проф. А.Я. Губергриц,
Донецкое областное клиническое территориальное медицинское объединение (пульмонологическое отделение)
Версия для печати
Особенности ведения пациентов с хроническим обструктивным заболеванием легких (ХОЗЛ) определяются различной внелегочной патологией этих больных. Трактовка имеющейся внелегочной патологии не всегда бывает однозначной с точки зрения ее патогенетической связи с ХОЗЛ, поскольку многим больным (особенно старческого возраста) свойственна сочетанность заболеваний. В данной статье рассматривается одна из важных современных медико-социальных проблем остеопороза (ОП) в свете сочетания данного заболевания с ХОЗЛ.
Хроническое обструктивное заболевание легких — болезнь, поддающаяся профилактике и лечению, характеризующаяся ограничением воздушного потока через дыхательные пути, которое не является полностью обратимым. Нарушение проходимости дыхательных путей, как правило, прогрессирует и связано с патологическим воспалительным ответом легких на воздействие вредных частичек или газов, прежде всего табакокурения (приказ № 128 МЗ Украины).
Согласно Глобальной стратегии диагностики и лечения хронического обструктивного заболевания легких (Global initiative for chronic obstructive lung disease — GOLD), ХОЗЛ является заболеванием, характеризующимся сочетанием клинических проявлений хронического обструктивного бронхита и эмфиземы, долевое соотношение которых может быть различным [1].
По данным Европейского респираторного общества, только у 25 % пациентов заболевание диагностируется своевременно. Гиподиагностика ХОЗЛ связана с тем, что больные обращаются за медицинской помощью лишь при появлении выраженной симптоматики или даже серьезной угрозы для жизни. Вместе с тем ХОЗЛ находится на 6-м месте среди ведущих причин смерти в мире, на 5-м — в развитых странах Европы. ХОЗЛ — патология, которая требует чрезвычайно высоких затрат и является серьезным социальным бременем.
По прогнозам ВОЗ, к 2020 году ХОЗЛ займет 3-е место в мире в структуре смертности [2].
Для ХОЗЛ характерны системные нарушения, которые являются важной частью порочного круга, и их необходимо всегда учитывать в клиническом ведении больных. К таковым относятся: кахексия с потерей жировой массы, потеря скелетной мускулатуры и ее слабость, остеопороз, депрессия, анемия, повышенный риск развития сердечно-сосудистых заболеваний. Особого внимания заслуживает остеопороз — как следствие использования кортикостероидов, так и самостоятельно развившийся в ходе патогенеза ХОЗЛ.
Основные принципы терапии больных ХОЗЛ:
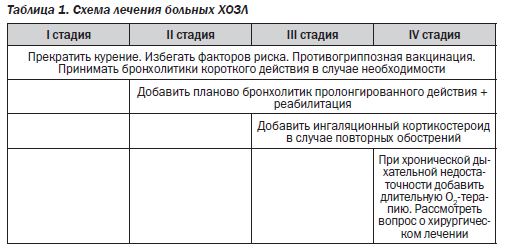
Из табл. 1 видно, что в терапии больных с ХОЗЛ, начиная с III стадии заболевания, имеет место применение глюкокортикостероидов (ГКС), что, в свою очередь, может способствовать развитию остеопороза.
Остеопороз — системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, приводящее к увеличению хрупкости кости и риску переломов [3].
Наиболее часто местами переломов при остеопорозе являются позвонки, ребра, запястья, шейка бедра, проксимальные отделы плечевой кости, кости таза. Переломы костей часто приводят к инвалидности и смертельным исходам, что и определяет клиническую значимость остеопороза.
Низкая минеральная плотность костной ткани (МПКТ) является основным количественным признаком остеопороза. В 1994 г. рабочей группой Всемирной организации здравоохранения решено диагностировать остеопороз на основании степени снижения МПКТ, определяемой методом костной денситометрии. При этом используется единый универсальный диагностический показатель для всех методик денситометрии — так называемый Т-критерий, который определяется как отношение фактической костной массы обследуемого к пиковой костной массе молодых здоровых людей того же пола, рассчитываемое в процентах и стандартных отклонениях [4].
Эпидемиология
Если принять во внимание эпидемиологические данные о частоте ОП и ХОЗЛ, то выявляется очевидная тенденция к увеличению частоты заболеваемости с возрастом. Поэтому, казалось бы, можно говорить о естественной «возрастной коморбидности» ХОЗЛ и ОП. Этот фактор не вызывает сомнений, однако имеющиеся по данной проблеме исследования свидетельствуют, что в развитии ОП у больных ХОЗЛ может иметь значение целый ряд других причин, одни из которых не вызывают сомнений, а другие требуют уточнения. По-видимому, одной из первых работ, посвященных изучению возможной связи ОП с хроническими легочными заболеваниями, было исследование у больных хроническим бронхитом минеральной плотности костной ткани, которая оказалась ниже по сравнению с контрольной группой, сопоставимой по возрасту [11]. В более поздних исследованиях установлена высокая частота остеопений и ОП у больных ХОЗЛ, достигающая 60 % [12, 13], причем по мере прогрессирования ХОЗЛ остеопороз выявлялся чаще. Высокая частота ОП установлена у больных с терминальной стадией различных хронических легочных заболеваний (в том числе и ХОЗЛ), которые являются кандидатами для трансплантации легких. МПКТ позвоночника и бедра в сопоставимых возрастных группах была снижена как до трансплантации, так и после нее [13].
Клинические проявления остеопороза
Чаще всего клиническим симптомом остеопороза является боль в спине, в пояснично-крестцовой или крестцовой области. Чувство усталости, необходимость частого отдыха в положении лежа, перелом лучевой кости в типичном месте и кифотическая деформация, появляющиеся задолго до боли, чаще всего не воспринимаются пациентами как симптомы болезни. Выраженность болевого синдрома может быть различной не только у разных больных, но и у одного и того же больного в разные промежутки времени. Особенностью боли при остеопорозе является то, что длительный прием нестероидных противовоспалительных средств не купирует ее [5].
Боль не всегда связана с переломами, чаще ее причина — микропереломы трабекул. Хотя боль при остеопорозе менее интенсивна, чем при остеомаляции, в некоторых случаях именно она приковывает больных к постели. В ходе болезни происходит типичное изменение облика больных. Отмечается выраженный грудной кифоз, укороченное сжатое туловище, ребра достигают гребней подвздошных костей. Из-за укорочения туловища кожа живота образует множественные складки. Поясничный лордоз может быть чрезмерным или, наоборот, уплощенным. В большинстве таких случаев имеется выраженная защитная поза с ограничением подвижности. В англоязычной литературе этому состоянию дано наименование dowager''s hump (вдовий горб) [11].
Общим симптомом у больных с остеопорозом независимо от его формы является уменьшение роста. Движения в поясничном отделе позвоночника ограничиваются. Нарушение походки выявляется не только у больных с переломами костей таза и шейки бедра. Шаркающая, неуверенная походка с широко расставленными стопами нередко отмечается у больных с постменопаузальной и стероидной формами остеопороза и возникает без переломов костей скелета.
Возможно длительное течение заболевания без клинических проявлений, вплоть до возникновения бессимптомных переломов тел позвонков. Независимо от числа и количества компрессионных переломов тел позвонков при остеопорозе не наблюдается парезов и параличей. В некоторых случаях именно это позволяет провести дифференциальную диагностику остеопороза с метастатическим поражением тел позвонков [11].
Инструментальная диагностика остеопороза
Стандартная рентгенография — наиболее широко применяемый до последнего времени метод диагностики как самого остеопороза, так и его осложнений. Однако диагностическая ценность рентгенографии зависит от ряда трудно поддающихся учету факторов, включая опыт рентгенолога.
Для объективизации степени нарушения минерализации костей разработаны так называемые полуколичественные методы. В их основе лежит вычисление вертебральных, феморальных и метакарпальных индексов. Для трубчатых костей — это отношение ширины кортикального слоя к диаметру кости, для позвонков — степень их деформации, которая часто обусловлена компрессионными переломами.
Характерные для остеопороза рентгенологические изменения появляются, когда кости теряют 20–40 % кальция. Более того, во многих случаях выраженность остеопении на рентгенограммах не коррелирует с переломами позвоночника [6].
Денситометрия — количественное исследование минеральной плотности костей — в настоящее время является одним из наиболее значимых методов в диагностике метаболических заболеваний скелета и практически единственным методом неинвазивной оценки риска костной травмы при остеопорозе. Наибольшее распространение получили рентгеновская и ультразвуковая денситометрия, а также количественная компьютерная томография (ККТ). При ультразвуковой денситометрии для измерения доступны лишь некоторые отделы периферического скелета, эта методика чаще используется для скрининга.
ККТ обладает достаточной точностью при исследовании позвоночника, ее основное преимущество по сравнению с другими методами — возможность селективного анализа губчатой и компактной кости в единицах объемной плотности. Основные недостатки ККТ: трудности при исследовании костей периферического скелета, неприемлемо большая суммарная лучевая нагрузка при длительном динамическом наблюдении и высокая стоимость исследования.
В настоящее время двуэнергетическая рентгеновская денситометрия (DXA) более предпочтительна, поскольку она менее дорогая, более точная и дает меньшее облучение. Возможность динамического наблюдения определяется точностью теста. Погрешность DXA составляет 1–3 %. Этот метод в настоящее время рассматривается как золотой стандарт методов костной денситометрии. Одновременно проводится исследование не менее двух критических участков скелета (в типичном случае — проксимальный отдел бедра и позвоночник в прямой проекции), что позволяет избежать многих ошибок, например, при получении завышенных результатов по одному отделу [10].
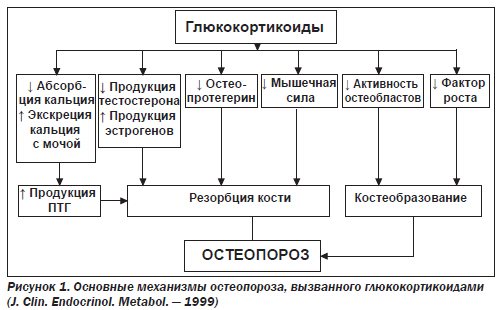
Основные факторы развития остеопороза при ХОЗЛ (рис. 1, 2):
— хронический воспалительный процесс, увеличение продукции провоспалительных цитокинов;
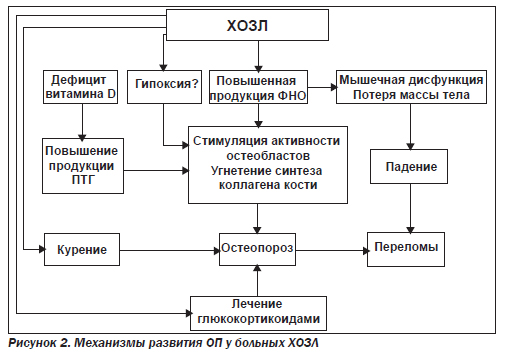
Хотя пульмонологи связывают проблему остеопороза в основном с приемом ГКС, результаты исследований показывают, что не принимающие ГКС больные также имеют значительный риск развития остеопороза. У 90 % тяжелых больных наблюдается гиперрезорбция костной ткани. Ее возникновение в 40 % случаев связано с дефицитом витамина D, в 10 % — с резорбцией костной ткани вследствие иммобилизации, в 45 % отмечается сочетание этих двух факторов. Показано, что иммобилизация даже на 6–8-й нед. приводит к безвозвратной потере 10 % костной плотности. Такое снижение костной плотности приблизительно в 2 раза увеличивает риск переломов [14].
Хронический воспалительный процесс способствует образованию большого количества цитокинов, принимающих участие в костной резорбции. В норме они не определяются в крови, но при выраженном воспалении их концентрация значительно возрастает. Цитокины «раннего ответа» (фактор некроза опухоли (TNF), интерлейкины — IL-1 и IL-6) продуцируются в большом количестве при бронхиальной астме (БА), пневмонии, туберкулезе, муковисцидозе, саркоидозе. Они же участвуют в процессе костной резорбции.
Наиболее убедительные доказательства получены для TNF, который способствует пролиферации и созреванию предшественников остеокластов. Мощными медиаторами остеокластогенеза являются также IL-1 и IL-6 (IL-1 в 4–10 раз более сильный фактор костной резорбции in vitro, чем паратиреоидный гормон — ПГ). Эти и другие цитокины обеспечивают связь между воспалительным процессом в бронхолегочной системе и костным ремоделированием, что в итоге приводит к потере костной ткани [7].
Немаловажными факторами являются гипоксия, снижение физической активности из-за респираторных симптомов и частых госпитализаций у тяжелых больных. Известен факт, что больные с тяжелыми легочными заболеваниями (БА, ХОЗЛ, саркоидоз, альвеолит, муковисцидоз, после трансплантации легких) имеют низкую костную плотность и вследствие этого страдают переломами.
Наиболее частым вариантом вторичного остеопороза является стероидный.
Стероидный остеопороз развивается в результате воздействия на костную ткань избыточного количества глюкокортикостероидов. Остеопороз на фоне лечения глюкокортикостероидными препаратами обусловлен биологическими эффектами естественных гормонов — глюкокортикостероидов, в основе которых лежат молекулярные механизмы взаимодействия с глюкокортикостероидными рецепторами остеокластов (ОК) и остеобластов (ОБ). В течение первых недель лечения ГКС отмечается снижение абсорбции кальция в кишечнике. ГКС усиливают почечную экскрецию и уменьшают канальцевую реабсорбцию фосфора и кальция. Прием 40 мг преднизолона в течение 5 дней приводит к увеличению экскреции кальция с мочой в 2 раза. Есть сообщения о непосредственном влиянии ГКС на состояние рецепторов и активность ОБ и ОК. ГКС подавляют продукцию ПГ Е2, которые стимулируют синтез коллагена и неколлагеновых белков костными клетками [8]. Кроме того, ГКС уменьшают количество половых гормонов, которые обладают анаболическим действием, что также может способствовать остеопорозу [8]. Таким образом, ГКС оказывают многогранное влияние на костную ткань, которое суммарно активизирует ремоделирование костной ткани. Последнее приводит к увеличению скорости резорбции без компенсаторного роста костеобразования и, как итог, к развитию остеопороза.
Для стероидного остеопороза характерно поражение трабекулярных костей осевого скелета — тел позвонков, костей таза, ребер, шейки бедра. Для стероидного повреждения скелета в детском возрасте типична задержка линейного роста. Прием высоких доз ГКС вызывает довольно быструю и существенную потерю костной массы. Уже в первые 6–12 мес. лечения может наблюдаться ее потеря в 5–15 % [8]. Большая потеря происходит в поясничном отделе позвоночника. По данным литературы, при равных дозах ГКС и длительности терапии развитие остеопороза, как и других осложнений кортикостероидной терапии, имеет большие индивидуальные особенности [13]. Это обусловлено прежде всего генетическими факторами, которые определяют особенности метаболизма ГКС и состояние рецепторов к витамину D.
Отмечена высокая частота компрессионных переломов позвонков у мужчин пожилого возраста с хронической легочной болезнью (сенильный остеопороз), однако тяжелые клинические проявления переломов встречаются наиболее часто у тех, кто принимает глюкокортикоиды.
Использование ингаляционных стероидов по сравнению с парентеральными формами приводит к снижению неблагоприятных влияний на скелет, но не предотвращает их полностью. Следовательно, плотность КТ должна измеряться у всех пациентов с хроническими заболеваниями легких. Определенные профилактические режимы необходимо установить для тех больных, которые имеют низкие начальные значения МПКТ или получают лечение глюкокортикоидами.
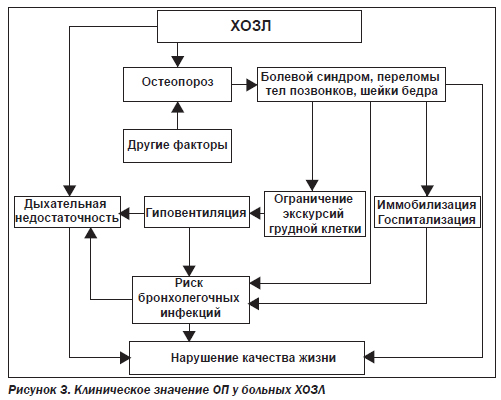
Основные клинические проявления ОП — это болевой синдром и переломы, хотя потеря костной массы может протекать бессимптомно и первым признаком ОП оказываются переломы костей. Переломы негативно влияют на качество жизни пациентов в целом, особенно у больных ХОЗЛ. Типичной локализацией переломов у больных ОП являются позвоночник и проксимальная часть бедра. Клиническое значение вертебральных переломов у больных ХОЗЛ заключается в ухудшении функциональной способности легких вследствие наличия болевого синдрома, а также прогрессирующего кифоза грудного отдела позвоночника с последующими рестриктивными нарушениями дыхания. Так, при исследовании 9 некурящих больных с выраженным кифосколиозом форсированная жизненная емкость легких (ФЖЕЛ) составляла 29 %, а общая способность легких — 44 % от должной, в то время как соотношение объема форсированного воздуха за 1 с/ФЖЕЛ было в пределах нормы [13]. По данным изучения 74 женщин с ОП, каждый перелом грудного позвонка снижает ФЖЕЛ приблизительно на 9 % [13]. Возникающие вследствие остеопоротических переломов позвонков деформации позвоночника оказывают негативное влияние на функцию внешнего дыхания. При позвоночном кифозе у женщин с ОП значительно уменьшаются показатели ЖЕЛ, общей емкости легких, инспираторная емкость легких, а также боковая и вертикальная подвижность ребер по сравнению со здоровыми женщинами того же возраста. При этом отмечена отрицательная корреляция между углом кифоза и изучаемыми показателями функции внешнего дыхания (ФВД) [13]. Следует подчеркнуть, что если у лиц с нормальной легочной функцией выявляемые изменения легочных объемов не имеют существенного значения, то у больных ХОЗЛ даже минимальные ухудшения ФВД могут усугублять функциональные нарушения, ухудшая качество жизни пациентов. Кроме того, имеются данные, что вертебральные переломы повышают риск смерти больных ХОЗЛ [2]. Клиническое значение вертебральных переломов у этих пациентов заключалось в повышенном риске обострений ХОЗЛ, развития у них пневмонии, что нередко имело фатальный исход [4]. Наиболее серьезным последствием ОП являются переломы шейки бедра, риск возникновения которых нарастает по мере снижения МПКТ и при наличии сопутствующих хронических заболеваний. Возникновение переломов шейки бедра ведет к гипомобильности, что у больных ХОЗЛ усугубляет функциональные нарушения, делает больных более зависимыми от ухаживающих за ними, увеличивает смертность больных, особенно пожилого и старческого возраста. Приведенные данные свидетельствуют о том, что ОП с последующими переломами позвоночника и других костей является серьезной проблемой у пожилых больных ХОЗЛ и требует раннего выявления с целью своевременной коррекции и предупреждения прогрессирования снижения МПКТ [14]. На рис. 3 представлены основные последствия и клиническое значение ОП у больных ХОЗЛ.
В настоящее время золотым стандартом диагностики ОП или остеопении является двуэнергетическая рентгеновская абсорбциометрия. Однако в силу своей высокой стоимости и относительно малой доступности выявление ОП и назначение соответствующего лечения у многих больных, в том числе больных ХОЗЛ, являются запоздалыми. Попытки использования с целью ранней диагностики ОП у больных ХОЗЛ методов ультразвуковой денситометрии пяточной кости, даже при дополнительном использовании специального вопросника, не оправдались [11]. Этот метод оказался менее чувствительным, чем DXA при диагностике ОП и остеопений у больных различными заболеваниями легких. Авторы подчеркивают, что ультразвуковая оценка не может быть использована в качестве скрининга для выявления низких показателей МПКТ. Костный обмен оценивается с помощью некоторых маркеров — сывороточных С-телопептида и N-телопептида, активности костноспецифической щелочной фосфатазы. С позиций современного понимания механизмов переломов костей при ОП в последнее время обсуждается концепция качества кости и критерии оценки эффективности антиостеопоротических препаратов. Поскольку в настоящее время доказано отсутствие параллелизма между приростом МПКТ и снижением частоты переломов, есть основание считать, что некоторые препараты уменьшают риск переломов в большей степени за счет воздействия на качество кости, чем на МПКТ [9]. Оценка качества кости проводится с помощью ультразвукового исследования, магнитно-резонансной томографии, периферической компьютерной томографии, костной биопсии.
Лечение и профилактика ОП у больных ХОЗЛ
Контроль внелегочной патологии у больных ХОЗЛ является существенным компонентом ведения данной категории пациентов. В отношении ОП такая позиция лечащего врача приобретает особое значение с учетом риска переломов позвоночника и шейки бедра, которые существенно ухудшают не только функцию легких, но и качество жизни этих пациентов. Ведение больных ХОЗЛ в сочетании с ОП включает:
Исследования по применению антиостеопоротических препаратов у больных ХОЗЛ касаются главным образом больных, получающих глюкокортикоиды, являющиеся доказанным фактором риска ОП.
Витамин D и препараты кальция
Полученные данные о наличии дефицита витамина D у больных ХОЗЛ [15] являются основанием к назначению этим пациентам витамина D. Особое значение имеют при этом активные метаболиты витамина D (альфакальцидол и кальцитриол), нормализующие абсорбцию и баланс кальция, снижающие секрецию ПТГ наряду со стимуляцией костеобразования. У больных, получающих системные ГК, целесообразно назначение препаратов кальция (1000–1500 мг элементарного кальция в сутки) с учетом снижения кишечной абсорбции кальция и повышения его экскреции с мочой. В серии рандомизированных исследований показана эффективность комбинированного применения препаратов витамина D и кальция для профилактики ОП у больных, длительно принимающих системные ГК. При этом рекомендуется контроль уровня кальция в крови и моче.
Заместительная гормональная терапия
Дефицит тестостерона у мужчин с ХОЗЛ, усугубляющийся на фоне лечения системными ГК, является одним из факторов развития ОП у данной категории пациентов. С учетом снижения мышечной массы у больных ХОЗЛ и катаболического эффекта ГК назначение тестостерона может иметь еще и дополнительные показания для увеличения мышечной массы и снижения жировой ткани. Назначение в течение года заместительной гормональной терапии (ЗГТ) женщинам в постменопаузе, получавшим системные ГК по поводу ХОЗЛ, способствовало увеличению МПКТ поясничных позвонков на 4,1 %, в то время как в группе больных, не получавших ЗГТ, отмечалось дальнейшее снижение показателей МПКТ на 3,4 % [16].
Кальцитонин
Данные о влиянии кальцитонина на частоту переломов у леченных ГК больных ХОЗЛ в настоящее время отсутствуют. Важным свойством кальцитонина является его выраженный и стойкий анальгетический эффект, что дает препарату дополнительные преимущества у больных ОП с болевым синдромом. Устранение болей при остеопоротических переломах у больных ХОЗЛ позволяет избегать осложнений, обусловленных болями (длительная иммобилизация, гиповентиляция, нарушение экспекторации), дополнительного назначения анальгетических препаратов, в том числе и НПВП, к которым у ряда больных может быть повышенная чувствительность [16].
Клинические рекомендации по ведению больных ХОЗЛ с наличием ОП или факторов риска ОП:
1. Global initiative for chronic obstructive lung disease — GOLD, 2007.
2. Snow V., Lascher S., and Mottur-Pilson C., for the Joint Expert Panel on Chronic Obstructive Pulmonary Disease of the American College of Chest Physicians and the American College of Physicians — American Society of Internal Medicine. Evidence base for management of acute exacerbations of chronic obstructive pulmonary disease // Ann. Intern. Med. — 2001. — Vol. 134. — P. 595-9.
3. Франке Ю., Рунге Г. Остеопороз. — М.: Медицина, 1995. — С. 12-15.
4. Беневоленская Л.И. Остеопороз — актуальная проблема медицины // Остеопороз и остеопатии. — 1998. — С. 4-7.
5. Поворознюк В.В. Остеопороз: клиника, диагностика, профилактика, лечение // Журн. практ. врача. — 1996. — № 6. — С. 18-35.
6. Деквейкер Я. Стратегия лечения остеопороза // Первый Российский симпозиум по остеопорозу. — М., 1995. — С. 21-28.
7. Делмас П.Д. Механизмы потери кости при остеопорозе // Тезисы лекций и докладов I Российского симпозиума по остеопорозу. — М., 1995. — С. 31-33.
8. Насонов Е.Л. Вторичный остеопороз: патогенез и клиническое значение при воспалительных заболеваниях суставов // Остеопороз и остеопатии. — 1998. — № 1. — С. 18-22.
9. Smith R. Investigation of osteoporosis // Clin. Endocr. — 1996. — Vol. 44(4). — P. 361-374.
10. Лепарский Е.А., Скрипникова И.А. Диагностика и лечение остеопороза (современное состояние вопроса). — М., 1997. — С. 26.
11. Praet J.P, Peretz A., Rosenberg S. et al. Risk osteoporosis in men with chronic bronchitis // Osteoporos Int. — 1992. — Vol. 2. — P. 257-261.
12. Iqbal F., Michaelson J., Thaler L. et al. Declining bone mass in men with chronic pulmonary disease. Contribution of glucocrticoud treatment, body mass index, and gonadalfunction // Chest. — 1999. — Vol. 116. — P. 1616-1624.
13. Incalzi R.A., Caradonna P., Ranieri P. et al. Correlates of osteoporosis in chronic obstructive pulmonary disease // Respir. Med. — 2000. — Vol. 94. — P. 1079-1084.
14. McEvoy C.O., Ensrud K.E., Bender E. et al. Association between corticosteroid use and vertebral fractures in older men with chronic obstructive pulmonary disease // Am. J. Respir. Crit. Care Med. — 1998. — Vol. 157. — P. 704-709.
15. Del Pino-Montes J., Fernandes J.L., Gomez F. et al. Bone mineral density is related to emphysema and lung function in chronic obstructive pulmonary disease // J. Bone Miner. Res. — 1999. — Vol. 14 (suppl.). — SU 331.
16. Сноу В., Лэсчер С., Моттур-Пилсон К. Клинические рекомендации Ч. I. // Обоснование тактики ведения больных с обострениями хронических обструктивных заболеваний легких. — Международный журнал медицинской практики.
17. Чучалин А.Г. Хроническое обструктивное заболевание легких и сопутствующие заболевания // Здоровье Украины. — 2008. — № 15–16. — С. 37-39.
