Газета «Новости медицины и фармации» Акушерство, гинекология, репродуктология (317) 2010 (тематический номер)
Вернуться к номеру
Контрацепція
Авторы: Донна Шауп і Деніел Р. Мішель-мол. Університет Південної Каліфорнії, Лос-Анджелес (штат Каліфорнія)
Версия для печати
І. Використання методів контрацепції у Сполучених Штатах Америки
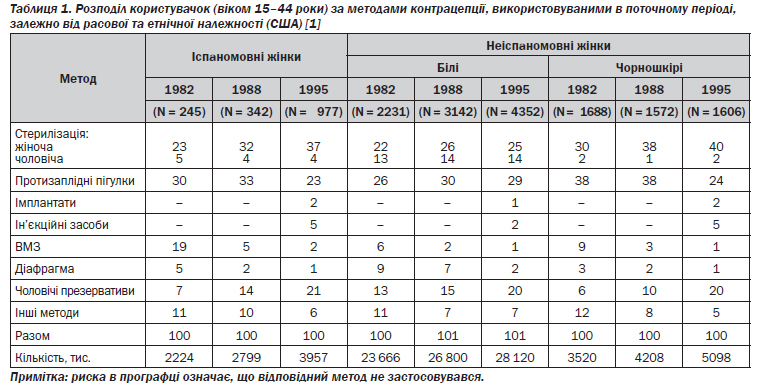
Дані опитувань, проведених у масштабах країни в 1982, 1985 і 1995 роках, містять корисну інформацію щодо вибору методів контрацепції американськими жінками [1]. Отримані результати свідчать про те, що загалом поширеність користування протизаплідними засобами серед жінок репродуктивного віку (15–44 роки) зросла з 56 до 64 %. Серед сексуально активних жінок, які не бажали завагітніти, тільки 5 % не вдавалися до контрацепції [1]. Однак викликає стурбованість те, що 30 % користувачок застосовують методи контрацепції, для яких при «типовому» користуванні характерний високий відсоток невдач. Оскільки значна частина сексуально активних жінок у США використовують недостатньо ефективні методи контрацепції, у країні спостерігається висока частота випадків небажаної вагітності, а отже, й не зумовлених медичними показаннями абортів, — тоді як у Західній Європі й у Канаді відповідні показники істотно менші. Небажана вагітність — нібито свого роду «ендемічне захворювання» в Сполучених Штатах, де, наприклад, у 1994 році небажаними були майже половина (49 %) з 5,4 млн вагітностей.
У період з 1988 до 1995 року частка користувачок пероральних контрацептивів зменшилася з 31 до 27 %, тоді як застосування презервативів зросло з 15 до 20 %. Особливо помітно — з 75 до 32 % — зменшилося використання протизаплідних пігулок серед чорношкірих жінок віком до 25 років. Серед жінок віком 35–39 років поширилося вживання пероральних контрацептивів, у віковій групі 40–44-річних воно збільшилося в шість разів. Показники користування презервативами серед чорношкірих та іспаномовних жінок зросли більше, ніж серед білих. У 1995 році поширеність користування презервативами становила 20 % і була практично однаковою в усіх трьох групах (табл. 1).
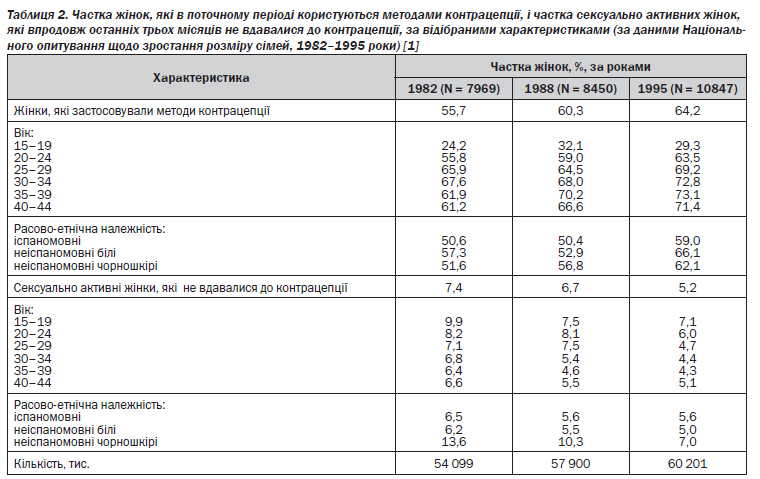
Іспаномовні жінки стали менше довіряти внутрішньоматковим протизаплідним засобам (ВМЗ), а білі жінки з вищою або середньою спеціальною освітою — піхвовим діафрагмам і шийковим ковпачкам. Зниження популярності пероральних контрацептивів, діафрагм і ковпачків, а також збільшення частки тих, хто віддає перевагу презервативам, може відбивати дедалі поширенішу серед пар репродуктивного віку стурбованість стосовно ВІЛ та інших хвороб, що передаються статевим шляхом. Загалом у 1995 році показник використання методів контрацепції досяг найвищого рівня за всі часи — 64,2 %. Порівняно з 1988 роком частка жінок, які користувалися ними, зросла в усіх вікових групах серед іспаномовних, білих і чорношкірих жінок (табл. 2) [1].
На вибір методу контрацепції впливають вік, родинний стан, освіта, дохід, наміри щодо збереження фертильності. У 1995 році жінки віком до 30 років, які ніколи не були в шлюбі, з освітою на рівні одного- двох років навчання у вищому або середньому спеціальному навчальному закладі, користувалися переважно протизаплідними пігулками, тоді як жінки, що вже були заміжні, на четвертому-п''ятому десятку життя зазвичай обирали стерилізацію шляхом перев''язки маткових труб. Реагуючи на дедалі більшу стурбованість хворобами, що передаються статевим шляхом, майже 8 % жінок використовують два методи, один з яких — презерватив [1].
II. Ефективність контрацепції
Показник «ефективність тривалого користування» відбиває результативність методу впродовж досить великого проміжку часу, визначену з застосуванням статистичних методів (включно з аналізом таблиць дожиття). Дослідження з вивчення ефективності контрацепції найчастіше проводяться в формі клінічних випробувань; при цьому можливість частих контактів учасниць із медичним персоналом, що надає їм посилену підтримку й консультування, може спричинитися до отримання нижчих показників невдач і вищих показників продовження користування, ніж ті, що спостерігалися б у звичайних умовах за типового користування методами контрацепції.
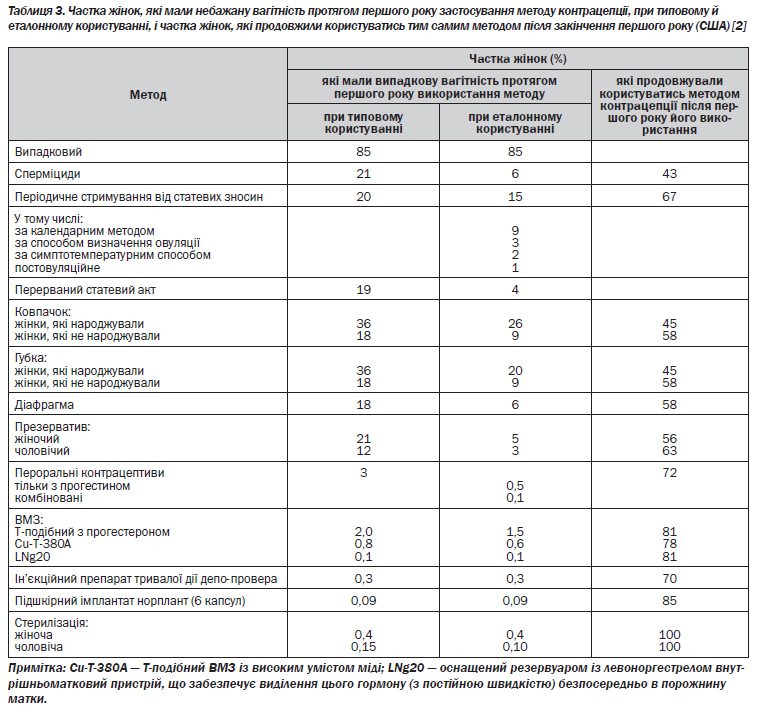
Невдачі в намаганні запобігти зачаттю частіше трапляються в тих сімейних пар, які мають намір відкласти народження бажаної дитини, аніж у тих, що бажають узагалі в надалі уникнути народження дітей. Між віком жінки та невдалою контрацепцією спостерігається сильна негативна кореляція; те ж саме стосується соціально-економічного статусу й рівня освіти. Показник невдач нижчий серед заміжніх жінок проти незаміжніх; упродовж першого року користування методом він зазвичай вищий, ніж у наступні роки. У табл. 3 подано показники невдач на першому році застосування різноманітних методів контрацепції при «типовому» й «еталонному» (з найточнішим дотриманням усіх правил) користуванні, а також наведено дані про частку жінок, які продовжили користуватись тим самим методом після закінчення першого року [2].
Опубліковано дані щодо невдач під час поточного користування певними засобами контрацепції тривалої дії за п''ять років [3–5]. Кумулятивний показник невдач за п''ять років використання норпланту, за результатами клінічних випробувань, становить 1,1 % [3]. У широкомасштабному дослідженні, проведеному Всесвітньою організацією охорони здоров''я (ВООЗ), отримані кумулятивні показники невдач у разі застосування ВМЗ типу Сu-Т-380, які дорівнюють 1,0, 1,4 і 1,6 % відповідно через три, п''ять і сім років після введення засобу [4]. Подібна картина спостерігається й при трубній стерилізації — 1,3 і 1,9 % відповідно через п''ять і десять років після перев''язки труб [5].
III. Економічні витрати, пов''язані з методами контрацепції
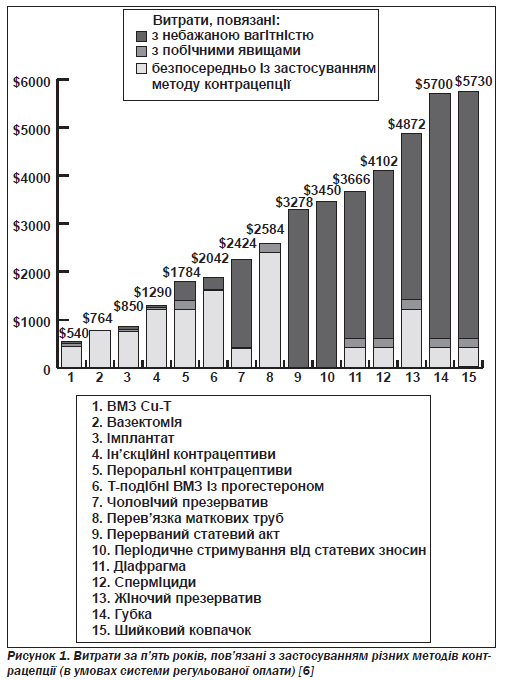
Усі методи контрацепції сприяють зменшенню витрат у системі медичного обслуговування. Економічну модель для порівняння витрат, пов''язаних з 15 методами, подано на рис. 1 [6]. Вона відображує витрати за п''ять років користування кожним з методів, додаючи до прямих витрат непрямі — зумовлені невдачами й побічними явищами. Оскільки небажана вагітність призводить до вельми значних витрат, застосування будь-якого з 15 досліджуваних методів контрацепції є вигіднішим, ніж відмова від їх використання. Найбільш економічно ефективними виявилися ВМЗ з умістом міді, вазектомія, прогестинові імплантати та ін''єкційні контрацептиви.
IV. Типи протизаплідних засобів
А. Сперміциди: піни, креми, свічки
Усі сперміцидні продукти містять сурфактант (поверхнево-активну речовину) — звичайно ноноксинол-9, — що позбавляє сперматозоїди рухливості або вбиває їх при контакті. Ефективність цих засобів (що підвищується зі збільшенням віку жінок) порівнянна із зареєстрованою в разі використання ковпачка в усіх групах, класифікованих за віком і за рівнем доходу. Виробництво інтравагінальної губки припинено в 1994 році, внаслідок чого нині цей засіб не застосовується. Деякі дослідники пов''язують зачаття, що відбулося на тлі використання сперміцидів, з підвищеним ризиком уроджених аномалій розвитку, однак кілька ретельно проведених досліджень не виявили наявності підвищеного ризику виникнення в подібних випадках внутрішньоутробних вад [7, 8] або аномалій каріотипу [9].
Б. Бар''єрні методи контрацепції
1. Діафрагма
Діафрагму має добирати лікар-фахівець. Потрібно застосовувати найбільший розмір діафрагми, що не викликає почуття дискомфорту. Щоб досягти максимального ефекту, діафрагму потрібно залишати протягом восьми годин після статевих зносин. У разі повторних статевих зносин треба додатково застосовувати сперміциди.
Серед жінок, які користуються діафрагмою, захворюваність на інфекції сечового тракту вища порівняно з тими, які не використовували цей засіб; причина, імовірно, у тому, що тиск діафрагми на уретру певною мірою перешкоджає відтоку сечі [10]. Діафрагму не можна залишати в піхві довше ніж на 24 години, оскільки довготривале застосування інколи призводить до виникнення виразки вагінального епітелію.
2. Шийковий ковпачок
Шийковий ковпачок — це чашкоподібний пластиковий або гумовий пристрій, що надягають на шийку матки, добираючи потрібний розмір. В Європі, особливо у Великобританії, цей засіб застосовують уже десятки років, але в США його було затверджено для широкого використання тільки в 1988 році. Випускаються шийкові ковпачки чотирьох розмірів. Ковпачок може залишатись у піхві до 48 годин, і він зручніший, ніж діафрагма. Перед використанням ковпачка в нього обов''язково кладуть сперміциди. Застосування ковпачка порівняно з діафрагмою потребує серйознішої підготовки як від медичного працівника, котрий повинен точно дібрати розмір, так і від жінки, яка має правильно ввести засіб.
За даними широкомасштабних клінічних випробувань, частота випадків вагітності на рік застосування методу становить для ковпачка (zk і для діафрагм) 17 % [11]. З огляду на можливість негативного впливу на тканини шийки матки використання ковпачка допускається тільки за умови нормальної цитології шийки матки.
3. Чоловічий презерватив
Презерватив — один із найстаріших і найпоширеніших засобів контрацепції: ним почали користуватися ще в XVI столітті для захисту від венеричних хвороб, а нині до нього вдаються понад 40 млн пар у всьому світі. Сьогодні чоловічий презерватив — найефективніший спосіб контрацепції і запобігання хворобам, що передаються статевим шляхом, як у чоловіків [12], так і в жінок [13]. Дані епідеміологічних досліджень підтверджують, що використання презервативів захищає від передачі ВІЛ [14, 15]. Презерватив відіграє роль протективного фактора щодо клітинних аномалій тканин шийки матки й навіть має терапевтичний ефект у разі їх наявності, обмежуючи передачу агентів, пов''язаних із карциномою шийки матки [16], і приблизно на 40 % зменшуючи ризик запалення тазових органів (ЗТО) у жінок [13]. За даними одного дослідження, після десятьох років користування презервативом або діафрагмою відносний ризик розвитку дисплазії шийки матки становив 0,2 % [17].
Презервативи сьогодні виробляють здебільшого з вулканізованої латексної гуми; вони випускаються в широкому асортименті — різноманітних форм, з різною структурою поверхні, різного кольору. Завдяки вдосконаленому контролю якості виробничі дефекти, що могли б спричинити невдачу, у сучасних презервативах виявляються дуже рідко. На першому році користування цим методом показник невдач коливається від 0,4 до 6,0 % в умотивованих популяціях і від 8,0 до 31,9 % — серед молодих, недосвідчених або непослідовних користувачів [1, 18, 19]. Майбутні вдосконалення технології виготовлення можуть бути спрямовані на виробництво надтонких презервативів, розширення асортименту презервативів зі сперміцидною змазкою та на забезпечення суворішого контролю за якістю продукції.
4. Жіночий презерватив
У США використання жіночих презервативів було схвалено в 1994 році. Такий презерватив складається з широкого м''якого чохла й двох гнучких поліуретанових кілець. Одне з них, що розміщують усередині піхви, відіграє роль внутрішнього фіксатора для підтримання чохла у відповідній позиції у вагіні. Друге кільце залишають поза піхвою, створюючи таким чином зовнішній захист для вульви й пеніса. Презерватив змащений, що замінює прелюбрикацію. Засіб призначений для одноразового використання.
На відміну від чоловічого презерватива жіночий можна ввести за будь-який час до сексуальної активності, і його можна залишати на місці довше. Поліуретан, як і латекс, захищає від передачі вірусної інфекції; є підстави вважати, що зовнішнє кільце може забезпечити жінці навіть надійніший захист від хвороб, що передаються статевим шляхом, ніж чоловічий презерватив. До того ж поліуретан — міцніший матеріал порівняно з латексом і тому рідше рветься. За даними багатоцентрового клінічного випробування, показник вагітностей за шість місяців використання цього протизаплідного засобу становив 12,4 %, хоча в разі еталонного користування він не перевищує 2,6 % [20]. Після закінчення шестимісячного періоду приблизно третина жінок відмовилися від цього методу контрацепції.
В. Періодичне стримування від статевих зносин/природне планування сім''ї
За визначенням ВООЗ, до природних методів планування сім''ї належать методи планування вагітності або запобігання зачаттю за допомогою спостереження природних ознак і симптомів сприятливої і несприятливої для запліднення фаз менструального циклу. Багато пар вдаються до цих методів із різних мотивів: бажаючи уникнути застосування «штучних технологій», прагнучи отримати можливість самостійно контролювати свою фертильність, з релігійних або пов''язаних з особливостями культури причин.
Існує кілька методів встановлення періоду, коли організм жінки здатний до зачаття. Найдавніший із них — метод календарного ритму, що спирається на три основні припущення: 1) людська яйцеклітина може бути запліднена тільки впродовж 10–24 годин після овуляції; 2) сперматозоїди зберігають свою запліднювальну здатність лише 48 годин; 3) овуляція відбувається за 12–16 днів до початку наступної менструації. Щоб визначити перший день періоду, коли ймовірне зачаття, потрібно відняти 18–20 днів від тривалості найкоротшого циклу, а для визначення останнього дня цієї фертильної фази — відняти 11 днів від тривалості найдовшого циклу. Застосування цього методу часто призводить до тривалих періодів стримування від статевої активності — тож не дивно, що він рідко використовується як єдиний спосіб визначення фертильного періоду жінки.
Користуючись температурним методом, пара має стримуватись від статевих зносин від початку циклу до ранку третього дня після збереження підвищеної базальної температури тіла. У разі застосування методу, що базується на спостереженні за змінами цервікального слизу, першим фертильним днем циклу вважають перший день, коли з''являється відчуття вологості або слиз у піхві, а останнім — четвертий день після піку прояву цих симптомів. Для визначення початку фертильного періоду використовуються також зміни у відкритті шийки матки (пом''якшення або зміщення вгору в ділянці таза) перед овуляцією. Симптотемпературні методи використовують для визначення початку фертильного періоду зміни в цервікальному слизу або календарні підрахунки, а для встановлення його закінчення — зміни в слизу або базальну температуру тіла. Нині доступні прості, призначені для самостійного виконання тести, що дають змогу визначити концентрацію в сечі естрогенів і прегнандіолу глюкуроніду. Здійснюючи таке тестування приблизно протягом 12 днів щомісяця, можна скоротити необхідний період стримування від статевих стосунків до сімох днів.
Ці методи застосовують кожен окремо або в поєднанні. Показник невдач, зумовлений безпосередньо якістю самих методів, звичайно низький і становить від 1 до 7 % [21–23]. Однак (як і у випадку з багатьма іншими способами контрацепції) реальний показник невдач у користувачок значно вищий і коливається в межах від 6,6 до 39 % [24, 25]. Загалом найширше використовуються численні різновиди симптотемпературних методів, що характеризуються низьким рівнем невдач [26].
Г. Пероральні протизаплідні засоби
Вживання пероральних контрацептивів (що являють собою найглибше досліджений фармакологічний протизаплідний засіб XX століття) — надійний, до того ж оборотний спосіб запобігання небажаному зачаттю. Уперше з''явившись на ринку США в 1960 році, пероральні контрацептиви швидко стали найпопулярнішим у світі протизаплідним засобом. У складі більшості таких препаратів поєднано естроген і прогестин. Основна функція прогестинного компонента — гальмувати (пригнічувати) процес овуляції і викликати інші ефекти (зокрема, підвищення в''язкості цервікального слизу), що сприяють запобіганню зачаття. Основне призначення естрогенного компонента — підтримка ендометрію й запобігання кровотечі в міжменструальному періоді. Перші пероральні контрацептиви, що надійшли в продаж, містили 150 мкг естрогену (местранол) і 9,85 мг прогестину (норетинодрел), а до складу багато яких з сучасних комбінованих препаратів входить тільки 20 мкг естрогену й 100–150 мкг прогестину.
1. Фармакологія/Конкурентність
Розрізняють три основні типи пероральних протизаплідних препаратів: фазові комбіновані; комбіновані з фіксованою дозою компонентів; прогестин для щоденного приймання (протизаплідна міні-пігулка — так звані міні-пілі). Фазові препарати створено для того, щоб знизити загальну місячну дозу стероїдів. Усі пероральні контрацептиви, що доступні нині на ринку, виробляються із синтетичних стероїдів і не містять природних естрогенів чи прогестинів. Прогестини є похідними або від 19-нортестостерону, або від 17α-ацетоксипрогестерону. У сучасних пероральних контрацептивах ацетоксипрогестерони (включаючи медроксипрогестерону ацетат і мегестролу ацетат) не використовуються. Прогестини, похідні від 19-нортестостерону, розділяються на два класи: естрани (рис. 2) і гонани (рис. 3).
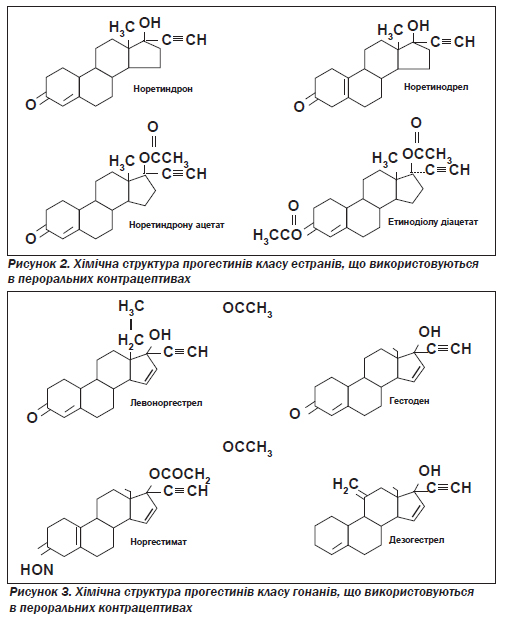
Гонани мають більшу гестагенну активність на одиницю маси, ніж естрани, і тому до складу пероральних контрацептивів гонани входять у меншій кількості. Вихідною сполукою класу гонанів є dl-норгестрел, що існує у вигляді двох ізомерів — правообертального (d — dextro) і лівообертального (l — levo). Біологічно активна тільки лівообертальна форма. Левоноргестрел у 10–20 разів активніший, ніж норетиндрон — прогестин, що належить до класу естранів [27, 28]. Три менш андрогенні похідні левоноргестрелу — дезогестрел, норгестимат і гестоден — широко використовуються в Європі вже багато років. На ринку США пероральні контрацептиви з дезогестрелом і норгестиматом (але не з гестоденом) з''явилися в 1992 році.
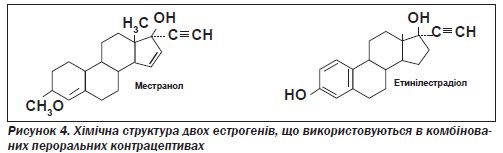
Усі сучасні пероральні контрацептиви з кількістю естрогену менше ніж 50 мкг містять етинілестрадіол. Препарати, що містять 50 мкг або більше естрогену (етинілестрадіолу чи местранолу, хімічну структуру яких показано на рис. 4), належать до першого покоління пероральних контрацептивів, а ті, що містять 20–35 мкг етинілестрадіолу, — до другого, за умови що до їхнього складу не включено який-небудь з трьох найновіших прогестинів.
Прогестини, що входять до складу пероральних контрацептивів третього покоління, — дезогестрел, норгестимат і гестоден, — мають таку саму або вищу гестагенну активність, як і решта прогестинів класу гонанів, але меншу андрогенну активність на одиницю маси. Конкурентність — це порівняння гестагенної активності прогестину з його андрогенною активністю. Етинілестрадіол приблизно в 1,7 раза активніший від местранолу й у 100 разів активніший, ніж спряжений естроген еквівалентної маси [29].
2. Механізм дії
Комбіновані прогестино-естрогенні пероральні контрацептиви — найефективніший варіант, оскільки ці препарати послідовно гальмують пік екскреції гонадотропіну в середині менструального циклу, а отже, запобігають овуляції.
За даними кількох досліджень, у більшості жінок, які вживають пероральні контрацептиви, спостерігається значне гальмування вивільнення лютеїнізуючого й фолікулостимулюючого гормонів (ЛГ і ФСГ) після введення гонадотропін-рилізинг-гормонів, що свідчить про безпосереднє пригнічення відповідних функцій як гіпофіза, так і гіпоталамуса. На ступінь гальмування не впливають вік жінки або тривалість використання стероїдів — вона залежить тільки від активності компонентів складу перорального контрацептиву [30]. Для порівняння: пігулки, що містять тільки прогестин, мають зменшену дозу прогестину й не стримують постійно овуляцію [31]. Як комбіновані засоби, так і препарати, що містять лише прогестин, впливають також на безліч інших аспектів репродуктивного процесу: 1) змінюють консистенцію цервікального слизу, підвищуючи його в''язкість і щільність, що перешкоджає проникненню сперматозоїдів; 2) зменшують скоротливу здатність фаллопієвих труб і матки, порушуючи процес транспортування яйцеклітини й сперматозоїдів; 3) пригнічують ендометрій, унаслідок чого його залози виробляють менше глікогенів, а отже, бластоциста отримує менше енергії, необхідної для її виживання в порожнині матки; 4) змінюють сприйнятливість яєчників до стимуляції гонадотропінами. Під час поточного вживання пероральних контрацептивів ні продукування стероїдів яєчниками, ні секреція гонадотропінів не припиняються повністю. На тлі приймання пероральних контрацептивів концентрація ендогенного естрадіолу в крові жінки підтримується на рівні, близькому до спостережуваного на початку фолікулярної фази нормального циклу [32].
3. Ефективність
Значних відмінностей у клінічній ефективності пероральних контрацептивів різних типів не виявлено (табл. 3). Доти, доки таблетки приймаються систематично, без пропусків (тобто за еталонного користування), річний показник випадків вагітності серед користувачок комбінованих пероральних контрацептивів не перевищує 0,2 %. У Сполучених Штатах приблизно 3 % жінок, які вживають пероральні контрацептиви, завагітніли на першому році типового користування [33]. Також на першому році типового користування міні-пілі частка жінок, які завагітніли, коливалася від 1,1 до 13,2 % [34]. У жінок, які годують груддю, міні-пілі забезпечують ефективність, близьку до 100 % [35]. Невдачі виникають частіше, коли жінка пропускає прийом однієї-двох пігулок після закінчення періоду, коли згідно зі схемою препарат не вживався, — порівняно з ситуаціями, коли такий пропуск трапляється протягом циклу приймання засобу.
4. Побічні явища
Більшість жінок, які вживають пероральні контрацептиви нового типу, не відчувають жодних побічних ефектів, зумовлених дією естрогену, — таких як нудота (наслідок впливу на центральну нервову систему), болючість молочних залоз, затримка рідини в організмі, гіперпігментація шкіри, виділення з піхви. Пероральні контрацептиви можуть викликати слабкі, клінічно незначущі зміни концентрації вітамінів у крові, наприклад, зменшення кількості вітамінів групи В й аскорбінової кислоти [36] і збільшення вітаміну А [37]. Препарати старого типу з великою дозою активних речовин, за повідомленнями, пришвидшують появу симптомів захворювання жовчного міхура, що пов''язане з дією естрогену на цей орган через підвищення концентрації холестерину [38–40].
Хоч усі нові міні-пілі зі зменшеною дозою активних речовин позитивно впливають на вугри й жирну шкіру, декотрі прогестини мають андрогенний ефект. Спостерігаються такі андрогенні побічні явища, пов''язані з прогестинним компонентом препарату, як збільшення апетиту й маси тіла, вугри, жирна шкіра [41], негативний вплив на ліпідний обмін, діабетогенний ефект, сверблячка, депресія, зміни настрою, підвищена збудливість, виснаження й втома [36]. Нові прогестини, а також комбіновані препарати з малою дозою прогестину дають змогу мінімізувати ці андрогенні ефекти.
Обидва компоненти пероральних контрацептивів — естрогени й прогестини — можуть спричинити появу таких проблем, як підвищений кров''яний тиск, головний біль, болючість молочних залоз. Якщо в період після припинення прийому препарату не виникає менструальноподібна кровотеча або спостерігається аменорея, це зумовлюється домінуванням у його складі прогестинів і може бути усунено з переходом на прийом контрацептивів зі збільшеним умістом естрогенів.
А. Вплив на печінкові білки: глобулін, що зв''язує статеві гормони, і зміни здатності крові зсідатися. Основний вплив андрогенних прогестинів на печінку полягає в дозозалежному пригніченні синтезу глобуліну, що зв''язує статеві гормони (ГЗСГ). Оскільки естрогени підвищують концентрацію ГЗСГ, вимірювання її являє собою надійний спосіб визначення відносного балансу між естрогенами й андрогенами, що входять до складу препарату (рис. 5).
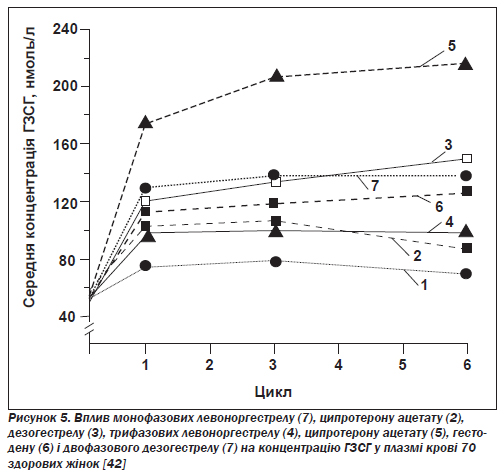
Найбільше підвищення концентрації ГЗСГ спостерігалося під час вживання комбінованих пігулок із дезогестрелом, гестоденом, ципротерону ацетатом [42], норгестиматом; це дає підстави вважати, що ці препарати найефективніші для лікування жінок із симптомами гіперандрогенізму, такими як вугри, гірсутизм або ожиріння андроїдного типу.
Синтетичні естрогени в пероральних контрацептивах, потрапляючи в організм через ротову порожнину, викликають дозозалежне посилення внутрішньопечінкового синтезу білків. Збільшення кількості цих білків, що спричиняє підвищення коагуляційної активності (фактори V, VIII, X системи зсідання крові й фібриноген), підраховують за змінами в концентрації факторів, що посилюють антитромботичну активність [43] (рис. 6).

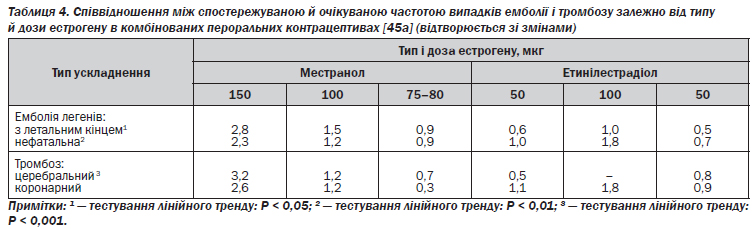
Найсерйозніші ускладнення, яких зазнають користувачки пероральних контрацептивів, пов''язані з хворобами, що перебігають з розладами кровообігу, зумовленими змінами зсідання крові. Серцево-судинні хвороби найчастіше виникають під час приймання таких препаратів у тих жінок, які курять, мають надмірну масу тіла, страждають на діабет, гіпертонію або старші від 50 років. За даними епідеміологічних досліджень, частота випадків як артеріального, так і венозного тромбозу безпосередньо пов''язана з дозою естрогену (табл. 4) [45а].
Ризик виникнення серйозних серцево-судинних захворювань при користуванні новими пігулками з малою дозою невисокий. Частота госпіталізацій із приводу серйозних серцево-судинних захворювань, що пов''язані з уживанням комбінованих пероральних контрацептивів зі зменшеною дозою (або яких не було уникнуто, незважаючи на прийом цих препаратів), характеризується такими показниками: один інфаркт міокарда, три інсульти й 11 випадків тромбозу або емболії вен на 100 тис. користувачок цих засобів [46].
Базовий показник частоти випадків тромбозу/емболії вен серед невагітних жінок репродуктивного віку, які не вживають пероральних контрацептивів, становить 0,8 на 10 тис. жінко-років. Аналогічний показник серед користувачок пероральних контрацептивів, що містять 20–50 мкг етинілестрадіолу, за даними широкомасштабного обсерваційного дослідження, дорівнює трьом. Це майже в чотири рази вище від базового показника, однак удвічі нижче показника 6 на 10 тис. жінко-років, пов''язаного з вагітністю [47]. Жінки зі спадковими розладами зсідання крові (наприклад, із недостатністю білків С та S, фактора Ляйдена, антитромбіну III чи з резистентністю до активованого білка С) належать до групи високого ризику. Одне з досліджень показало, що загальний ризик розвитку тромбозу в користувачок пероральних контрацептивів збільшився від базового показника 6 до 30 на 10 тис. жінко-років [48]. Жінок з родинним або особистим анамнезом, обтяженим випадками тромбозу, рекомендується піддавати скринінговому обстеженню на виявлення цих дефіцитарних розладів зсідання крові.
Чотири обсерваційних дослідження показали, що ризик тромбозу/емболії вен у користувачок пероральних контрацептивів третього покоління зріс порівняно з аналогічним показником, пов''язаним із вживанням препаратів другого покоління. Хоча ці висновки викликали стурбованість, подані результати стосовно тривалості користування були суперечливі; до того ж при вживанні пероральних контрацептивів третього покоління порівняно з другим спостерігалося значно нижче відношення шансів (ВШ) щодо інфаркту міокарда. Після того як дані транснаціонального дослідження повторно проаналізували з урахуванням тривалості вживання пероральних контрацептивів кожного типу, виявилося, що ризик тромбозу/емболії вен для жінок, які вперше приймали препарати третього покоління, залежить від тривалості приймання попередніх контрацептивів і що він практично ідентичний для пігулок другого і третього покоління (табл. 5).
Б. Вуглеводний обмін. У жінок, які вживають сучасні пероральні контрацептиви зі зменшеною дозою активних речовин, не виявлено клінічно значущих змін вуглеводного обміну, хоча давніші пігулки з великою дозою справляли значний вплив на концентрацію глюкози й інсуліну. Дані щодо впливу естрогенного компонента суперечливі, однак найімовірніше, що він діє синергічно з прогестином, погіршуючи толерантність до глюкози [49]. Загалом чим вищі доза й активність прогестину, тим більшою мірою порушуються процеси метаболізму глюкози. Завдяки тому, що препарати з низькою дозою не справляють істотного впливу на концентрацію глюкози, інсуліну та глюкагону, ними можуть без особливого ризику користуватися жінки з анамнезом гестаційного діабету [50] і багато хто з інсулінозалежних хворих на діабет. Дослідження з вивчення стану здоров''я медичних сестер показало, що хоча діабет типу 2 розвився в понад 2000 жінок, ризик серед користувачок сучасних пероральних контрацептивів не зріс (RR = 0,86, 95% ІН 0,46–1,61) [51].
В. Ліпіди й довготерміновий ризик атеросклерозу. Естрогени, що входять до складу пероральних контрацептивів, підвищують концентрацію ліпопротеїдів високої щільності, загального холестерину й тригліцеридів, знижуючи концентрацію ліпопротеїдів низької щільності. Прогестинний компонент, навпаки, сприяє зниженню концентрації ліпопротеїдів високої щільності, загального холестерину й тригліцеридів, підвищуючи концентрацію ліпопротеїдів низької щільності. Більш ранні препарати, у складі яких домінував прогестин, мали загалом негативний вплив на ліпідний обмін, тоді як сучасні засоби з низькою дозою цього компонента, за наявними даними, не спричиняють значних змін концентрацій ліпопротеїдів високої і низької щільності та загального холестерину (хоча концентрація тригліцеридів підвищується). Препарати з високим відношенням кількості естрогену до кількості прогестину (тобто такі, що містять не більше ніж 0,5 мг норетиндрону або нових прогестинів) підвищують концентрацію ліпопротеїдів високої щільності та тригліцеридів, знижуючи концентрацію ліпопротеїдів низької щільності (рис. 7) [52, 53, 53а].
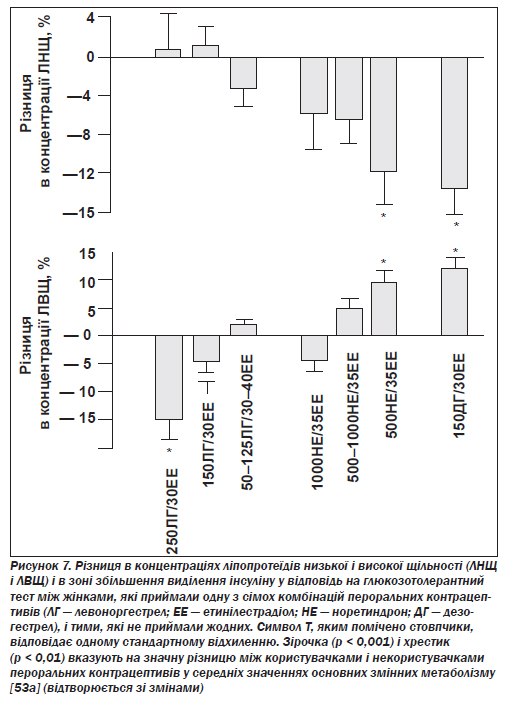
Незважаючи на певні зміни концентрації ліпідів, у жінок, які в минулому користувалися пероральними контрацептивами старого чи нового типу, не спостерігається підвищення ризику розвитку атеросклерозу [54, 55]. Нагромаджується дедалі більше даних, які, по суті, свідчать про те, що пероральні контрацептиви мають довготерміновий захисний ефект щодо захворювань судин [56], хоча існує короткотерміновий ризик виникнення тромбозу, пов''язаний із поточним вживанням пероральних контрацептивів. Результати ангіографічного обстеження молодих жінок, у яких було діагностовано інфаркт міокарда, підтверджують, що в тих з них, які в поточному періоді вживають пероральні контрацептиви, інфаркт частіше зумовлюється тромбозом, а не атеросклерозом: коронарний атеросклероз було виявлено в 79 % пацієнток, що не користуються цими препаратами, і тільки в 36 % жінок, котрі приймають їх [57]. Ці дані підтримують наявність швидше довготермінового захисного впливу, ніж підвищеного ризику.
Г. Вплив на виникнення новоутворень
Ризик раку молочної залози. Оскільки естрогени стимулюють ріст тканини молочної залози, виникає занепокоєність стосовно ймовірності того, що пероральні контрацептиви можуть або викликати рак цього органа в користувачок, або активізувати розвиток злоякісного процесу. Всебічний науковий аналіз даних усіх опублікованих епідеміологічних досліджень, проведений у 1991 році, показав, що підсумковий показник відносного ризику в жінок, які вживають ці препарати, становить 1,0 (95% ІН 1,0–1,1) (табл. 6) [58].
Відносний ризик раку молочної залози в користувачок пероральних контрацептивів із родинним анамнезом цього захворювання і без нього вивчався у вісьмох дослідженнях типу «випадок — контроль» і одному когортному. Жодне з них не виявило значущої різниці в жодній з цих категорій [36].
У 1996 році міжнародна група повторно проаналізувала весь масив епідеміологічних даних глобального масштабу стосовно пероральних контрацептивів і раку молочної залози [59]. Аналіз виконувався на матеріалах 54 досліджень, проведених у 25 країнах із охопленням понад 53 тис. хворих на рак молочної залози і понад 100 тис. контрольних пацієнток. У жінок, які вживали пероральні контрацептиви, спостерігався трохи підвищений ризик розвитку цієї форми раку (RR = 1,24, 95% ІН 1,15–1,33) [59], який неухильно зменшувався після припинення прийому препаратів і через десять років після цього не перевищував 1,01 (95% ІН 0,96–1,05). Цікаво, що порівняно з іншими жінками, в яких було діагностовано рак молочної залози, у користувачок пероральних контрацептивів він виявлявся на більш ранній стадії клінічного розвитку. Ризик наявності раку, що поширився за межі молочної залози, порівняно з пухлиною, локалізованою в її межах, у жінок, які в поточному періоді вживають ці препарати, значно нижчий (RR = 0,88, 95% ІН 0,81–0,95), ніж у тих, котрі ними не користуються.
Загалом більшість даних стосовно пероральних контрацептивів має заспокійливий характер. Імовірно, що протизаплідні стероїди активізують ріст вже наявної злоякісної пухлини й одночасно підвищують шанси на її ранню діагностику, таким чином уникаючи звичайної ситуації, коли проходить багато років, поки рак молочної залози виявляється клінічно. На підставі результатів досліджень рекомендується застосовувати пероральні контрацептиви з найменшою дозою активних речовин.
Рак шийки матки. Епідеміологічні дані щодо ризику виникнення інвазивного раку шийки матки в користувачок пероральних контрацептивів суперечливі. Результати деяких досліджень можуть пояснюватись впливом факторів, що втручаються, таких як кількість сексуальних партнерів, вік на момент першого статевого контакту, інфікування вірусом папіломи людини, використання бар''єрних контрацептивів і сперміцидів, тютюнокуріння, частота цитологічних досліджень. Шлесельман у своєму огляді за матеріалами 14 досліджень, що охоплювали понад 3800 жінок з інвазивним раком шийки матки, доходить висновку про значне підвищення ризику зі збільшенням тривалості вживання пероральних контрацептивів (рис. 8) [60].
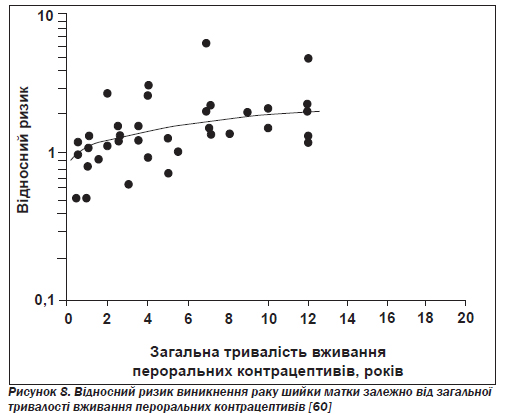
У публікаціях за даними інших досліджень повідомляється, що внаслідок довготермінового вживання ризик підвищується в 1,5–2,5 раза [61, 62]. На відміну від цих даних деякі добре контрольовані дослідження не виявили змін щодо ризику виникнення внутрішньоепітеліальної неоплазії шийки матки, пов''язаних із використанням пероральних контрацептивів [61, 63]. У статті за результатами популяційного дослідження типу «випадок — контроль» стверджувалося, що пероральні контрацептиви й тютюнокуріння впливають на здатність вірусу папіломи людини викликати інвазивний рак шийки матки [64]. Автори припускають, що вживання пероральних контрацептивів може відігравати значну роль в етіології інвазивних сквамозноклітинних пухлин шийки матки тільки тоді, коли ці препарати вживаються в критичний період розвитку жіночого репродуктивного тракту, тобто у віці до 17 років.
Рак ендометрію. Тринадцять із п''ятнадцятьох досліджень (типу «випадок — контроль» і когортних) показали, що пероральні контрацептиви захищають від раку ендометрію — третього за поширеністю різновиду раку серед жінок у США [65]. Жінки, які вживали такі препарати хоча б один рік, мали на 50 % менший ризик розвитку раку ендометрію у віці від 40 до 55 років порівняно з тими жінками, котрі ними не користувалися. Виявлено значущу тенденцію зменшення ризику зі збільшенням тривалості використання комбінованих контрацептивів (рис. 9) [60].
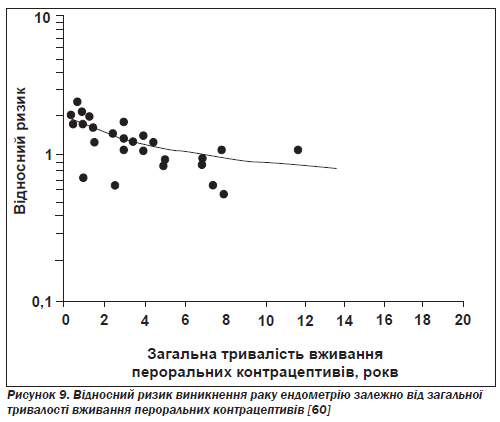
Найвищий захисний ефект спостерігався в жінок, які не народжували, причому він забезпечувався при використанні комбінованих препаратів як з великою, так і з малою дозою прогестину [66].
Рак яєчника. Як відзначено у вісімнадцятьох із двадцятьох публікацій за матеріалами відповідних досліджень, серед користувачок пероральних контрацептивів зменшується ризик виникнення раку яєчника, особливо його найпоширенішого різновиду — епітеліального раку яєчника (рис. 10) [67].
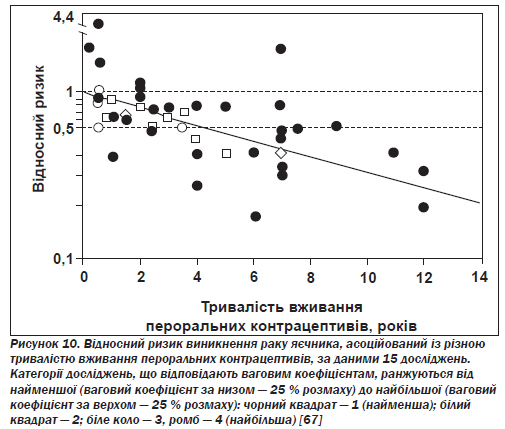
Підсумковий (отриманий на базі сукупних даних) показник відносного ризику розвитку раку яєчника серед жінок, які коли-небудь вживали ці препарати, становить 0,64, тобто зниження дорівнює 36 %. Пероральні контрацептиви знижують ризик виникнення чотирьох основних гістологічних типів епітеліального раку яєчника (серозного, мукозного, ендометріоїдного й паренхіматозноклітинного), а також як інвазивного раку яєчника, так і форм із низьким потенціалом злоякісного росту. Ступінь зниження ризику безпосередньо пов''язаний з тривалістю вживання препаратів і коливається від 40 % після чотирьох років до 53 % після восьми і до 60 % після дванадцяти років. Захисний ефект починає проявлятися в межах десятьох років від початку вживання пероральних контрацептивів і зберігається принаймні протягом 20 років після припинення прийому. При використанні монофазових препаратів з низькою дозою активних речовин та інших контрацептивів з вищою дозою спостерігається приблизно однаковий захисний ефект [68]. Як і в разі раку ендометрію, такий ефект виявляється лише в жінок, які народжували не більше ніж від одного до чотирьох разів, — тобто в тих, які належать до групи найвищого ризику щодо цього типу раку.
Гепатоаденома і рак печінки. У рідкісних випадках спостерігається розвиток доброякісної гепатоцелюлярної аденоми, пов''язаний із довготривалим вживанням пероральних контрацептивів із великою дозою активних речовин (особливо це стосується препаратів, що містять местранол). У публікації за матеріалами двох досліджень, проведених у Великобританії, повідомлялося про підвищений ризик раку печінки серед користувачок пероральних контрацептивів, однак значущість цих результатів знижується через невелику чисельність охоплених пацієнток і значну кількість сторонніх факторів, що втручаються [69]. Широкомасштабне багатоцентрове епідеміологічне дослідження, координоване ВООЗ, не виявило зростання ризику виникнення раку печінки навіть зі збільшенням тривалості вживання таких препаратів [70].
Аденома гіпофіза. Пероральні контрацептиви маскують симптоми пролактиноми, а саме аменорею й галакторею. Коли приймання препаратів переривається, ці симптоми проявляються, що наводить на думку про наявність причинного зв''язку. Однак дані трьох досліджень свідчать про те, що захворюваність на аденому гіпофіза серед користувачок протизаплідних пігулок не вища від спостережуваної серед контрольних пацієнток, дібраних за принципом парності [71].
Злоякісна меланома. Кілька епідеміологічних досліджень з вивчення зв''язку між вживанням пероральних контрацептивів і розвитком злоякісної меланоми дали неоднозначні результати. Автори публікації за матеріалами дослідження щодо пероральних контрацептивів, здійсненого Королівським коледжем лікарів загальної практики (Великобританія), і дослідження, проведеного в Оксфорді Асоціацією планування родини (з охопленням понад 450 тис. жінко-років спостереження), дійшли висновку, що вживання пероральних контрацептивів, найімовірніше, не асоціюється зі зростанням ризику виникнення меланоми [72].
5. Протипоказання щодо використання пероральних контрацептивів
Призначати пероральні контрацептиви більшості жінок репродуктивного віку цілком безпечно. До абсолютних протипоказань належить анамнез тромбоемболії, атеросклерозу, інсульту чи будь-якого системного захворювання, пов''язаного з ураженням судин (вовчак, діабет із ретинопатією, нефропатія та тощо). У перелік протипоказань входять також куріння у віці понад 35 років, неконтрольована гіпертонія, вагітність, макроаденома гіпофіза, мігреневий головний біль із локалізованими ознаками, гостра хвороба печінки, рак молочної залози або ендометрію. Не слід призначати пероральні контрацептиви й жінкам з функціональними серцевими захворюваннями, оскільки в таких випадках затримка рідини в організмі може призвести до серцевої недостатності. Відносним протипоказанням є підвищений кров''яний тиск у літніх або повних жінок.
Не є протипоказаннями асимптоматичне пролабування стулок мітрального клапана серця, вік за 40 років, перенесена в минулому хвороба печінки, випадки раку молочної залози в родинному анамнезі, контрольований діабет, пролактинсекретуюча мікроаденома гіпофіза. Користування пероральними контрацептивами слід припинити, якщо на тлі їх вживання в жінки виникає сильний головний біль, непритомність, тимчасова втрата зору чи мови, парестезії.
6. Взаємодія з іншими препаратами
Деякі лікарські засоби, такі як барбітурати, сульфаніламіди, циклофосфан і рифампіцин, перешкоджають дії пероральних контрацептивів, стимулюючи ферменти печінки, що перетворюють відповідні стероїди на більш полярні й менш біологічно активні метаболіти. У жінок, які приймають ці ліки, може спостерігатися більша частота невдач у запобіганні вагітності. Клінічні дані щодо показників невдач під час лікування певними антибіотиками (зокрема, пеніциліном, ампіциліном і тетрацикліном), сульфаніламідами, анальгетиками й барбітуратами (наприклад, фенітоїном) суперечливі.
7. Користь для здоров''я, не пов''язана з контрацепцією
На додаток до того, що пероральні контрацептиви являють собою один з найефективніших засобів контрацепції, вони ще й справляють позитивну дію на здоров''я жінки в багатьох його аспектах.
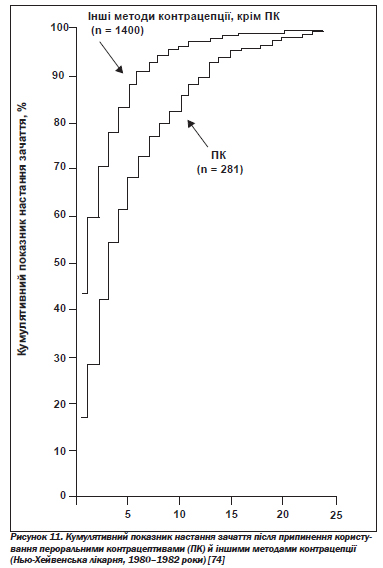
А. Вплив на репродуктивну функцію. Пероральні контрацептиви мають довготривалий сприятливий вплив на фертильність, зменшуючи ризик сальпінгіту, позаматкової вагітності, формування кісти яєчника. Однак вони також дають короткотривалий негативний ефект, пов''язаний із періодом затримки (більшим чи меншим) відновлення овуляції після припинення їх прийому: протягом двох років після цього фертильність залишається нижчою порівняно зі спостережуваною після припинення користування бар''єрними засобами контрацепції (рис. 11) [73, 74].
Естроген справляє проліферативну дію на тканини молочної залози, що містять естрогенні рецептори. Припускають, що прогестини пригнічують синтез цих рецепторів у залозі, таким чином справляючи на неї антиестрогенну дію. Кілька досліджень показали, що пероральні контрацептиви знижують частоту виникнення доброякісних пухлин молочної залози, причому цей ефект безпосередньо пов''язаний із кількістю прогестину. За даними досліджень, серед жінок, які в поточному періоді вживають пероральні контрацептиви, спостерігається 85% зменшення частоти випадків фіброаденоми й 50% — хронічного полікістозу й пухлин молочної залози (не перевірених біопсією) порівняно з тими жінками, котрі не використовують цих препаратів [75].
В. Користь від пригнічення овуляції. Такі розлади, як дисменорея, передменструальне напруження, рідше виникають в ановуляційних циклах. Серед тих користувачок, які раніше страждали від дисменореї, тільки приблизно 30 % повідомляють про відсутність покращення після того, як вони почали приймати пероральні контрацептиви [76]. Комбіновані пероральні контрацептиви зі зменшеною дозою активних речовин фактично усувають у більшості жінок циклічні симптоми передменструального синдрому [77]. Пригнічення овуляції зменшує ймовірність розвитку функціональних кіст (табл. 7) [78];
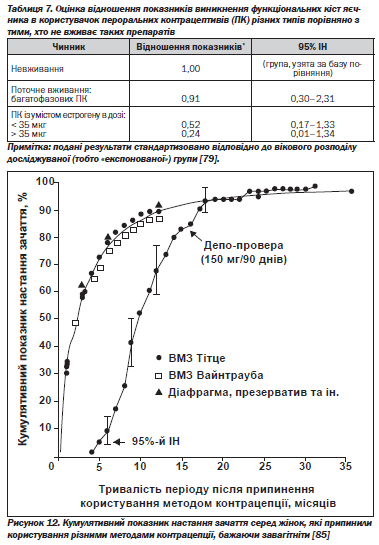
на тлі прийому пероральних контрацептивів частота виникнення таких кіст знижується на 80–90 % [75]. Багатофазові препарати також мають подібний захисний ефект, хоча й менш виражений. Інші розлади, пов''язані з постійною овуляцією, рак яєчника також значно рідше трапляються в користувачок пероральних контрацептивів.
Г. Інші переваги. Кілька досліджень, проведених в Європі, показали, що ризик розвитку ревматоїдного артриту в користувачок пероральних контрацептивів удвічі менше, ніж у контрольній групі [79], хоча інші розвідки не виявили такого захисного ефекту [80]. Ще одна перевага — захисний ефект щодо сальпінгітів: ризик зменшується на 50 %, що може пояснюватися скороченням тривалості менструальної кровотечі або згущенням цервікального слизу, який перешкоджає проникненню збудників інфекції у верхні статеві шляхи. У жінок, які вживають пероральні контрацептиви в поточному періоді, більше ніж на 90 % знижується ризик позаматкової вагітності [41]. За даними кількох досліджень, ці препарати уповільнюють процес зниження щільності кісток у перименопаузі [81] (особливо в жінок із олігоменореєю), зменшують ризик виникнення фіброміом [82] і поліпшують контроль над кровотечею [83].
Ґ. Ін''єкційні протизаплідні засоби тривалої дії
Оскільки більшість ін''єкційних стероїдних препаратів пролонгованої дії містять тільки прогестин без естрогену, ендометрій не підтримується й маткова кровотеча виникає нерегулярно, з непрогнозованими інтервалами. Упроваджено три типи ін''єкційних стероїдів: депо-препарати медроксипрогестерону ацетату (ДМПА); енантат норетиндрону; кілька комбінованих препаратів (з умістом прогестину й естрогену), що вводять один раз на місяць. Ін''єкційні протизаплідні засоби — популярний метод контрацепції в усьому світі, хоч у США офіціально затверджено для використання тільки ДМПА.
1. Депо-препарати медроксипрогестерону ацетату
ДМПА являє собою 17-ацетоксипрогестерон, тобто це єдиний із прогестинів, використовуваних для цілей контрацепції, який не є похідним від 19-нортестостерону. Ацетоксипрогестинам, структурно пов''язаним з прогестероном, не властива андрогенна активність. Медроксипрогестерону ацетат широко використовувався в складі пероральних контрацептивів доти, доки це не було заборонено в США після експериментів, які показали, що він підвищує ризик раку молочної залози в собак породи бігль (коротконога гонча). Згодом виявилося, що через певні особливості метаболізму в організмі цих тварин 17-ацетоксипрогестини перетворюються на естроген, стимулюючи гіперплазію молочних залоз. В організмі людини ДМПА не зазнає подібних перетворень. У 1992 році, після того як відповідні епідеміологічні дослідження довели, що ДМПА не підвищує ризик раку молочної залози в жінок, Управління США з санітарного нагляду за якістю харчових продуктів і ліків дозволило використовувати цей препарат як протизаплідний засіб.
У широкомасштабному випробуванні, проведеному ВООЗ, частота випадків вагітності на першому році вживання ДМПА становила лише 0,1 %, а кумулятивний показник за два роки не перевищував 0,4 %.
Основний механізм дії медроксипрогестерону ацетату полягає в пригніченні овуляції; на додаток до цього під його впливом слизова оболонка матки тоншає, що перешкоджає імплантації ембріона. Крім того, ДМПА викликає згущення й підвищення в''язкості цервікального слизу, таким чином зводячи до мінімуму імовірність досягнення сперматозоїдами фаллопієвих труб.
А. Фармакокінетика. У великому колі кровообігу ДМПА виявляється через 30 хвилин після ін''єкції; протягом 24 годин його концентрація в крові неухильно підвищується до ефективного рівня (більше 0,5 нг/мл). Потім упродовж трьох місяців вона підтримується на постійному рівні 1,0–1,5 нг/мл, а на п''ятому місяці знижується приблизно до 0,2 нг/мл. Нерідко препарат можна виявити в крові протягом сімох, іноді навіть дев''ятьох місяців. Концентрація естрадіолу протягом перших чотирьох місяців залишається нижчою від 100 пг/мл. Фолікулярна активність відновлюється на 2–3 місяці раніше, ніж лютеїнова. У декотрих користувачок ДМПА овуляція може не відновлюватися протягом сімох-дев''ятьох місяців, поки концентрація медроксипрогестерону ацетату не зменшиться до рівня нижче 0,01 нг/мл.
Б. Пригнічення овуляції. Мішель зі співавт. у своїй публікації повідомляють, що протягом перших двох місяців після ін''єкції, хоча пік екскреції ЛГ і ФСГ у середині циклу гальмується, секреція цих гормонів усе ще відбувається в пульсуючому ритмі [84]. Упродовж цього проміжку часу в жінок, які використовували ДМПА протягом чотирьох-п''яти років, концентрація естрадіолу коливається від 5 до 100 пг/мл (у середньому — 42 пг/мл), але жодна з них не скаржилася на симптоми, пов''язані з гіпоестрогенним станом.
В. Відновлення фертильності. Оскільки для виведення ДМПА з системи кровообігу потрібен певний час, відновлення овуляції може затриматися навіть на рік з моменту останньої ін''єкції. Після цієї затримки повертається нормальна здатність до зачаття (рис. 12) [85].
Тривалість інтервалу між припиненням вживання препарату й відновленням фертильності не залежить від кількості ін''єкцій, але збільшується з підвищенням маси тіла жінок — найімовірніше, через те, що медроксипрогестерону ацетат абсорбується жировими тканинами, звідки він виводиться повільніше.
Г. Зміни ендометрію. Біопсія ендометрію, зразки тканини для якої відбиралися з інтервалом в 1,5; 3; 6; 9 і 12 місяців після першої ін''єкції ДМПА в групі жінок, які отримували цей препарат один раз у три місяці, показала, що протягом шістьох тижнів приблизно в половині зразків тканина була проліферативною. Після другої ін''єкції проліферативними були менше ніж 10 % біопсій. Більшість зразків визначалися як неактивний тип ендометрію, а після року прийому ДМПА приблизно 40 % характеризувались як атрофічні.
Ґ. Побічні явища
Клінічні прояви. Найголовніший побічний ефект ДМПА — цілковите порушення менструального циклу. Упродовж трьох місяців після першої ін''єкції приблизно в 30 % жінок спостерігалася аменорея, а в інших 30 % — нерегулярні кровотечі й кров''янисті виділення в міжменструальному періоді, які тривали понад 11 днів на місяць. Кровотеча звичайно була незначною й не викликала анемії. Наприкінці другого року користування ДМПА аменорея розвинулася приблизно в 70 % жінок [86]. Після припинення прийому ДМПА через шість місяців регулярні цикли відновилися майже в половини жінок, а до закінчення року з моменту останньої ін''єкції — у трьох чвертей.
За даними п''ятьох одномоментних поперечних досліджень, у жінок, які вживали ДМПА, маса тіла була більша, ніж у тих, що не користувалися гормональними контрацептивами [36]. Кілька лонгітудинальних (поздовжніх) досліджень показали, що користувачки ДМПА набирають від 1,5 до 4 кг маси тіла на рік [87]; цей показник вищий від типового показника збільшення ваги, що становить близько 1 кг на рік.
В інструкції, що додається до препарату, серед побічних явищ ДМПА перелічуються також депресія й зміни настрою. Однак за даними кількох досліджень частота випадків цих розладів не досягає й 5 %. Для з''ясування питання щодо наявності причинного зв''язку між користуванням ДМПА й розвитком депресії не провадилося жодних клінічних випробувань із застосуванням групи порівняння. Головний біль, за багатьма повідомленнями, є найчастішим ускладненням медичного характеру й найпоширенішою причиною припинення вживання ДМПА, однак знов-таки не було жодного компаративного дослідження, яке б засвідчило, що ці препарати підвищують частоту виникнення або ступінь тяжкості головного болю напруження чи мігреневого болю.
Вплив на метаболізм. Оскільки ДМПА не активізує вироблення глобулінів печінки, на тлі його вживання не спостерігається змін у факторах системи згортання крові чи в концентрації ангіотензиногенів. Ці препарати також не пов''язують із підвищенням кров''яного тиску або з випадками тромбоемболії. У результаті дослідження, проведеного ВООЗ, було відзначено, що після двох років ін''єкцій показники кров''яного тиску в користувачок ДМПА не змінилися [88].
Середні значення концентрації тригліцеридів і загального холестерину під час використання ДМПА не змінюються (або спостерігаються лише незначні зміни). У всіх сімох дослідженнях, в яких визначали концентрацію ліпопротеїдів високої щільності, цей показник був нижчий у тих жінок, котрі користувалися ДМПА. Три з п''ятьох досліджень, у ході яких вимірювалася концентрація ліпопротеїдів низької щільності, показали її підвищення в користувачок ДМПА [36]. Жодне з досліджень не виявило збільшення частоти випадків серцево-судинних хвороб серед жінок, які протягом тривалого часу вживали ДМПА (у поточному періоді або в минулому), а також немає даних, які б підтверджували, що ДМПА пришвидшує розвиток атеросклерозу.
Остеопороз. В одномоментному поперечному дослідженні, де було застосовано метод сканування кісток DEXA, у 30 жінок, які протягом тривалого часу користувались ДМПА, виявилося зниження щільності кісток у поперековому відділі хребта, а також стегнових кісток порівняно з 30 жінками, які не користувалися цими препаратами [89]. Катамнестичне спостереження показало, що після припинення прийому ДМПА щільність кісток повертається до норми [89]. Ці дані дають підставу припускати, що зниження щільності кісток під час користування ДМПА можна звести до мінімуму (або уникнути цього зовсім) за умови достатнього вживання кальцію. Інші довготривалі дослідження не виявили зменшення щільності кісток у користувачок ДМПА, і досі жодне дослідження не продемонструвало зростання ризику переломів кісток у жінок, які користувалися чи користуються ним [36].
Ризик виникнення раку. Протягом багатьох років відповідні органи не давали дозволу на використання ДМПА для цілей контрацепції в США, оскільки існували побоювання щодо можливого підвищення ризику раку шийки матки, молочної залози й ендометрію. Результати двох широкомасштабних досліджень типу «випадок — контроль» показали, що серед користувачок ДМПА не спостерігається підвищення відносного ризику раку молочної залози [90, 91]. У жінок, що вживали ці препарати понад п''ять або понад чотирнадцять років тому, такий ризик теж не зріс (відповідно RR = 1,0, 95% ІН 0,7–1,5 і RR = 0,89, 95% ІН 0,63–1,3). Однак серед жінок до 35 років, які почали користуватися ДМПА в останні п''ять років, було помічено значне зростання ризику раку молочної залози (RR = 2,0, 95% ІН 1,5–2,8), порівнянне зі спостережуваним серед користувачок пероральних контрацептивів. Загалом ДМПА, судячи з наявних даних, не впливає на частоту випадків розвитку раку молочної залози.
Дослідження типу «випадок — контроль», проведене ВООЗ, виявило серед користувачок ДМПА значно знижений ризик виникнення раку ендометрію (RR = 0,21, 95% ІН 0,06–0,79), причому цей ефект зберігається щонайменше протягом восьми років після припинення вживання препаратів [92].
Ризик розвитку раку яєчника серед користувачок ДМПА, згідно з результатами дослідження ВООЗ типу «випадок — контроль», практично не змінюється (RR = 1,1, 95% ІН 0,6–1,8) [93]. Ці дані не демонструють захисного ефекту, подібного до виявленого серед користувачок пероральних контрацептивів, хоча препарати обох типів пригнічують овуляцію. Відсутність захисного ефекту, спостережувана при використанні ДМПА, може пояснюватись тим, що в країнах, де здійснювалося дослідження, ці контрацептиви застосовували тільки до жінок, які неодноразово народжували (а отже, належать до групи з низьким ризиком розвитку епітеліального раку яєчника).
Значного зростання ризику розвитку інвазивного раку шийки матки, за даними кількох широкомасштабних досліджень типу «випадок — контроль», не спостерігається (RR = 1,1, 95% ІН 1,0–1,3) — ні при короткочасному, ні при тривалому використанні ДМПА. Згідно з результатами дослідження ВООЗ, загальний ризик розвитку раку in situ в користувачок ДМПА трохи підвищується (RR = 1,4, 95% ІН 1,2–1,7), однак такої тенденції не виявлено в одній з охоплених країн — Коста-Риці (RR = 1,0, 95% ІН 0,6–1,8) [94], а також у Новій Зеландії (за даними двох досліджень, проведених у цій країні) [95, 96].
Д. Користь для здоров''я, не пов''язана з контрацепцією. Існують переконливі епідеміологічні дані, які свідчать про те, що користування ДМПА зменшує ризик розвитку залізодефіцитної анемії, ЗТО та раку ендометрію й позитивно впливає на стан жінок із серпоподібноклітинною анемією (табл. 8).
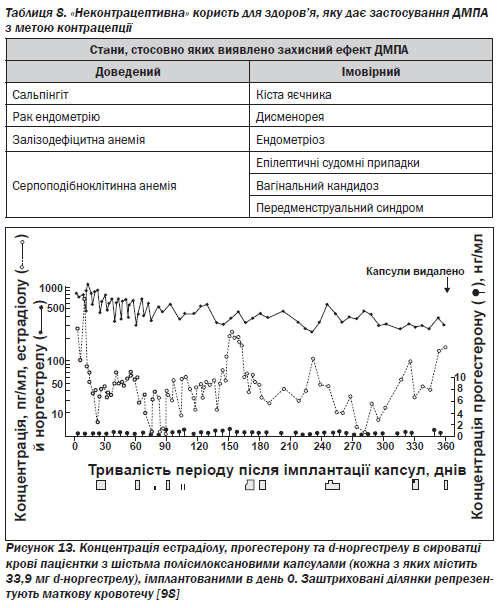
Є підстави припускати, що ці препарати також знижують частоту судомних припадків у жінок, хворих на епілепсію, і частоту виникнення первинної дисменореї, функціональних кіст яєчника, болю під час овуляції. Крім того, вони пом''якшують симптоми ендометріозу, а згідно з результатами двох невеликих досліджень сприяють зниженню захворюваності на вагінальний кандидоз [36].
2. Норетиндрону енантат (Нет-Ен)
Норетиндрону енантат — ін''єкційний прогестинний препарат, дозволений для використання як протизаплідний засіб у понад 40 країнах, до яких, однак, не належать США. Через менш тривалу дію рекомендовано вводити Нет-Ен (200 мг у маслянистій суспензії) кожні 60 днів принаймні в перші шість місяців використання, а відтак — не рідше ніж один раз у 12 тижнів.
3. Прогестино-естрогенний ін''єкційний препарат (для щомісячного введення)
З огляду на те що в користувачок засобів, що містять тільки прогестин, часто виникали проблеми, пов''язані з кровотечею, було розроблено кілька комбінованих ін''єкційних препаратів складного ефіру прогестину-естрадіолу. Вони призначені для введення один раз на місяць і часто асоціюються з регулярними кровотечами в період припинення дії активних речовин. Нині найпопулярніші чотири варіанти складу таких препаратів. Контрацептив, який застосовують у Китаї, містить 250 мг 17α-гідроксипрогестерону капронату і 5 мг естрадіолу валерату, а використовуваний у Мексиці та в інших країнах Латинської Америки — 150 мг дигідроксипрогестерону ацетофеніду і 10 мг естрадіолу енантату. Всесвітньою організацією охорони здоров''я розроблено дві нові формули, що їх застосовують у програмах планування сім''ї кількох країн. Комбінований препарат, що містить 25 мг медроксипрогестерону ацетату з естрадіолу ципіонатом, надходить на ринок під назвою циклофем (або циклопровера), а засіб, до складу якого входять 50 мг норетиндрону енантату й 5 мг естрадіолу валерату, — під назвою месигина. Ці препарати дають змогу контролювати кровотечу краще, ніж ті, що містять тільки прогестин. Майже в 85 % випадків цикли регулярні, а частота аменореї низька. За результатами п''ятьох клінічних випробувань, при вживанні циклофему й месігини частота випадків вагітності не перевищує відповідно 0,4 і 0,2 % за 12 місяців [97].
Д. Підшкірні імплантати
Підшкірні імплантати — капсули з полідиметилсилоксану (силастик, або силіконова гума), що містять левоноргестрел, — були розроблені Радою з проблем народонаселення США й дозволені до впровадження в Сполучених Штатах у 1990 році. Сьогодні 5,5 млн жінок використовують норплант, дозволений відповідними органами державного регулювання 60 країн. Доза стероїдів, що виділяються в організм, прямо пропорційна площі поверхні капсули, а тривалість дії залежить від кількості стероїдів у капсулах. Кожна з шістьох циліндричних капсул (довжина 3,4 см, зовнішній діаметр 2,4 мм), що імплантуються в жирову підшкірну клітковину, містить 36 мг кристалічного левоноргестрелу.
Після імплантації капсул концентрація левоноргестрелу в сироватці крові швидко зростає, досягаючи рівня 1000–2000 пг/мл за 24 години. Після закінчення першого місяця вона залишається відносно постійною протягом року (рис. 13) [98].
Через п''ять років середня концентрація левоноргестрелу в сироватці крові становить 170–350 пг/мл (у повніших жінок цей показник нижче, ніж у худих). Щоденний показник виділення левоноргестрелу становить у середньому 50 пг/мл протягом першого року й спадає до 30 пг/мл через вісім років.
1. Механізм дії
Визначити частоту овуляційних циклів у користувачок норпланту дуже важко. Згідно з даними одного дослідження, в якому показником концентрації прогестерону в сироватці крові понад 3 нг/мл скористались як ознакою наявності овуляції, приблизно в третині випадків цикли, можливо, були овуляційні. Однак концентрація прогестерону в користувачок виявилася значно нижчою порівняно зі спостережуваною в контрольних учасниць, що свідчить про високу частоту наявності дефіциту гормону жовтого тіла та/або ановуляційних лютеїнізованих фолікулів. Результати щоденного ультразвукового сканування яєчників у користувачок норпланту, в котрих спостерігалися регулярні цикли й підвищена концентрація прогестерону в лютеїновій фазі, показали, що тільки в одній третині циклів картина, отримана за допомогою ультразвукового сканування, збігалася з типовою для овуляції [99]. Оскільки лише половина циклів асоціювалися в користувачок з нормальними менструаціями, отримані дані дають підставу вважати, що в цих жінок овуляційними були менше ніж 20 % циклів і що в багатьох з них знижено вироблення прогестерону.
Через низьку концентрацію левоноргестрелу в крові гонадотропіни в користувачок норпланту пригнічуються не повністю, і фолікулярна активність яєчників спричиняється до періодичних піків екскреції естрадіолу. Левоноргестрел, що є в кровообігу, гальмує позитивний зворотний вплив естрадіолу на виділення ЛГ; отже, овуляція відбувається рідко, особливо протягом перших двох років. Крім того, ця низька концентрація левоноргестрелу запобігає нормальному стоншенню шару цервікального слизу в середині циклу, і нормального проникнення сперматозоїдів не відбувається [100].
2. Ефективність
У кількох публікаціях за матеріалами більш ранніх досліджень повідомлялося про підвищену частоту невдач за два роки користування норплантом (1,7 % на рік) в повніших жінок (з масою тіла понад 70 кг) [101]. Однак в цих дослідженнях використовувалися капсули з трубок, виготовлених із матеріалу збільшеної щільності, і концентрація левоноргестрелу в сироватці крові була нижчою від тої, що спостерігалася при звичайних трубках. Зв''язок між масою тіла й ефективністю не підтверджено подальшими клінічними випробуваннями. Середньорічний показник частоти випадків вагітності за перші п''ять років поточного користування препаратом становив 0,2 на 100 жінок в усьому діапазоні варіантів маси тіла, що дає кумулятивний показник за п''ять років 1,1 % [92].
3. Позаматкова вагітність
Коли зачаття відбувається на тлі вживання норпланту (як і інших препаратів, що містять тільки прогестин), у значній частці випадків (17 %) виникає позаматкова вагітність. Однак завдяки високій ефективності методу загальна частота виникнення цієї патології в користувачок норпланту (1,3 на 1000 жінко-років) нижче, ніж серед тих американок, які не застосовували жодних методів контрацепції в період зачаття (1,0–1,5 %) [3].
4. Побічні явища
А. Клінічні прояви. Середнє значення концентрації естрадіолу в крові в користувачок норпланту приблизно таке саме, як у жінок із регулярними овуляційними циклами. Майже в половині випадків у користувачок препарату спостерігалися періодичні, нерегулярні піки екскреції естрадіолу (до 400 пг/мл), у 30 % спостерігалися її флуктуації (понад 400 пг/мл) і приблизно в 10 % вона була низькою (нижча від 75 пг/мл) [102]. Після падіння концентрації естрадіолу звичайно відбувалося відторгнення ендометрію й виникали маткова кровотеча або кров''янисті виділення.
Протягом першого року використання імплантатів епізоди кровотечі бувають здебільшого тривалішими й нерегулярними, після чого найчастіше встановлюються регулярні цикли. За даними досліджень, на першому році приблизно в 35 % користувачок цикли були регулярні, у 55 % — нерегулярні, а в 10 % спостерігалася аменорея (рис. 14), тоді як на п''ятому році майже в двох третинах випадків цикли були регулярні і в одній третині — нерегулярні.
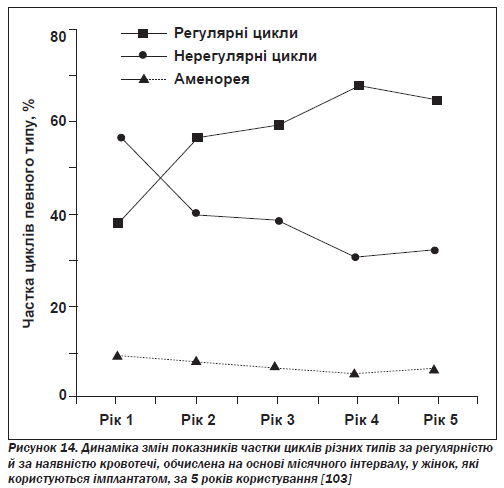
Середня кількість днів кровотечі постійно зменшувалася: від майже 54 днів у першій рік до 44,1 в п''ятий [103]. Незважаючи на зростання (порівняно з жінками, які не користуються імплантатами) кількості днів кровотечі й наявності кров''янистих виділень, у користувачок норпланту (навіть у тих, що відмовилися від цього методу контрацепції через кровотечу) підвищується концентрація гемоглобіну завдяки зменшенню середнього об''єму втрат менструальної крові (менше від 25 мл на місяць).
Спостерігаються й інші ускладнення, зокрема локальна інфекція, подразнення, болюча реакція в місці введення імплантату під шкіру. Зрідка трапляється спонтанне вигнання (експульсія) капсули, найчастіше у зв''язку з інфекцією. Частота випадків інфікування в місці імплантації не перевищує 1 % [3]. Найпоширеніший медичний стан, через який жінки припиняють користуватись імплантатами, — головний біль (цією причиною пояснюються 30 % відмов від продовження користування ними). Друга поширена причина видалення імплантатів, згідно з результатами досліджень, проведених у США, — збільшення маси тіла (тоді як у Домініканській Республіці дослідники виявили, навпаки, втрату маси тіла). До інших медичних проблем належать акне, болючість молочних залоз, зміни настрою, почуття занепокоєності, депресія й збудженість.
Оскільки розвиток фолікулів у яєчниках без наступної овуляції — звичайне явище в користувачок імплантатів, збільшення придатків унаслідок постійної наявності нерозірваних фолікулів трапляється в них у вісім разів частіше, ніж у жінок із нормальними циклами. Ці гіпертрофовані фолікули, що в діаметрі можуть досягати 5–7 см, регресують спонтанно.
Користувачки норпланту, інфіковані вірусом генітального герпесу, скаржаться на частіші загострення після введення імплантату [3].
Б. Вплив на метаболізм. Вивчення вуглеводного обміну, хімії сироватки, функції печінки, концентрації кортизолу в сироватці, функції щитоподібної залози, імуноглобулінів і згортуваності крові в користувачок імплантатів виявило в них лише незначні зміни. За даними більшості досліджень, концентрація тригліцеридів, загального холестерину й ліпопротеїдів низької щільності в період використання імплантату трохи знижується, а концентрація ліпопротеїдів високої щільності або трохи знижується, або зростає [104]. Співвідношення між концентраціями загального холестерину й ліпопротеїдів високої щільності майже не змінюється, і це свідчить про те, що норплант, найімовірніше, не підвищує ризик атеросклерозу [36].
5. Уведення й видалення
Вводять імплантати в амбулаторних умовах; вся процедура триває приблизно п''ять хвилин. Використовуючи місцеву інфільтраційну анестезію, скальпелем роблять невеличкий (3 мм) розріз (зазвичай на внутрішній поверхні плеча) й імплантують капсули в тканини підшкірного шару в радіальному порядку.
Видалення імплантату — складніша процедура, ніж уведення, частково через те, що навколо кожної капсули розростається фіброзна тканина. Труднощі під час видалення найчастіше виникають унаслідок надто глибокого введення капсул. Відновлення овуляції відбувається приблизно так само, як у разі припинення приймання інших гормональних контрацептивів, і у перші три місяці показник відновлення становить 50 %, а протягом року — 86 %.
Показники продовження користування методом коливаються в межах 76–99 % у розрахунку на один рік й від 33 до 78 % — на п''ять років. Це приблизно такі самі показники, що й у випадку з ВМЗ; картина частково пояснюється тим, що для видалення імплантату жінка має повторно звернутися до клініки.
6. Нові перспективні розробки
Управління США з санітарного нагляду за якістю харчових продуктів і ліків затвердило новий імплантат під назвою норплант-2 (Norplant-2®), що складається з двох твердих стержнів, які легше вводити й видаляти, ніж шість капсул. Два чотирисантиметрових стержні, в яких міститься гомологічна суміш силастику (силіконової гуми) й кристалічного левоноргестрелу, мають такий самий загальний рівень виділення гормону (50 мкг на добу), як і шість капсул норпланту, кожна завдовжки 3,4 см. Одинарні імплантати з іншими прогестинами, зокрема з дезогестрелом (імпланон), нині проходять клінічні випробування. Тривалість дії імпланону — три роки; цей імплантат легко вводити й видаляти. Побічних явищ небагато, а ефективність залишається високою [105].
Е. Екстрена контрацепція
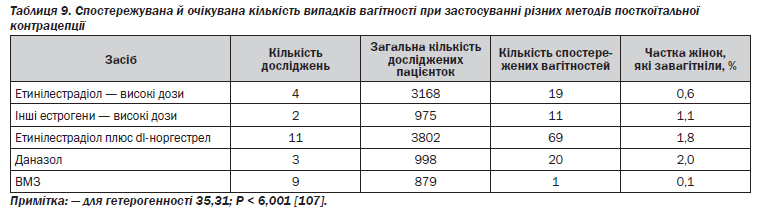
Для посткоїтальної контрацепції — або для того, що називають «пігулкою на ранок після» (маючи на увазі вживання протизаплідного засобу після незахищених статевих зносин), — застосовувалися препарати різного складу. За деякими оцінками, використання екстреної контрацепції могло б щороку зменшувати кількість небажаних вагітностей на 1,7 млн, а кількість абортів — на 800 тис. [106]. Термінове вживання пероральних контрацептивів знижує ризик вагітності після незахищених статевих зносин щонайменше на 74 % (табл. 9) [99, 107].
Екстрені протизаплідні засоби — це звичайні пероральні контрацептиви (2–4 таблетки на один прийом), що приймають упродовж 72 годин після незахищеного статевого акту, а повторну дозу — ще через 12 годин. Управління США з санітарного нагляду за якістю харчових продуктів і ліків схвалило для використання з метою екстреної контрацепції препарати ло/оврал, леврен, нордетт, трифазил, трилеврен. Однак через побічні явища (такі як нудота, блювання, болючість молочних залоз, порушення менструального циклу) жінки неохоче вдаються до цього методу контрацепції і нерідко не дотримуються схеми прийому препаратів.
Ще один варіант посткоїтальної контрацепції полягає в тому, що після незахищеного статевого акту вводять ВМЗ Сu-Т-380 на термін 7–10 діб. Цей спосіб застосовують у випадках, коли жінці показано застосування ВМЗ і вона планує після введення засобу використовувати його й далі.
Ефективним посткоїтальним контрацептивним засобом виявився також міфепристон (RU 486), якщо його приймають у дозі 600 мг [108].
Є. Внутрішньоматкові протизаплідні засоби
Основні переваги ВМЗ — висока ефективність, практична відсутність систематичних змін метаболізму, пов''язаних з їх використанням, а також можливість обмежитися лише одним відвідуванням клініки для введення пристрою. Але попри ці переваги, у Сполучених Штатах тільки 1 % жінок репродуктивного віку користуються ВМЗ, тоді як у більшості країн Європи та в Канаді цей показник становить 14–30 %.
1. Ефективність
Показник невдач упродовж першого року для Т-подібного ВМЗ із умістом міді типу Сu-Т-380А не перевищує 1 % (табл. 10), а для ВМЗ, що виділяють прогестерон, становить 2–3 % [4].
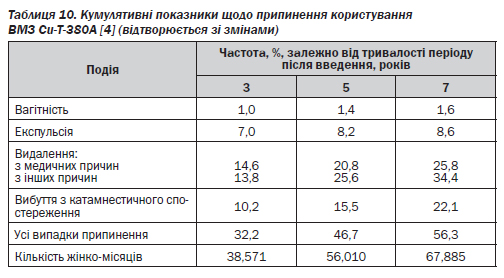
Частота випадків спонтанного вигнання (експульсії) ВМЗ і частота випадків вагітності значною мірою залежать від кваліфікації фахівця, який уводить ці засоби. Кумулятивний показник частоти випадків вагітності за сім років користування Сu-Т-380А — лише 1,6 %. Кількість усіх основних небажаних подій, пов''язаних із використанням ВМЗ (таких як вагітність, експульсія чи видалення ВМЗ через кровотечу та/або біль), постійно зменшується з роками (табл. 10) [4].
Нині ВМЗ Сu-Т-380А затверджено на 10 років використання.
2. Типи ВМЗ
У 60-х роках XX століття ВМЗ виробляли з поліетилену, імпрегнованого сульфатом барію (для забезпечення рентгеноконтрастності). У намаганні зменшити частоту побічних явищ, зокрема кровотечі й болю, було розроблено менші за розміром пластикові пристрої, вкриті міддю. У 80-х роках було запроваджено ВМЗ із підвищеним умістом міді, що складалися з двох рукавів на горизонтальному стержні, — такі як Cu-T-380A, Cu-T-220C, Multiload Cu-250 і Cu-375 (останній нині широко використовується в Європі).
Ефективність ВМЗ Т-подібної форми підвищується також додаванням резервуару з прогестероном до вертикального стержня. Наприклад, ВМЗ під назвою прогестасерт щодня виділяє в порожнину матки 65 мг прогестерону, забезпечуючи запобігання вагітності через місцеву дію, практично без підвищення концентрації прогестерону в сироватці периферійної крові. Завдяки цьому прогестаційному впливу на ендометрій об''єм маткової кровотечі зменшується, тому такі ВМЗ можна використовувати для лікування менорагії. Прогестасерт треба замінювати щороку, оскільки резервуар із прогестероном випорожнюється за 18 місяців.
Нині в Європі впроваджуються в практику ВМЗ Т-подібної форми з резервуаром, що містить левоноргестрел, на вертикальному стержні. Широкомасштабне компаративне випробування з порівняння Сu-Т-380А і ВМЗ із левоноргестрелом продемонструвало приблизно однаковий рівень ефективності й показників продовження користування. Тривалість дії ВМЗ з левоноргестрелом — щонайменше п''ять років. Він зменшує втрати крові під час менструацій і може використовуватися в терапевтичних цілях.
3. Механізм дії
Основний механізм контрацептивної дії ВМЗ полягає в сперміцидному ефекті, що забезпечується місцевою асептичною реакцією запалення, викликаною наявністю стороннього предмета в матці. Після введення жінці ВМЗ кількість лейкоцитів у маткових змивах зростає на 1000 % [109]. Лейкоцити спричинюють фагоцитоз сперми, а продукти їх розпаду токсичні як для сперми, так і для бластоцисти. Ступінь запальної реакції — а отже, й ефективності контрацепції — безпосередньо пов''язаний із розміром і складом ВМЗ. Мідь значно підвищує інтенсивність такої реакції, а також перешкоджає транспорту сперматозоїдів і знижує їхню життєздатність. До того ж мідь ускладнює просування сперматозоїдів крізь цервікальний слиз і знижує їхню життєздатність у ньому. Сперматозоїди практично не досягають фаллопієвих труб (а якщо й досягають, то лише в мізерній кількості), і яйцеклітина звичайно не запліднюється.
У жінок, яким уведено ВМЗ, значно порушується транспортування сперми від шийки матки до фаллопієвих труб у перші 24 години після зносин. До того ж у дослідженні, у ході якого жінок обстежували після незахищених статевих зносин незадовго до овуляції, запліднені яйцеклітини, що перебували в процесі нормального дроблення, були виявлені в трубних змивах приблизно в половини учасниць, котрі не користувалися ВМЗ, тоді як в користувачок ВМЗ жодної такої яйцеклітини знайдено не було [110]. Ще одним підтвердженням того, що ВМЗ діє скоріше як сперміцид, ніж як абортивний засіб, є дані, які показують, що хоча частота випадків внутрішньоматкової вагітності поступово зростає зі збільшенням тривалості використання ВМЗ, показник частоти випадків позаматкової вагітності залишається постійним і низьким [111]. Засоби з прогестероном дають вищу частоту випадків позаматкової вагітності, ніж ВМЗ із умістом міді, і можуть діяти через уповільнення транспортування ембріона матковими трубами або перешкоджаючи імплантації заплідненого яйця [36]. Такі пристрої посилюють вплив ВМЗ на ендометрій, призводячи до його відпадання з атрофією залоз. Крім того, прогестерон викликає згущення цервікального слизу, що ускладнює проникнення сперматозоїдів. Внутрішньоматкові пристрої, що містять левоноргестрел, крім того, частково гальмують процес дозрівання фолікулів в яєчниках і пригнічують овуляцію.
4. Фертильність після видалення ВМЗ
Після видалення ВМЗ запальна реакція скоро припиняється. Фертильність відновлюється швидко й на тому самому рівні, що й після припинення використання бар''єрних методів (рис. 12) [85, 112]. Стурбованість щодо зв''язку між ЗТО й користуванням ВМЗ нині можна звести до мінімуму, пропонуючи безпечні й ефективні ВМЗ жінкам із низьким ризиком інфікування хворобами, що передаються статевим шляхом.
5. Небажані явища
Загалом упродовж першого року використання ВМЗ частота випадків вагітності становить 1 %, експульсії — 10 %, видалення засобу за медичними показаннями (переважно через кровотечу й біль) — 15 %. У наступні роки ці показники постійно зменшуються.
6. Маткові кровотечі
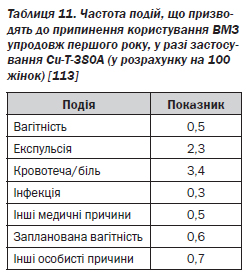
До найпоширеніших причин видалення Cu-Т належать затяжні менструації або маткові кровотечі в міжменструальному періоді (табл. 11) [113].
Точним індикатором запасів заліза в організмі є концентрація феритину в сироватці крові; якщо цей показник нижчий від 4 мкг/л, то для попередження анемії необхідно додатково приймати препарати заліза. Результати дослідження, у процесі якого концентрація феритину в сироватці крові пацієнток вимірювалася через 3, 6 і 12 місяців після введення ВМЗ Cu-Т, засвідчили відсутність істотних змін [115]. Сильні кровотечі, що не припиняються, можна лікувати інгібіторами простагландин-синтетази. Мефенамінова кислота (500 мг три рази на добу) значно зменшує крововтрату в користувачок ВМЗ [116].
7. Перфорація
Перфорація дна матки — відносно рідкісне ускладнення, що, однак, може мати серйозні наслідки. Воно трапляється під час уведення ВМЗ; іноді перфорація може бути частковою й пізніше перетворитися на повну, якщо скороченнями матки ВМЗ виштовхується крізь її стінку в черевну порожнину. Частота випадків перфорації залежить від форми ВМЗ, а також від досвіду й кваліфікації фахівців, які вводять ці пристрої. Це ускладнення найкраще попереджувати, зміцнюючи вісь матки за допомогою кульових щипців і ретельно обстежуючи порожнину матки матковим зондом перед уведенням ВМЗ. У широкомасштабному клінічному випробуванні з охопленням багатьох медичних установ частота випадків перфорації для Сu-7 (ВМЗ у вигляді цифри «7») становила приблизно 1 на 1000 уведень, а для Cu-Т — усього 1 на 3000 [117].
Частота випадків перфорації шийки матки, за опублікованими даними, коливається в межах від 1 на 600 до 1 на 1000 введень [84]. Вживаються певні заходи для зменшення ймовірності перфорації шийки матки, наприклад, з цією метою до нижнього кінця вертикального стержня Cu-Т було додано пластикову кульку.
8. Ускладнення, що стосуються вагітності
Якщо вагітність настає під час використання ВМЗ, імплантація відбувається в місці, віддаленому від пристрою, який, таким чином, завжди перебуває за межами амніону. Жодних повідомлень про зростання частоти внутрішньоутробних аномалій плода немає (щоправда, опублікованих даних стосовно подібних випадків узагалі обмаль).
Коли ВМЗ (будь-якого типу) залишалися в матці під час вагітності, частота випадків внутрішньоутробної смерті плода, за даними відповідних досліджень, не зростала, але частота спонтанних абортів становила приблизно 55 % — майже втричі більше звичайного показника [118]. Однак якщо ВМЗ було видалено (або відбулася його спонтанна експульсія), частота викиднів знижувалася до 20 %. Отже, ВМЗ слід видаляти, якщо прикріплені до нього спеціальні нитки залишаються в межах видимості, а в ранні терміни вагітності, як повідомляється в кількох публікаціях, його можна безпечно видалити під контролем ультразвуку, навіть коли нитки й не видно [119].
Якщо ВМЗ не видалено в ранні терміни, підвищується також ризик септичного аборту. Це пояснюється, принаймні частково, тим, що ВМЗ збільшує ризик спонтанних абортів (50 %), серед яких 2 % — септичні. Серйозні проблеми в аспекті септичних абортів були пов''язані з використанням ВМЗ типу Dalcon shield (нині не застосовується), зокрема з його багатофіламентним «хвостом». Патогенні мікроорганізми проникали в проміжки між філаментами, а ВМЗ у міру розвитку вагітності втягувався в маткову порожнину, що призводило до тяжких інфікувань, іноді навіть із фатальним кінцем [120].
9. Позаматкова вагітність
Відношення випадків позаматкової вагітності до загальної кількості вагітностей серед користувачок Cu-Т становить 39 на 1000, що майже втричі перевищує показник у загальній популяції (14,1 на 1000 вагітностей). Але оскільки Cu-Т ефективно запобігає виникненню будь-якої вагітності, оцінена частота випадків позаматкової вагітності не перевищує 0,2–0,4 на 1000 жінко-років [121]. У Сполучених Штатах частота випадків позаматкової вагітності серед сексуально активних жінок, які взагалі не вдаються до контрацепції, за різними оцінками, коливається від 1,5 до 4,5 на 1000 жінко-років; отже, жінки, які користуються Cu-Т, наражаються на значно менший ризик [121]. Частота випадків вагітності під час користування ВМЗ, що містять прогестерон, становить приблизно 30 на 1000 жінко-років, а частота випадків позаматкової вагітності — 7,5 на 1000 жінко-років. Це означає, що приблизно одна з чотирьох вагітностей, що трапляються на тлі користування таким ВМЗ, буде позаматковою.
Внутрішньоматкові засоби двох типів, доступні жінкам у Сполучених Штатах, по-різному впливають на ризик позаматкової вагітності: Cu-Т, поки знаходяться in situ, знижують цей ризик, а ВМЗ, що містять прогестерон, — підвищують [122].
Імовірність виникнення трубної позаматкової вагітності в користувачок ВМЗ (у період, коли ВМЗ знаходиться in situ) вища, ніж у жінок, які застосовують інші види контрацепції, але нижча, ніж у тих, котрі взагалі не вживають заходів для запобігання зачаттю [123]. Трубна вагітність трапляється в жінок, які користуються ВМЗ, частіше, ніж у тих, котрі вживають пероральні контрацептиви (RR = 3,8, 95% ІН 1,5–1,9) або застосовують бар''єрні методи (RR = 3,6, 95% ІН 1,6–8,1) [124]. Тривале користування ВМЗ у минулому пов''язане з підвищенням ризику [123]. У жінок, які користувалися ВМЗ (зокрема тими, що містять мідь) протягом трьох і більше років, імовірність трубної вагітності вдвічі вища, ніж у жінок, які ніколи не користувалися ВМЗ (відкоригований відносний ризик RR = 2,5, 95% ІН 1,5–4,3).
10. Передчасні пологи
За опублікованими даними, частота передчасних пологів у випадках, коли Cu-Т під час вагітності залишається in situ, в чотири рази вища, порівняно з тими випадками, коли Cu-Т було видалено. Дослідження, проведене у Великобританії, показало також зростання частоти випадків недоношеності: 13,6 % новонароджених, зачатих під час користування ВМЗ, з''явилися на світ з масою тіла менше від 2800 г проти 3 % серед зачатих під час застосування жінками інших методів контрацепції [125].
11. Запалення тазових органів
У 70-х ХХ ст. роках було опубліковано результати багатьох досліджень, які свідчили про те, що використання ВМЗ підвищує ризик запальних процесів у малому тазу. У 1996 році з''явилися дані дослідження, в якому в зразках тканини ендометрію, узятих через різні проміжки часу після введення ВМЗ «петля», виявлялися бактерії. Протягом перших 24 годин стерильна в нормі порожнина матки, вистелена ендометрієм, інфікувалася бактеріями. Через 24 години, однак, 80 % обстежених порожнин були стерильні [126]. З цих результатів випливає, що у випадках, коли ЗТО розвивається пізніше ніж через місяць після введення ВМЗ, це зумовлено інфікуванням збудником, який передається статевим шляхом, а не присутністю протизаплідного засобу в матці.
Це підтвердили й результати великомасштабного багатоцентрового дослідження з охопленням 24 тис. користувачок ВМЗ. Частота випадків ЗТО була найвища впродовж перших трьох тижнів після введення ВМЗ, а потім залишалася низькою протягом наступних вісьмох років, тримаючись на рівні показника 0,5 на 100 жінко-років. Інші дослідження підтримують висновок, що ризик ЗТО в жінок, які користуються Сu-7 або ВМЗ «петля», підвищується тільки впродовж перших чотирьох місяців після введення. У дослідженні, проведеному центрами з контролю і профілактики захворювань, вивчалася група користувачок ВМЗ, які мали тільки одного сексуального партнера впродовж останніх шістьох місяців. Підвищений ризик ЗТО було виявлено тільки у тих жінок, які були заміжні в минулому або ніколи не одружувались. Дослідники висунули припущення, що партнери таких жінок мали підвищений ризик передачі патогену, який відповідає за ЗТО. У заміжніх жінок (або тих, що жили з постійним партнером), які користувалися ВМЗ протягом понад чотири місяці, ризик ЗТО становив 1,0 [127].
За деякими даними, жінки, які користуються ВМЗ, можуть наражатися на підвищений ризик інфікування верхнього генітального тракту актиноміцетами. Якщо актиноміцети виявлено на рутинному мазку Папаніколау, слід розпочати відповідну антимікробну терапію. Видаляти ВМЗ у випадках, коли в пацієнтки не спостерігається патологічних симптомів, немає потреби. З''явилися повідомлення, що ВМЗ, які містять левоноргестрел, знижують ризик тазових інфекцій [128].
12. Безплідність
Використання Dalcon shield, а також, як припускають, тих пластикових ВМЗ, що не містять міді, може призводити до безплідності в жінок, котрі не народжували [129, 130]. У жінок, які будь-коли користувалися ВМЗ, ризик первинного трубного безпліддя, за деякими повідомленнями, у 3,7 раза вищий порівняно з тими, які ніколи не користувалися ВМЗ (95% ІН 2,2–6,1). Найвищого рівня це зростання відносного ризику, пов''язане з використанням ВМЗ, сягало в разі застосування Dalcon shield (RR = 6,0, 95% ІН 2,7–13,3). Значно підвищений ризик спостерігався також серед користувачок ВМЗ, що містять мідь (RR = 3,9, 95% ІН 2,0–7,4) [129].
За даними ще одного дослідження, відкоригований показник ризику первинної трубної безплідності, пов''язаної з використанням будь-якого ВМЗ жінкою до першого народження нею живої дитини, становить 2,0 (95% ІН 1,5–2,6) порівняно із жінками, які не користувалися ВМЗ. У користувачок ВМЗ з умістом міді спостерігався відносний ризик 1,6 (95% ІН 1,7–5,2). У жінок, які, за їхніми словами, мали тільки одного сексуального партнера, не виявлено підвищеного ризику первинної трубної безплідності, пов''язаної з використанням ВМЗ. Відкоригований показник ризику вторинної трубної безплідності, пов''язаної з користуванням мідними ВМЗ після народження першої живої дитини, не був статистично значущим [130].
13. Протипоказання щодо використання ВМЗ
Абсолютні протипоказання щодо введення ВМЗ такі: 1) вагітність або підозра на вагітність; 2) гостре ЗТО; 3) післяпологовий ендометрит або інфікований аборт у межах трьох останніх місяців; 4) діагностовані чи підозрювані злоякісні пухлини матки або шийки матки; 5) генітальні кровотечі нез''ясованого походження; 6) гострий цервіцит, який не лікували; 7) наявність у матці невидаленого ВМЗ, введеного раніше. Є небагато даних на підтримку твердження, що протипоказаннями є також хвороба Вілсона (алергія на мідь) і генітальний актиномікоз.
До відносних протипоказань належать: 1) деформація порожнини матки; 2) ЗТО, перенесене в минулому; 3) вагініт, що не лікувався; 4) наявність у пацієнтки (або її партнера) кількох сексуальних партнерів; 5) стани, пов''язані з підвищеною сприйнятливістю до інфекцій; 6) ендокардит, ревмокардит або штучний клапан серця. Жінки, які страждають на цукровий діабет першого чи другого типу, можуть користуватися ВМЗ.
Приймаючи рішення стосовно доцільності використання ВМЗ у випадках, коли йдеться про жінку, яка не народжувала (особливо якщо вона або її партнер має сексуальні стосунки з кількома особами), потрібно взяти до уваги підвищений ризик погіршення її фертильності в майбутньому через ЗТО, яке розвивається у перший місяць після введення ВМЗ, а також можливість позаматкової вагітності в разі, якщо контрацепція виявиться неуспішною. Пероральні контрацептиви, діафрагми й презервативи знижують ризик розвитку сальпінгіту в жінок, інфікованих гонореєю, тому вони мають розглядатись як варіанти першого вибору, коли добирається метод контрацепції для жінок, які ніколи не народжували, або для тих, котрі наражаються на високий ризик зараження хворобами, що передаються статевим шляхом. Приховані, безсимптомні ЗТО, що пов''язані з безпліддям у майбутньому і з підвищеним ризиком позаматкової вагітності, часто не виявляються або не лікуються [131, 132].
14. Загальна безпечність
Користування ВМЗ не корелює з підвищеною частотою випадків раку ендометрію або шийки матки. Цей метод контрацепції особливо підхожий для жінок, які вже завершили формування своєї родини, однак не бажають вдаватися до постійної стерилізації. Проведений аналіз показав, що після п''яти років використання ВМЗ стає економічно найвигіднішим методом контрацепції (рис. 1) [6]. За даними опитувань, жінки повідомляють про високий рівень задоволеності ВМЗ [36].
Ж. Стерилізація
У 1995 році в США стерилізація когось із подружжя була найпоширенішим — після пероральних контрацептивів — методом запобігання вагітності. Особливою популярністю цей метод користувався в таких випадках: 1) вік жінки понад 30 років; 2) подружжя перебувають у шлюбі понад 10 років; 3) подружжя більше не бажають мати дітей. Стерилізацію треба розглядати як постійну, хоча як після перев''язки труб, так і після вазектомії можливий реанастомоз.
Добровільну стерилізацію узаконено в усіх 50 штатах США. Рішення має прийматися тільки самими пацієнтами після консультації з лікарем. Якщо жінка, котра бажає пройти цю процедуру, молодша від 25 років, варто проконсультуватися більше ніж в одного фахівця. Для такого обачливого підходу є певні підстави: молодші кандидатки більш схильні змінювати свої наміри, їхні установки менш постійні; у них попереду більший відрізок репродуктивного віку, упродовж якого можливі розлучення, повторний шлюб або смерть когось із дітей. У Сполучених Штатах приблизно 7000 жінок щороку звертаються до медичних установ, бажаючи відновити репродуктивну здатність. Однак в остаточному підсумку повернути фертильність щастить лише приблизно двом з 1000 стерилізованих жінок [133].
1. Техніки стерилізації жінок
Лапароскопічна стерилізація може виконуватись із застосуванням моно- й біполярного електрохірургічного втручання, ультразвукової деструкції або за допомогою механічних засобів (затискачів, силіконових кілець, накладання швів). Ця процедура пов''язана з мінімальним дискомфортом, і загалом жінка повертається до повноцінної активності вже через один-два дні. Найпоширеніша в усьому світі техніка стерилізації жінок — перев''язка маткових труб шляхом мікролапаротомії (хоча в США цей метод застосовують переважно в післяпологовому періоді). Під час виконання малого (3–5 см) розтину можна використовувати місцеву анестезію. Найширше застосовують простий метод накладання лігатури типу Помероя.
Для молодших пацієнток бажано використовувати найефективніший і найменш деструктивний метод оклюзії труб, оскільки це дає змогу зменшити ймовірність дисфункції яєчників і формування спайок. Для жінок, молодших від 25 років, слід застосовувати ефективні техніки лапароскопічного перев''язування або модифіковану техніку Помероя (її називають також частковою сальпінгектомією). У разі проведення реанастомозу після цих процедур частота настання вагітності становить приблизно 75 %.
2. Ефективність
Як уже згадувалося, найефективнішим методом запобігання вагітності вважалася, за попередніми даними, стерилізація жінок шляхом хірургічного видалення частини фаллопієвої труби або механічного закупорювання частини її просвіту за допомогою затискачів, перев''язки чи електрокоагуляції [134]. Однак результати тривалого дослідження свідчать про те, що вагітність може наставати через багато років після стерилізації: частота невдач у розрахунку на 100 жінок зростає від 0,55 у перший рік до 1,31 через 5 років і 1,85 через 10 років [135]. Серед жінок віком 18–27 років 2,8 % вагітніють через 5–10 років після біполярної коагуляції фаллопієвих труб. Існує кілька оборотних методів контрацепції з приблизно таким самим відсотком невдач, як і в разі трубної стерилізації: наприклад, кумулятивний показник невдач за п''ять років користування норплантом становить 1,1 %, а в разі застосування ВМЗ Сu-Т-380 — 1,2 % порівняно з 1,3 % при стерилізації жінки.
До того ж серед жінок, які вагітніють після стерилізації, приблизно в одній третині випадків спостерігається позаматкова вагітність порівняно із однією чвертю серед жінок, які користуються норплантом, і п''ятьма відсотками серед тих, що користуються Сu-Т-380. З огляду на те, що Сu-Т-380 ефективно діє протягом 10 років, імовірність невдалого результату під час його використання приблизно така сама, як при жіночій стерилізації, і до того ж цей ВМЗ дає нижчу частоту виникнення позаматкової вагітності й коштує дешевше, його можна розглядати як альтернативу трубній стерилізації.
1. Piccinio L.J., Mosher W.D. Trends in contraception use in the United States 1982–1995 // Font. Plann. Perspec. — 1998. — 30(1). — 4-10.
2. Trussell J., Hatcher R.A., Cates W. et al. American Health Consultants, Contraceptive technology update. — 1995. — 17(2). — 13.
3. Sivin I. Contraception with Norplant® implants // Hum. Reprod. — 1994. — 9. — 1818-1826.
4. World Health Organization. The TCU220, multiload 250 and Nova T IUDs at 3, 5 and 7 years of use. Results from three randomized multicentre trials // Contraception. — 1990. — 42. — 141-158.
5. Peterson H.B., Xia Z., Hughes J.M. et al. The risk of pregnancy after tubal sterilization: Findings from the U. S. Collaborative Review of Sterilization // Am. J. Obstet. Gynecol. — 1996. — 174. — 1161-1168.
6. Trussell J., Leveque J. A., Koenig J.D. Am. J. Public Health. — 1995. — 85(49). — 494.
7. Bracken M.B., Vita K. Frequency of non-hormonal contraception around conception and association with congenital malformations in offspring // Am. J. Epidemiol. — 1983. — 117. — 281.
8. Louik C., Mitchell A.A., Werler M.M. et al. Maternal exposure to spermicides in relation to certain birth defects // N. Engl. J. Med. — 1987. — 317. — 474.
9. Strobino B., Kline J., Lai A. et al. Vaginal spermicides and spontaneous abortion of known karyotype // Am. J. Epidemiol. — 1986. — 123. — 432.
10. Fihn S.D., Latham R.H., Roberts P. et al. Association between diaphragm use and urinary tract infection // JAMA, J. Am. Med. Assoc. — 1986. — 254. — 240.
11. Klitsch M. FDA approval ends cervical cap''s marathon // Fam. Plann. Perspect. — 1988. — 20. — 137.
12. Barlow D. The condom and gonorrhoea // Lancet. — 1977. — 2. — 811.
13. Kelaghan J., Rubin G.L., Ory H.W., Layde P.M. Barrier-method contraceptives and pelvic inflammatory disease // JAMA, J. Am. Med. Assoc. — 1982. — 248. — 184.
14. Conant M., Hardy D., Sernatinger J. et al. Condoms prevent transmission of AlDS-associated retrovirus // JAMA, J. Am. Med. Assoc. — 1986. — 255. — 1706.
15. Fischl M., Dickinson G.M., Scott G.B. et al. Evaluation of heterosexual partners, children and household contacts of adults with AIDs // JAMA, J. Am. Med. Assoc. — 1987. — 257. — 640.
16. Richardson A.C., Lyon J.B. The effect of condom use on squamous cell cervical intraepithelial neoplasia // Am. J. Obstet. Gynecol. — 1981. — 140. — 909.
17. Harris R.W.C., Brinton L.A., Cowdell R.H. et al. Characteristics of women with dysplasia or carcinoma in situ of the cervix uteri // Br. J. Cancer. — 1980. — 42. — 359.
18. Vessey M., Lawless M., Yeates D. Efficacy of different contraceptive methods // Lancet. — 1982. — 1. — 841.
19. John A.P.K. Contraception in a practice community // J. R. Coll. Gen. Practitioners. — 1973. — 23. — 665.
20. Trussell J., Sturgen K., Striсker J., Dominik R. Comparative contraceptive efficacy of the female condom and other barrier methods // Fam. Plann. Perspect. — 1994. — 26. — 66-72.
21. Marshall J. A field trial of the basal body temperature method of regulation births // Lancet. — 1968. — 2. — 8-10.
22. World Health Organization. Task force on methods for the determination of the fertile period. Special programme of research, development and research training in human reproduction. A prospective multi-center trial of the ovulation method of natural family planning. 2. Effectiveness phase // Fertil. Steril. — 1981. — 36. — 591-598.
23. Perez A., Zabala A., Larrain et al. The clinical efficiency of the ovulation method (Billings) // Rev. Chil. Obstet. Ginecol. — 1983. — 48(2). — 97.
24. Rice F.J., Lanctot C.A., Garcia-Devesa C. Effectiveness of the sympto-thermal method of natural family planning: An International Study // Int. J. Fertil. — 1981. — 26. — 222-230.
25. Wade M.E., McCarthy P., Abernathy J.R. et al. A randomized prospective study of the use effectiveness of two methods of natural family planning: An Interim Report // Am. J. Obstet. Gynecol. — 1979. — 134. — 628-631.
26. Marshall J. A prospective trial of the mucothermic method of natural family planning // Int. Rev. Nat. Fam. Plann. — 1985. — 9. — 139-143.
27. Ferin J. Orally active progestational compounds. Human studies: Effects on the utero-vaginal tract // International Encyclopedia of Pharmacology and Therapeutics. — Pergamon, Oxford. — 1972. — Vol. 2.
28. Dorlinger L. Relative potency of progestins used in oral contraceptives // Contraception. — 1985. — 31. — 557.
29. Goldqieher J.W., Tazewell S., de la Pean D. et al. Plasma levels and pharmacokinetics of ethinyl estrogens in various populations // Contraception. — 1980. — 21. — 17.
30. Scott J.A., Kletzky O.A., Brenner P.F. et al. Comparison of the effects of contraceptive steroid formulations containing two doses of estrogen on pituitary function // Fertil. Steril. — 1978. — 30. — 141.
31. Mishell D.R. Jr, Kletzky O.A., Brenner P.F. et al. The effect of contraceptive steroids on hypothalamic-pituitary function. — 1978. — 130. — 817.
32. Mishell D.R. Jr, Thorneycroft I.H., Nakamura R.M. et al. Serum estradiol in women ingesting combination oral contraceptive steroids // Am. J. Obstet. Gynecol. — 1972. — 114. — 923.
33. Trussell J., Hatcher R.A., Cates W., Stewart F.H., Kost K. Contraceptive failure in the United States: An update // Stud. Fam. Plann. — 1990. — 21(1). — 51-54.
34. Sheth A., Jain U., Sharma S. et al. A randomized double-blind study of two combined and two progestogen-only oral contraceptives // Contraception. — 1982. — 25(3). — 243-252.
35. Shaaban M.M. Contraception with progestogens and progesterone during lactation // J. Steroid Biochem. Моl. Biol. — 1991. — 40(4–6). — 705-710.
36. Mishell D.R. Family planning. Comprehensive Gynecology / Mishell, Herbst, Stenchever, Droegemueller, eds., 3rd ed. Mosby, St. Louis, MO. — 1997.
37. Gal I., Parkinson C., Craft I. Effect of oral contraceptives on human plasma vitamin A levels // Br. Med. J. — 1971. — 2. — 436.
38. Drife J. Complications of combined oral contraception // Contraception Science and Practice / M. Filshie and J. Guillebaud eds. — Butterworth, London. — 1989.
39. Layde P.M., Vessey M.P., Yeates D. Risk factors for gall-bladder disease: A Cohort Study of Young Women Attending Family Planning Clinics // J. Epidemiol. Commun. Health. — 1982. — 36. — 274.
40. Boston Collaborative Drug Surveillance Project. Oral contraceptives and venous thromboembolic disease, surgically confirmed gallbladder disease and breast tumours // Lancet. — 1973. — 1. — 1399.
41. Kols A., Rinehart W., Piotrow P. et al. Oral contraceptives in the 1980s // Popul. Rep. — 1982. — 10. — A191-A222.
42. Van der Vange N., Blankenstein M.A., Kloosterboer H.J. et al. Effects of seven low-dose combined oral contraceptives on sex hormone binding globulin, corticosteroid binding globulin, total and free testosterone // Contraception. — 1990. — 41. — 345.
43. Meade T.W. Oral contraceptives, clotting factors, and thrombosis // Am. J. Obstet. Gynecol. — 1982. — 142. — 758.
44. Wilson E.S., Cruickshank J., McMaster M. el al. A prospective controlled study of the effect on blood pressure of contraceptive preparations containing different types of dosages and progestogen // Br. J. Obstet. Gynaecol. — 1984. — 91. — 1254.
45. Khaw K.-T., Peart W.S. Blood pressure and contraceptive use // Br. Med. J. — 1982. — 285. — 403.
45a. Mann J.I. Am. J. Obstet. Gynecol. — 1982. — 142. — 752.
46. Harlap S., Kost K., Forrest J.D. Preventing Pregnancy, Protecting Health: A New Look at Birth Control Choices in the United States // The Allan Guttmacher Institute, New York and Washington, DC. — 1991.
47. Farmer R.D.T., Preston J.T. The risk of venous thrombosis associated with low oestrogen oral contraceptives // J. Obstet. Gynecol. — 1995. — 15. — 195.
48. Vandenbroucke J.P., Koster T., Briet E. et al. Increased risk of venous thrombosis in oral-contraceptive users who are carriers of Factor V Leiden mutation // Lancet. — 1994. — 344. — 1453.
49. Wynn V., Goldsland I.F. Effects of oral contraceptives on carbohydrate metabolism // J. Reprod. Med. — 1986. — 31(Suppl. 9). — 892-897.
50. Shoupe D., Bopp B. Contraceptive options for the gestational diabetic woman // Int. J. Fertil. — 1991. — Suppl. 2. — 80-86.
51. Rimm E.B., Manson J.E., Stampfer M.J. et al. Oral contraceptive use and the risk of type 2 (non-insulin-dependent) diabetes mellitus in a large prospective study of women // Diabetologia. — 1992. — 35. — 967-972.
52. Petersen, Skouby S.O., Pedersen R.G. Desogestrel and gestodene in oral contraceptives: 12 months'' assessment of carbohydrate and lipoprotein metabolism // Obstet. Gynecol. — 1991. — 78. — 666.
53. Speroff L., DeCherney A., the Advisory Board for the New Progestins. Evaluation of a new generation of oral contraceptives // Obstet. Gynecol. — 1993. — 81. — 1034.
53a. Goldsland I.F., Crook D., Simpson R. et al. // N. Engl. J. Med. — 1990. — 323. — 1375.
54. Layde P.M., Ory H.W., Schlesselman J.J. The risk of myocardial infarction in former users of oral contraceptives // Fam. Plann. Perspect. — 1982. — 14. — 78.
55. Stampfer M.J., Willett W.C., Colditz G.A. et al. A prospective study of past use of oral contraceptive agents and risk of cardiovascular diseases // N. Engl. J. Med. — 1988. — 319. — 1313.
56. Adams M.R., Clarkson T.B., Kortinik D.R. et al. Contraceptive steroids and coronary artery atherosclerosis in cynomologus macaques // Fertil. Steril. — 1987. — 47. — 1010.
57. Engel H.-J., Engel E., Lichtlen P.R. Coronary atherosclerosis and myocardial infarction in young women — role of oral contraceptives // Eur. Heart J. — 1983. — 4. — 1.
58. Thomas D.B. Oral contraceptives and breast cancer. Review of the epidemiologic literature // Contraception. — 1991. — 43. — 597-642.
59. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormonal contraceptives: Collaborative reanalyzes of individual data on 53,297 women with breast cancer and 100,239 women without breast cancer from 54 epidemiological studies // Lancet. — 1996. — 347. — 1713-1727.
60. Schlesselman J.J. Net effect of oral contraceptive use on the risk of cancer in women in the United States // Obstet. Gynecol. — 1995. — 85. — 793-801.
61. Kjaer S.K., Engholm G., Dahl C. et al. Case-control study of risk factors for cervical squamous-cell neoplasia in Denmark. III. Role of oral contraceptive use // Cancer Causes Control. — 1993. — 4. — 513-519.
62. Ursin G., Peters R.K., Henderson В.E. et al. Oral contraceptive use and adenocarcinoma of cervix // Lancet. — 1994. — 334. — 1390.
63. Coker A.L., McCann M.F., Hulka B.S., Walter L.A. Oral contraceptive use and cervical intraepithelial neoplasia // J. Clin. Epidemiol. — 1992. — 45. — 1111.
64. Daling J.R., Madeleine M.M., McKnight B., Carter J.J., Wipf G.C, Ashley R., Schwartz et al. The relationship of Human papillomavirus-related cervical tumors to cigarette smoking, oral contraceptive use, and prior herpes simples virus type 2 infection // Cancer Epidem., Biomarkers Prev. — 1996. — 5. — 541-548.
65. Centers of Disease Control. Combination oral contraceptives use and risk of endometrial cancer // JAMA, J. Am. Med. Assoc. — 1987. — 257. — 976.
66. Voigt L.F., Deng O., Weiss N.S. Recency, duration, and progestin content of oral contraceptives in relation to the incidence of endometrial cancer // Cancer Causes Control. — 1994. — 5. — 227—233.
67. Hankinson S.E., Colditz G.A., Hunter D.J. et al. A quantitative assessment of oral contraceptive use and risk of ovarian cancer // Obstet. Gynecol. — 1992. — 80. — 708.
68. Rosenberg L., Palmer J.R., Lesko S.M. et al. Oral contraceptive use and the risk of myocardial infarction // Am. J. Epidemiol. — 1990. — 131. — 1009.
69. Forman D., Vincent T.J., Doll R. Cancer of the liver and the use of oral contraceptives // Br. Med. J. — 1986. — 292. — 1357.
70. World Health Organization. Combined oral contraceptives and liver cancer // Int. J. Cancer. — 1989. — 43. — 254.
71. Pituitary Adenoma Study Group. Pituitary adenomas and oral contraceptives: A multicenter case-control study // Fertil. Steril. — 1983. — 39. — 753.
72. Hannaford P.C., Villard-Mackintosh L., Vessey M.P., Kay C.R. Oral contraceptives and malignant melanoma // Br. J. Cancer. — 1991. — 63. — 430.
73. Vessey M.P., Wright N.H., McPherson K. et al. Fertility after stopping different methods of contraception // Br. Med. J. — 1978. — 1. — 265.
74. Bracken M.B., Hellenbrand K.G., Holford T.R. // Fertil. Steril. — 1990. — 53. — 21.
75. Ory H.W., Forrest J.D., Lincoln R. Making Choices: Evaluating the Health Risks and Benefits of Birth Control Methods // The Allan Guttmacher Institute, New York. — 1983.
76. Robinson J.C., Plichta B.A., Weismann C.S., Nathanson C.A., Ensminger M. Dysmenorrhea and use of oral contraceptives in adolescent women attending a family planning clinic // Am. J. Obstet. Gynecol. — 1992. — 166(2). — 578-583.
77. Hatcher R.A., Trussell J., Stewart F.H. et al. Menstrual problems and common gynecologic concerns // Contraceptive Technology 16th rev. — Irvington Publishers, New York. — 1994.
78. Lanes A.F., Birmann B., Walter A.M., Singer S. Oral contraceptive type and functional ovarian cysts // Am. J. Obstet. Gynecol. — 1992. — 166. — 956.
79. Hazes J.M.W., Dijkmans В.A.C., Vanderbroucke J.P. et al. Reduction of the risk of rheumatoid arthritis among women who take oral contraceptives // Arthritis Rheum. — 1990. — 33. — 173.
80. Del Junco D.J., Annegers J.F., Luthra H.S. et al. Do oral contraceptives prevent rheumatoid arthritis? // JAMA, J. Am. Med. Assoc. — 1985. — 254. — 1938-1941.
81. Gambacciani M., Spinetti A., Toponeco F. et al. Longitudinal evaluation of perimenopausal vertebral bone loss: Effects of a low-dose oral contraceptive preparation on bone mineral density and metabolism // Obstet. Gynecol. — 1993. — 83. — 392-396.
82. Ross R.K., Pike M.C., Vessey M.P. et al. Risk factors for uterine fibroids: Reduced risk associated with oral contraceptives // Br. Med. J. — 1986. — 293. — 359-362.
83. Guillebaud J. The Pill and Other Hormones for Contraception. — Oxford University Press, Oxford. — 1991.
84. Mishell D.R., Kharma K.M., Thorneycroft I.H., Nakamura R.M. Estrogenic activity in women receiving an injectable progestogen for contraception // Am. J. Obstet. Gynecol. —1972. — 113. — 372.
85. Schwallie P.C., Assenzo J.R. Contraceptive use — efficacy study utilizing medroxyprogesterone acetate administered as an intramuscular injection once every 90 days // Contraception. — 1974. — 10(2). — 181.
86. Schwallie P.C., Assenzo J.R. The effect of depot-medroxyprogesterone acetate on pituitary and ovarian function, and the return of fertility following its discontinuation: A review // Fertil. Steril. — 1973. — 24. — 331.
87. Moore L.L., Valuck R., McDougall C. et al. A comparative study of one-year weight gain among users of medroxyprogesterone acetate, levonorgestrel implants, and oral contraceptives // Contraception. — 1995. — 52. — 215-220.
88. World Health Organization Expanded Programme of Research, Development and Research Training in Human Reproduction Task Force on Long-Acting System Agents for the Regulation of Fertility. Multinational comparative clinical evaluation of two long-acting injectable contraceptive steroids, norethisterone enanthate and medroxyprogesterone acetate. Final report // Contraception. — 1983. — 18. — 1.
89. Cundy T., Cornish J., Evans M.C. et al. Recovery of bone density in women who stop using medroxyprogesterone acetate // Br. Med. J. — 1994. — 308. — 247-248.
90. Skegg D.C., Noonan E.A., Paul C. et al. Depot medroxyprogesterone acetate and breast cancer: A pooled analysis of the World Health Organization and New Zealand studies // JAMA, J. Am. Med. Assoc. — 1995. — 273. — 799-804.
91. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. Breast cancer and depot-medroxyprogesterone acetate: A Multinational Study // Lancet. — 1991. — 338. — 833-838.
92. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. DMPA and risk of endometrial cancer // Int. J. Cancer. — 1991. — 49. — 186-190.
93. WHO Collaborative Study of Neoplasia and Steroid Contraceptives. DMPA and risk of epithelial ovarian cancer // Int. J. Cancer. — 1991. — 49. — 191-195.
94. Thomas D.B., Ray R.M. Depot-medroxyprogesterone acetate (DMPA) and risk of invasive adenocarcinomas and adenosquamous carcinomas of the uterine cervix // Contraception. — 1995. — 52. — 307-312.
95. New Zealand Contraception and Health Study Group. Risk of cervical dysplasia in users of oral contraceptives, intrauterine devices or depot medroxyprogesterone acetate // Contraception. — 1994. — 50. — 431.
96. New Zealand Contraception and Health Study Group. History of long-term use of depot-medroxyprogesterone acetate in patients with cervical dysplasia: Case-control Analysis Nested in a Cohort Study // Contraception. — 1994. — 50. — 443-449.
97. World Health Organization. Task Force of long-acting systemic agents for fertility regulation. Special Programmer of Research, Development and Research Training in Human Reproduction; a multicentre Phase III comparative study of two-hormonal contraceptive preparations given once-a-month by intramuscular injection: II. The comparison of bleeding patterns // Contraception. — 1989. — 40. — 531.
98. Moore D.E., Roy S., Stanczyk F.Z. el al. Bleeding and serum d-norgestrel, estradiol, and progesterone patterns in women using d-norgestrel subdermal polysiloxane capsules for contraception // Contraception. — 1978. — 17. — 315.
99. Shoupe D., Horenstein J., Mishell D.R. Jr et al. Characteristics of ovarian follicular development in Norplant users // Fertil. Steril. — 1991. — 55. — 766-770.
100. Brache V., Faundes A., Johansson E. et al. Anovulation, inadequate luteal phase and poor sperm penetration in cervical mucus during prolonged use of Norplant implants // Contraception. — 1985. — 31. — 261.
101. Sivin I. International experience with Norplant and Norplant II // Contraception. — 1988. — 19(2). — 81-94.
102. Brache V., Alvarez-Sanchez Faundes A. et al. Ovarian endocrine function through five years of continuous treatment with Norplant subdermal contraceptive implants // Contraception. — 1990. — 41. — 169.
103. Shoupe D., Mishell D.R., Bopp B.I., Fielding M. The significance of bleeding patterns in Norplant implant users // Obstet. Gynecol. — 1991. — 77. — 256.
104. Population Counsil. Norplant Levonorgestrel Implants: A summary of Scientific Data, Monograph. — Population Council, New York, 1990.
105. Davies G.C, Li X.F, Newton J.R. Release characteristics, ovarian activity and menstrual bleeding pattern with a single contraceptive implant releasing 3-keodesogestrel // Contraception. — 1993. — 47(3). — 251-261.
106. Van Look Paul F.A., Stewart F. Emergency contraception // Contraceptive Technology / R.A. Hatcher, J. Trussell, F.H. Stewart et al, eds. — Ardent Media, New York. — 1998.
107. Fasoli M., Parazzini F., Cecchetti G. et al. // Contraception. — 1989. — 39. — 459.
108. Glasier A., Thong K.J., Dewar M., Mackie M., Baird D.T. Mifepristone compared with high-dose estrogen and progestogen for emergency postcoital contraception // N. Engl. J. Med. — 1992. — 327. — 1041-1044.
109. Hatcher R.A., Trussell J., Stewart F. et al. Contraceptive Technology, 16th rev. edn. — Irvington Publishers, New York. — 1994. — P. 347-377.
110. Moyer D.L., Mishell D.R. Jr. Reactions of human endometrium to the intrauterine foreign day. II. Long term effects on the endometrial histology and cytology // Am. J. Obstet. Gynecol. — 1971. — 111. — 66.
111. Tredway D.R., Umezaki C.U., Mishell D.R. Jr. Effect of intrauterine devices on sperm transport in the human being // Am. J. Obstet. Gynecol. — 1975. — 123. — 734.
112. Vessey M.P., Lawless M., McPherson K. et al. Fertility after stopping use of intrauterine contraceptive device // Br. Med. J. — 1983. — 286. — 106.
113. Rosenberg M.J., Foldesy R., Mishell D.R. Jr. et al. Contraception. — 1996. — 53. — 197.
114. Rybo G. The IUD and endometrial bleeding // J. Reprod. Med. — 1977. — 20. — 715.
115. Milsom I., Andersson K., Jonasson K. et al. The influence of the Gyne-T 380S IUD on menstrual blood loss and iron status // Contraception. — 1995. — 52. — 175-179.
116. Anderson A.B.M., Haynes P.J., Guillebaud J. et al. Reduction of menstrual blood loss by prostaglandin synthetase inhibitor // Lancet. — 1976. — 1. — 774.
117. Sivin I., Stem J. Long-acting more effective copper T lUDs: A summary of U.S. experience, 1970–75 // Stud. Fam. Plann. — 1979. — 10. — 276-281.
118. Tatum H.J., Schmidt F.H., Jain A.K. Management and outcome of pregnancies associated with the copper T intrauterine contraceptive device // Am. J. Obstet. Gynecol. — 1976. — 126. — 869.
119. Shalev E., Edelstein S., Engelhard J. et al. Ultrasonically controlled retrieval of an intrauterine contraceptive device in early pregnancy // J. Clin. Ultrasound. — 1987. — 15. — 525.
120. Tatum H.J., Schmidt F.J., Phillips D.M. et al. The Dalkon shield controversy, structural and bacteriologic studies of IUD tails // JAMA, J. Am. Med. Assoc. — 1975. — 4. — 253.
121. Sivin I. Dose- and age-dependent ectopic pregnancy risks with intrauterine contraception // Obstet. Gynecol. — 1991. — 78. — 291-298.
122. Ory H.W., and the Women''s Health Study. Ectopic pregnancy and intrauterine contraceptive devices: new perspectives // Obstet. Gynecol. — 1981. — 57. — 137-144.
123. Rossing M.A., Daling J.R., Weiss N.S. Past use of an intrauterine device and risk of tubal pregnancy // Epidemiology. — 1993. — 4. — 245-251.
124. Rossing M.A., Daling J.R., Voigt L.F. Current use of an intrauterine device and risk of tubal pregnancy // Epidemiology. — 1993. — 4. — 252-258.
125. Vessey M.P., Johnson B., Doll R. et al. Outcome of pregnancy in women using an intrauterine device // Lancet. — 1984. — 1. — 495.
126. Mishell D.R. Jr, Bell J.H., Good R.G. et al. The intrauterine device: A bacteriologic study of the endometrial cavity // Am. J. Obstet. Gynecol. — 1996. — 96. — 119.
127. Lee, N.C., Rubin G.I. The intrauterine device and pelvic inflammatory disease revisited: New results from the women''s health study // Obstet. Gynecol. — 1988. — 71. — 1.
128. Toivonen J., Luukkainen T., Alloven H. Protective effect of intrauterine release of levonorgestrel on pelvic infection: Three years — comparative experience of levonorgestrel and copper-releasing intrauterine devi-
ces // Obstet. Gynecol. — 1991. — 77. — 261.
129. Daling J.R., Weiss N.S., Voigt L.E., McKnight B., Moore D.E. The intrauterine device and primary tubal infertility // N. Engl. J. Med. — 1992. — 326. — 203-204.
130. Cramer D.W., Schiff I., Schoenbaum S.C. et al. Tubal infertility and the intrauterine device // N. Engl. J. Med. — 1985. — 312. — 914-917.
131. Cates W., Wasserheit J.N., Marchbanks P.A. Pelvic inflammatory disease and tubal infertility: The preventable conditions // Ann. N. Y. Acad. Sci. — 1994. — 709. — 179-195.
132. Cates W., Joesoef M.R., Goldman M.B. A typical pelvic inflammatory disease: Can we identify clinical predictors? // Am. J. Obstet. Gynecol. — 1993. — 169. — 341-346.
133. Wilcox L.S., Chu S.Y., Peterson H.B. Characteristics of women who considered or obtained tubal reanastomosis: Results from a prospective study of tubal sterilization // Obstet. Gynecol. — 1990. — 75. — 661.
134. Trussell J., Hatcher R.A., Cates W.J.R., Stewart F.H., Kost K. Contraceptive failure in the United States: An update // Study Fam. Plann. — 1990. — 1. — 51.
135. Peterson H.B., Xia Z., Hughes J.M. et al. The risk of pregnancy after tubal sterilization: Findings from the U. S. collaborative review of sterilization // Am. J. Obstet. Gynecol. — 1996. — 174. — 1161-1170.