Газета «Новости медицины и фармации» Неврология (316) 2010 (тематический номер)
Вернуться к номеру
Элементный состав нейропротекторов природного происхождения
Авторы: Р.Т. Тогузов, А.Ю. Волков, А.А. Никонов, ГОУ ВПО «Российский государственный медицинский университет» им. Н.И. Пирогова (кафедра клинической лабораторной диагностики, зав. кафедрой д.м.н., профессор Р.Т. Тогузов)
; И.Ю. Торшин, О.А. Громова, Российский сотрудничающий центр «Нейробиология» Института микроэлементов, ЮНЕСКО, г. Москва
Версия для печати
Нейротрофическая терапия — одно из перспективных направлений в современной неврологии. В отличие от классической нейропротекции (защищающей нейроны от апоптоза и некроза) нейротрофическая терапия способствует восстановлению нейронной ткани через активацию процессов спраутинга и регенерации аксонов. В неврологической практике наряду с синтезированными нейропротекторами применяются лекарства-нейротрофики, полученные из природного сырья животного или растительного происхождения: Церебролизин (комплекс аминокислот и низкомолекулярных пептидов, полученных из мозга свиньи), билобил (стандартизированный экстракт растения гинкго билоба), актовегин (дериват крови бычков), церебролизат (комплекс аминокислот и среднемолекулярных пептидов, полученных из мозга коров).
Как показали многочисленные клинические исследования, наиболее перспективным направлением в нейротрофической фармакотерапии является использование препаратов, основанных на экстрактах головного мозга. Работы по доказательной и фундаментальной медицине, например касающиеся препарата Церебролизин, указывают на его несомненную эффективность при терапии инсульта, ЧМТ, деменций и перинатальных энцефалопатий [1]. В то же время попытки прямолинейного применения белковых факторов роста (прежде всего фактора роста нервов, ФРН) для терапии закончились полным провалом [2], основной причиной которого явилась, по всей видимости, фанатическая приверженность западных исследователей к биологическому редукционизму [3].
Что же является причиной эффективности экстрактов головного мозга животных?
Детальные исследования препарата Церебролизин, обладающего наиболее обширной базой доказательных и молекулярных исследований, позволяют ответить на этот вопрос [4]. В Церебролизине содержатся аминокислоты — природные нейротрофики и нейротрансмиттеры [5], пептиды-нейромиметики ФРН, энкефалины [6] и нейротрофические микроэлементы, прежде всего литий [7]. Синергическое воздействие этих компонентов и обеспечивает высокую эффективность препарата.
Представляют определенный интерес исследования и других препаратов этой группы. Очевидно, что такого рода исследования достаточно сложны и требуют значительных затрат. Например, исследования пептидного состава требуют хроматографического разделения с последующим секвенированием пептидов, что является крайне трудоемкой и дорогостоящей процедурой. В то же время сравнительные исследования элементного состава различных препаратов более доступны и позволяют провести оценку качества элементной очистки того или иного препарата и целесообразности проведения более трудоемких и дорогостоящих исследований [8]. В настоящей работе проведен сравнительный элементный анализ препаратов церегин и Церебролизин.
Материалы и методы
Элементный анализ 10 образцов препаратов Церебролизина (пр-во «EBEWE», Австрия, серия № 82286204) и церегина (пр-во «Белмедпрепараты», Беларусь, серия № 020509) проводился методом масс-спектрометрии [9, 10]. Для проведения анализа образцы, представляющие собой жидкую лекарственную форму, разбавляли бидистиллированной водой в соотношении 1 : 3. В качестве внутреннего стандарта в растворы вводили индий в концентрации 25 мкг/л. Калибровочные растворы были приготовлены из стандартных растворов фирмы «Merck» с известным содержанием в диапазоне 5–1000 мгк/л (10–7 %). Полученные растворы анализировались на масс-спектрометре с ионизацией в индуктивно-связанной плазме VG Plasma Quad PQ2 Turbo (Англия), рабочая мощность СВЧ-генератора 1,3 кВт, расход плазмообразующего газа (аргон) 14 л/мин, расход транспортирующего газа 0,89 мл/мин, для определения щелочных металлов расход 1,05 мл/мин. Проводилось 3 экспозиции каждого образца, время интегрирования сигнала 60 с. Результаты анализа «холостой пробы» автоматически вычитались в анализе. Единица измерения — мкг/кг (ppb).
Результаты и обсуждение
С использованием метода масс-спектрометрии был проанализирован элементный состав церегина и Церебролизина по более 100 химическим элементам. Результаты анализа приведены в табл. 1–3.
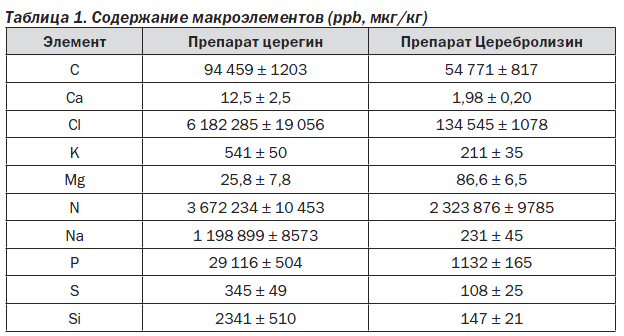
Анализ макроэлементного состава показал наличие в церегине значительных количеств натрия и хлора, что соответствует высокой концентрации NaCl в данном препарате. Концентрация хлорида натрия в исследованных образцах церегина составила по меньшей мере 1 г/л (
Анализ содержания токсических и условно-токсических микроэлементов показал значительные отличия между двумя препаратами (табл. 2).
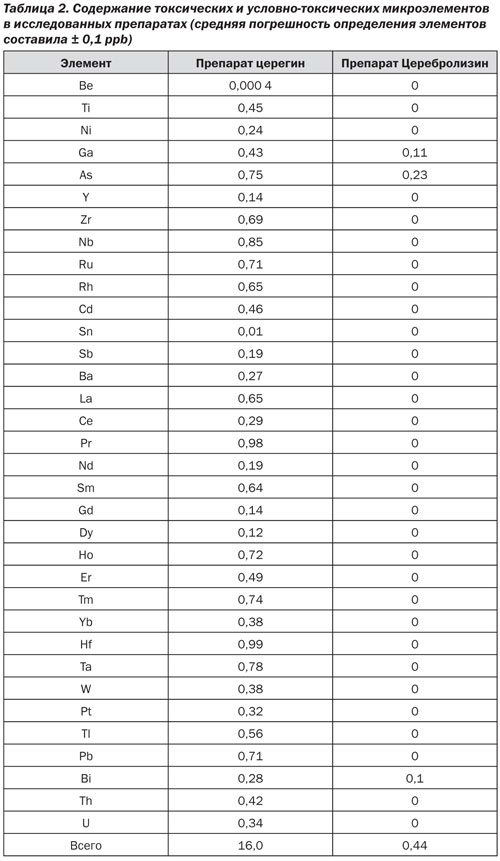
В церегине обнаружено присутствие следовых количеств более 30 токсических и условно-токсических микроэлементов, а в Церебролизине — присутствие следовых количеств всего лишь трех элементов. Наличие в составе препарата церегин следовых количеств тория и урана предположительно указывает на особенности экологии пастбищ и питьевой воды. Суммарно содержание условно-токсических элементов в церегине составило 16 ± 3,4 мкг/кг, а в Церебролизине — 0,44 ± 0,07 мкг/кг. Более чем 30-кратное отличие свидетельствует о высокой степени очистки препарата Церебролизин.
Не менее интересны результаты анализа эссенциальных микроэлементов (табл. 3). Прежде всего обращает на себя внимание присутствие значительных количеств брома в церегине (более 80 мг/кг). Наличие брома в совокупности со значительными количествами натрия и хлора позволяет предположить, что в церегин добавляется поваренная соль, не очищенная от бромидов (например, из Сакского, Сивашского месторождения и др).
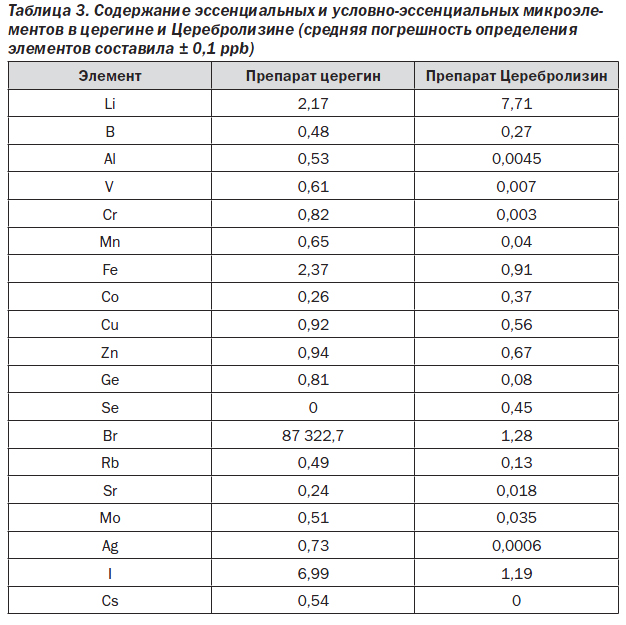
Следует также заметить, что содержание элементов лития, магния и селена (имеющих, как известно, нейроактивные функции [11]) выше в Церебролизине, чем в церегине, несмотря на более высокую степень очистки Церебролизина. В Церебролизине установлено более высокое содержание элементов лития (7,7 мкг/кг — Церебролизин, 2,2 мкг/кг — церегин), магния (86,6 мкг/кг — Церебролизин, 25,8 мкг/кг — церегин) и селена (0,45 мкг/кг — Церебролизин, 0,0 мкг/кг — церегин).
Вероятным объяснением различного содержания лития, магния и селена служат различия в питании животных. Для производства церегина используется мозговая ткань крупного рогатого скота, а именно взрослых коров. Для производства Церебролизина — мозг молодых свиней. Мозговая ткань является, как известно, лидером по способности накапливать микроэлементы, и активно развивающаяся ткань молодых животных, естественно, содержит большие количества нейроактивных микроэлементов [12, 13] и магния [14]. Данных о питании крупного рогатого скота, идущего на производство церегина, не имеется. В то же время рацион животных, используемых для производства Церебролизина, строго регламентирован и стандартизирован по белкам, жирам, углеводам и минеральным веществам.
Наличие в составе Церебролизина лития, магния и селена может иметь некоторое значение для терапевтической эффективности препарата. Экспериментальные исследования В.С. Райцеса [13], клинические работы M. Anthony [15], А. Таkeda [16] и других авторов показали, что без гарантированной нормализации баланса макро-, микроэлементов дополнительные курсы витаминов, вазоактивных препаратов, других лекарств могут быть недостаточными и даже вообще безуспешными, так как деформированный минеральный обмен не только вносит свой вклад в патогенез заболеваний нервной системы, но и изменяет фармакокинетический и фармакодинамический ответ на лекарственное воздействие.
Степень очистки и способ стабилизации препарата имеют огромное значение для сохранности препарата без потери эффективности. Церегин, благодаря стабилизации фенолом (3 мг/мл) и высокому содержанию поваренной соли, сохраняется в течение 3 лет. Однако именно фенолы и высокая концентрация соли препятствуют внутривенному введению препарата. Церебролизин производится на основе современных фармацевтических технологий (европейский стандарт GMP). Основой качества препарата является высокое качество исходного сырья, которое подвергается высокоточному протеолизу белковой фракции, очистке от солей, проводящимся в щадящих условиях. Как результат, препарат сохраняет фармакологическую эффективность в течение всего срока годности (5 лет).
Заключение
Церебролизин — единственный нейропротектор животного происхождения, разрешенный к применению от периода новорожденности до глубокой старости. Церебролизин является единственным нейропротектором животного происхождения, для которого разрешены и внутримышечный, и внутривенный пути введения. Как известно, к препаратам для в/в введения предъявляются особые требования по очистке от тяжелых металлов, содержанию таких консервантов, как хлорид натрия, антигенов животного происхождения, сульфитов, фенолов и других токсических органических веществ. Сравнительное исследование содержания более 100 химических элементов в двух препаратах, основанных на экстрактах головного мозга животных, показало высокую степень очистки Церебролизина от хлорида натрия и токсических микроэлементов. Более высокое содержание нейроактивных лития, селена и магния в церебролизиновом экстракте является косвенным свидетельством более высокой нейроактивности биоматериала, используемого для получения экстрактов Церебролизина.
1. Скворцова В.И., Стаховская Л.В., Шамалов Н.А., Кербиков О.Б. Результаты многоцентрового исследования безопасности и эффективности Церебролизина у больных с острым ишемическим инсультом // Инсульт: Приложение к журналу неврологии и психиатрии им С.С. Корсакова. — 2006. — 16. — С. 41-46.
2. Gladstone D.J., Black S.E., Hakim A.M. Heart and Stroke Foundation of Ontario Centre of Excellence in Stroke Recovery.Toward wisdom from failure: lessons from neuroprotective stroke trials and new therapeutic directions // Stroke. — 2002 Aug. — 33(8). — P. 2123-36.
3. Торшин И.Ю., Громова О.А. Нейротрофический эффект церебролизина против воинствующего редукционизма // Казанский неврологический журнал им. Бехтерева. — 2008. — № 8.
4. Громова О.А., Гупало Е.В., Торшин И.Ю. Церебролизин: анализ фундаментальных и клинических исследований, РСЦ ИМ ЮНЕСКО: Информационно-справочное издание. — М., 2008. — 124 с.
5. Торшин И.Ю., Громова О.А. Аминокислотный состав церебролизина // Трудный пациент. — 2010.
6. Торшин И.Ю., Громова О.А., Гусев Е.И., Юргель И.С., Никонов А.А., Третьяков В.Е., Лиманова О.А., Жевнеров А.В. Идентификация и анализ пептидов в составе церебролизина: пептиды фактора роста нервов // Трудный пациент. — 2010.
7. Гоголева И.В., Громова О.А., Уллубиев Н.М., Никонов А.А.. Нейробиология лития // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2008. — 108 (S22). — С. 49-55.
8. Громова О.А., Панасенко О.М. Структурный анализ и ферментативная антиокислительная активность нейрометаболических препаратов природного происхождения: церебролизина, церебролизата, билобила и актовегина. — Микроэлементы в медицине. — 2001. — Т. 2, № 1. — С. 23-27.
9. Зейлер Г. Некоторые проблемы анализа биологических материалов на содержание токсичных элементов в следах // Сб. научных трудов «Некоторые вопросы токсичности ионов металлов — М.: Мир, 1993. — 487 с.
10.Халезов А., Цалев Д. Атомно-эмиссионный анализ. — Л.: Медицина, 1983. — 200 с.
11. Громова О.А., Кудрин А.В. Нейрохимия микроэлементов. — М.: Алев, 2001. — 301 с.
12. Авцын А.П., Жаворонков А.А., Риш М.А., Строчкова Л.С. Микроэлементозы человека: этиология, классификация, органопатология. — М.: Медицина, 1991. — 496 с.
13. Райцес В.С. Нейрофизиологические основы действия микроэлементов. — Л.: Медицина, 1981. — 152 с.
14. Torshin I.Yu., Gromova O.A. Magnesium and pyridoxine: fundamental studies and clinical practice. — NY: Nova Science, 2009.
15. Anthony M. Nervous system // J. Metal. Toxicology. — 1995. — P. 199-235.
16. Takeda A., Ishiwatari S., Okada S. Manganese uptake into rat brain during development and aging // J. Neurosci. Res. — 1999. — 56. — 93-98.
