Газета «Новости медицины и фармации» Гастроэнтерология (313) 2010 (тематический номер)
Вернуться к номеру
Остеодефицит при хронических воспалительных заболеваниях кишечника
Авторы: Т.И. Бойко, Е.В. Сорочан. ГУ «Институт гастроэнтерологии АМН Украины», г. Днепропетровск
Версия для печати
Несмотря на то, что воспалительные заболевания кишечника (ВЗК) чаще встречаются у лиц молодого возраста (20–40 лет), при исследовании минеральной плотности костной ткани у этих пациентов часто выявляется остеопения (Т-индекс < 1 и > 2,5) — в 40–50 % случаев и остеопороз (Т-индекс < 2,5) — в 5–37 % случаев. Наблюдения показали, что при ВЗК в позвонках и лучевой кости ежегодно происходит снижение костной ткани до 2,5 %, причем выраженность остеодефицита коррелирует с активностью и длительностью основного заболевания.
Механизмы потери костной массы при патологии кишечника до настоящего времени изучены недостаточно. Известно, что одной из основных причин развития остеопении и остеопороза при заболеваниях желудочно-кишечного тракта является дефицит кальция (Са), концентрация которого зависит как от поступления с пищей, так и от эффективности абсорбции. Абсорбция Са осуществляется активно и пассивно в двенадцатиперстной и тощей кишках, а при их исключении из пассажа — в подвздошной. При этом хорошо абсорбируется Са в форме цитрата, лактата, карбоната, глюконата и хлорида, плохо — в форме фитата, фосфата и оксалата. Са абсорбируется в кишечнике за счет активного 1,25(ОН)2D-зависимого процесса и пассивных витамин D-независимых механизмов. В физиологических условиях уровень кишечной абсорбции Са не превышает 20–30 %, а витамин D увеличивает ее до 60–80 %.
Известно, что на фоне ВЗК нарушается всасывание Са, что приводит к гипокальциемии. Поддержание нормального уровня Са в крови является чрезвычайно важным для нормального функционирования организма, в связи с чем последний стремится сберечь гомеостаз по отношению к этому показателю. Гипокальциемия является сигналом для активации биосинтеза паращитовидными железами паратиреоидного гормона, под влиянием которого увеличивается реабсорбция Са в почечных канальцах и экскреция фосфатов, а также повышается уровнь Са в крови за счет активации костной резорбции. Происходит мобилизация Са, депонированного в костной ткани, за счет чего поддерживается гомеостаз его в крови. На фоне хронического снижения всасывания Са возникает вторичный гиперпаратиреоидизм, что способствует активации процессов костной резорбции.
Стресс, вызванный болезнью, и соблюдение строгой диеты с недостаточным содержанием Са из-за непереносимости больными молочных продуктов также являются факторами риска развития остеодефицита при ВЗК. Так, на фоне стресса, сопровождающегося выбросом катехоламинов, отмечается усиленный синтез кортикостероидов. Последние являются мощными стимуляторами костной резорбции. Через время после действия стрессорного агента костная ткань адаптируется к действию неблагоприятного фактора и переходит на так называемый медленный тип обмена. При этом наблюдается выраженное угнетение процессов костеобразования и низкая активность костной резорбции (неактивный остеопороз). Таким образом, изменения, возникшие в костной ткани под влиянием стрессорного фактора, которым в данном случае является болезнь, долго сохраняются, так как полная перестройка кости происходит на протяжении длительного времени.
На усвояемость и обмен кальция в организме большое влияние оказывают витамины А, Е, С, полиненасыщенные жирные кислоты. Остеопороз, независимо от этиологических факторов его развития, сопровождается интенсификацией свободнорадикального окисления липидов. Имеется связь между свободнорадикальным метаболизмом, продуктами окисления полиненасыщенных жирных кислот — простагландинами и гомеостазом кальция. Активные формы кислорода повышают резорбтивную активность остеокластов, продукцию ими гидролитических ферментов, повреждают соединительную ткань (органический матрикс) в составе хряща, кости. При усилении перекисного окисления липидов наблюдается дезорганизация транспортных механизмов переноса кальция, нарушение кальцификации матрикса, тормозится биосинтез белков, нуклеиновых кислот, повреждаются лизосомы с выходом гидролитических ферментов, происходит накопление молочной кислоты, оксикислот, кетокислот, развитие ацидоза, усиливающего деминерализацию кости.
Важная роль в развитии остеодефицита у пациентов с ВЗК отводится гипокинезии, которая приводит к остеоцитарному остеолизу.
Заслуживает внимания и то, что при ВЗК наблюдается снижение массы тела, что также отрицательно влияет на состояние минеральной плотности костной ткани. С одной стороны, жировая ткань является основным периферическим источником эстрогенов, принимающих участие в формировании костной ткани. С другой — при снижении массы тела снижается и нагрузка на кость, что приводит к повышению процессов резорбции в ней. Так, по данным многоцентрового европейского исследования, при повышении массы тела на 1 кг костная масса повышается на 0,5–0,6 %.
Доказано, что вторичная аменорея у молодых женщин на фоне ВЗК с высокой активностью приводит к значительному снижению минеральной плотности костной ткани. Недостаточно ясно, играет ли аналогичную роль снижение уровня тестостерона у молодых мужчин с неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК). Имеются сообщения о вторичном гипогонадизме с низким андрогенным индексом и нормальным уровнем гонадотропина, ассоциированным с увеличением костной резорбции у 6 % английской когорты пациентов с БК.
Особого внимания в последнее время заслуживае т изучение роли иммуновоспалительных нарушений, которые непосредственно связаны с патогенезом ВЗК. Доказано, что костное ремоделирование имеет много признаков воспалительного процесса, прослеживающихся как на клеточном уровне (взаимосвязь остеокластов с макрофагами и остеобластов с фибробластами), так и на уровне цитокинов. Предполагают, что в основе развития остеопороза при воспалительных процессах в организме лежит цитокинзависимая активация остеокластогенеза, что приводит к повышению резорбции костной ткани. При ВЗК нарушения в иммунной системе и остеопоротические изменения протекают параллельно и в их основе лежат сходные механизмы, связанные с дисбалансом между продукцией провоспалительных (проостеопоротических) и противовоспалительных (антиостеопоротических) цитокинов. Важную роль в данных процессах играет нарушение баланса в системе RANKL/RANK/OPG. Активация Т-лимфоцитов при ВЗК приводит к гиперэкспрессии RANKL в различных клетках, в том числе остеобластах, и снижению продукции остеокластами остеопротегерина (OPG). Как известно, RANKL относится к лигандам семейства фактора некроза опухоли a (ФНО-a) и является мощным медиатором костной резорбции. При взаимодействии с рецепторами RANK он стимулирует дифференцирование и активность остеокластов, а также индуцирует синтез провоспалительных цитокинов и пролиферацию Т-лимфоцитов. OPG (ложный растворимый рецептор RANKL), наоборот, блокирует остеокластогенез, конкурентно ингибирует связывание RANKL с RANK, действуя как физиологический регулятор процессов регенерации костной ткани. Таким образом, увеличение соотношения RANKL/OPG при ВЗК приводит к активации остеокластов и усилению костной резорбции, нейтрализация же RANKL остеопротегерином приводит к подавлению резорбции и увеличению массы костной ткани (рис. 1).
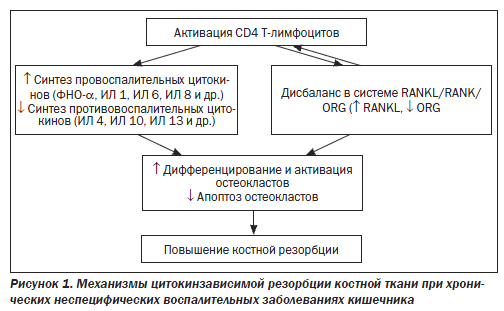
Продолжается изучение роли апоптоза в механизмах развития остеопороза при патологии пищеварительного тракта. Отмечены увеличение темпа и частоты апоптоза остеобластов, остеокластов и возможная роль апоптоза остеоцитов при некоторых видах остеопороза, в том числе алиментарного. Не исключено, что индукция апоптоза остеоцитов и вторичный некроз апоптических телец могут быть существенными факторами активации остеоцитарного остеолиза при остеопорозе, связанном с патологией органов пищеварения.
Среди факторов, влияющих на формирование внекишечных проявлений ВЗК, в частности остеопороза, выделяют и дисбиотические изменения кишечной микрофлоры. С одной стороны, симбиотические микроорганизмы существенно влияют на структуру кишечника и его всасывательную функцию, способствуют всасыванию витамина D, кальция и железа, с другой — принимают активное участие в формировании иммунобиологических реакций организма, стимулируют лимфоидный аппарат, синтез иммуноглобулинов, интерферонов, цитокинов, увеличивают количество пропердина и комплемента, повышают активность лизоцима и способствуют уменьшению проницаемости сосудистых, тканевых барьеров для токсических продуктов патогенных и условно-патогенных микроорганизмов. Снижение количества сахаролитических микроорганизмов способствует повышению концентрации протеолитической грамотрицательной микрофлоры (кишечной палочки, условно-патогенных энтеробактерий). Липополисахариды грамотрицательных микроорганизмов оказывают влияние на различные клетки-акцепторы — макрофаги, нейтрофилы, тромбоциты, эозинофилы, эндотелиоциты, результатом чего является инициация продукции провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α, интерферона-γ). Известно, что некоторые микробы-комменсалы могут стать патогенными при соответствующих условиях.
Метаболические эффекты микрофлоры кишечника связаны с синтезом короткоцепочных желчных кислот (КЦЖК). Последние образуются в результате анаэробного брожения доступных для бактерий ди-, олиго- и полисахаридов. Локально КЦЖК определяют снижение рН и обеспечивают колонизационную резистентность, а также принимают участие в регуляции кишечной моторики. Образование бутирата крайне важно для эпителия толстой кишки, так как колоноциты используют бутират для обеспечения своих энергетических потребностей. Бутират также принимает непосредственное участие в процессах всасывания воды, натрия, хлора, кальция, магния. Таким образом, нарушение его образования приводит к водно-электролитному дисбалансу в организме и недостаточному обеспечению кальцием и магнием.
Проведенные в ГУ «Институт гастроэнтерологии АМНУ» исследования показали, что максимальная частота выявления глубоких дисбиотических расстройств качественного и количественного состава микрофлоры толстой кишки при ВЗК наблюдалась в группе пациентов с остеопорозом (90,9 %). Дисбаланс микрофлоры толстой кишки был обусловлен главным образом снижением основных симбионтов толстокишечного содержимого, а именно бифидо- и лактофлоры, уменьшением количества нормальной Escherichia coli, увеличением концентрации ее биоваров с лактозоотрицательными и гемолитическими свойствами, появлением условно-патогенных микроорганизмов родов Enterobacter, Serratia, Klebsiella, Citrobacter в концентрации ≥lg 7,0 КОЕ/г; повышением содержания дрожжеподобных грибов Candida albicans в концентрации >lg 4,0 КОЕ/г.
В группе больных с остеопорозом наблюдалось значительно большее количество пациентов со снижением количества бифидо- и лактобактерий (81,8 %). Уменьшение сахаролитической флоры приводит к снижению ацидификации содержимого толстой кишки, а именно меньшей концентрации молочной и уксусной кислот — метаболитов бифидо- и лактобактерий, повышению рН в проксимальных отделах кишечника, что снижает растворимость кальция, вследствие чего уменьшается парацеллюлярный кальциевый транспорт и замедляется трансклеточный транспорт ионов Са. Кроме того, уменьшение количества бифидобактерий приводит к нарушению всасывания не только Са, но и витамина D.
Выявленная связь между степенью дисбиотических расстройств у больных с НЯК и БК и наличием остеопороза у этих пациентов подтверждает существенное влияние микрофлоры толстой кишки на метаболизм костной ткани.
Имеются данные, свидетельствующие о том, что риск развития остеопороза и переломы позвоночника у молодых пациентов с ВЗК генетически детерминированы. Исследование генетических маркеров развития остеодефицита показало прямую связь между нарушением минеральной плотности костной ткани (МПКТ) и генами-рецепторами провоспалительных цитокинов ИЛ-1 и ИЛ-6 при ВЗК и обратную зависимость между постменопаузным остеопорозом и генами-рецепторами эстрогена и витамина D.
Нарушение метаболизма основных микроэлементов кости при гастроэнтерологической патологии может усугубляться различными неблагоприятными факторами. Так, например, курение негативно влияет на метаболизм эстрогенов, снижая их биодоступность, что способствует снижению пика костной массы. Отрицательное влияние оказывают злоупотребление алкоголем, кофе, чрезмерное употребление соли, диета с недостаточным содержанием молочных продуктов, низкая физическая активность.
Частое и длительное использование кортикостероидов в лечении ВЗК также является одним из важных факторов, приводящих к нарушению минеральной плотности костной ткани. Глюкокортикоидный остеопороз (ГКОП) не только занимает первое место в этиологической структуре вторичного остеопороза, но и обусловливает более половины всех случаев остеопороза в молодом возрасте.
Данные относительно влияния на метаболизм костной ткани различных доз глюкокортикоидов (ГК) и длительности терапии противоречивы. Существует мнение, что малые дозы этих препаратов не способны изменить содержание минеральных веществ в позвоночнике и аппендикулярном скелете, однако это не соответствует клиническим наблюдениям относительно повышенной частоты переломов у больных, принимающих стероиды. Большинство исследователей считают пороговой дозой, при употреблении которой возникает остеопороз, 10 мг преднизолона или эквивалентную дозу других стероидов.
Что касается длительности использования данных препаратов, некоторые исследователи отмечают, что первые клинические признаки стероидного остеопороза появляются через 2 года постоянного приема кортикостероидов, другие — приблизительно через 3 года использования 5–7,5 мг/сут преднизолона ежедневно, остальные доказывают, что нарушение в ремоделировании костной ткани наступает в первые месяцы приема препаратов стероидного ряда и постоянно усиливается.
Имеются данные о том, что наиболее интенсивное снижение костной массы отмечается в первые 6–12 месяцев от начала терапии ГК, достигая 15 % в год, затем замедляется и выходит на плато на уровне 3,5 % в год. На фоне приема высоких доз ГК (более 20 мг/сут) снижение костной массы развивается преимущественно в поясничном отделе позвоночника (20–30 %) в первые 6–12 месяцев терапии.
До настоящего времени ведутся дискуссии по поводу относительно безопасной дозы ГК. В недавних исследованиях было показано, что эндогенная продукция кортизола составляет 6 мг/м2, что примерно соответствует дозе экзогенно вводимого гидрокортизона 20 мг/сут у мужчин и 15 мг/сут у женщин. Если принять во внимание, что относительная активность гидрокортизона по отношению к преднизолону составляет 1 : 4, то физиологическая доза преднизолона не должна превышать 3,75 мг/сут у женщин и 5 мг/сут у мужчин.
Исследование структурно-функционального состояния костной ткани в зависимости от использования в последние 5 лет в терапии больных хроническими ВЗК гормонов коры надпочечников, проведенное в отделении заболеваний кишечника ГУ «Институт гастроэнтерологии АМНУ», показало, что частота остеодефицита в группе пациентов, которые за последние 5 лет не принимали ГК, была в три раза ниже (р < 0,05), чем у больных, которым назначались данные препараты. При этом выраженность изменений МПКТ зависела от длительности лечения (табл. 1).
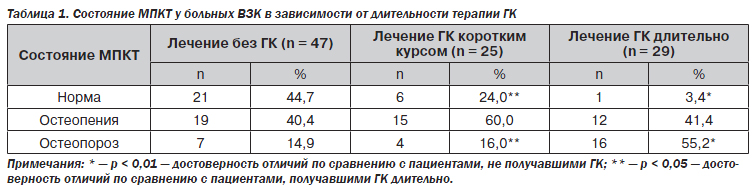
Как следует из табл. 1, при использовании ГК коротким курсом не более 1 раза в год снижение МПКТ наблюдалось у 76,0 % пациентов, при длительном лечении ГК — у 96,6 %. При более детальном анализе степени потери костной массы выявилось, что в группе больных, которым за последние 5 лет на протяжении не менее 3 лет назначались ГК коротким курсом (до 2 месяцев) 2 и более раз в год или длительным курсом (свыше 6 месяцев), частота остеопороза была максимальной (55,2 %), а нормальные показатели денситометрии были зафиксированы только в одном случае (3,4 %).
В то же время у пациентов, терапия которых не включала ГК, или ГК назначались редко коротким курсом (до 2 месяцев в год или реже), частота остеопороза была в 3,5 раза меншей (р < 0,05), а нормальные результаты денситометрии были выявлены в 44,7 и 24,0 % случаев соответственно.
При этом установлены обратные корреляционные связи между приемом ГК и качественными и количественными денситометрическими показателями: rs = –0,42 (р < 0,001) — с индексом прочности кости; rs = –0,37 (р < 0,001) — с показателем Z; rs = –0,45 (р < 0,001) — с показателем Т. Таким образом, терапия кортикостероидами является важной детерминантой, определяющей степень поражения костной ткани, темпы развития остеодефицита и его распространенность у больных хроническими ВЗК.
Снижение костной массы при ГКОП происходит неравномерно в различных участках скелета. По мнению ряда авторов, снижение МПКТ может быть выражено как в проксимальных отделах бедренной кости, так и в позвоночнике. В то же время данные эпидемиологических исследований свидетельствуют о том, что частота переломов шейки бедра у больных с ГКОП ниже, чем частота переломов позвоночника.
Экзогенное введение синтетических аналогов ГК приводит к развитию ГКОП у 30–50 % пациентов, причем его частота и выраженность зависят от длительности приема препаратов, их суммарной дозы, возраста и массы тела пациента, в меньшей степени — от способа введения.
В основе ГКОП лежат следующие патогенетические механизмы:
Еще в ранних исследованиях было показано, что одной из возможных причин, определяющих развитие ГКОП, является снижение кишечной абсорбции кальция. При этом снижение абсорбции кальция выявляется уже в течение первых недель от начала ГК-терапии и зависит от дозы ГК. Необходимо иметь в виду, что ГК ингибируют только активную кишечную абсорбцию кальция, в то время как пассивная диффузия через стенку кишечника несколько возрастает и становится основным механизмом поступления кальция в организм больных, получающих ГК. Следовательно, нарушение абсорбции кальция на фоне ГК-терапии может иметь особенно важное значение в развитии остеопороза при ограничении поступления кальция с пищей, что свойственно пациентам с ВЗК. Механизмы ГК-опосредованного ингибирования абсорбции кальция до конца не ясны.
Определенную роль может играть нарушение метаболизма витамина D. Так, имеются данные о том, что на фоне лечения ГК наблюдается снижение синтеза и метаболизма 1,25(OH)2D3. In vitro дексаметазон на 70 % снижает число рецепторов к витамину D и зависимым от дозы образом подавляет образование иРНК витамина D.
В то же время ГК способствуют снижению тубулярной реабсорбции кальция и усиленному выделению его с мочой. Отрицательный баланс кальция в организме приводит к гиперсекреции паратиреоидного гормона, что, в свою очередь, усиливает процессы резорбции костной ткани.
Основные эффекты ГК на костеобразование заключаются в снижении репликации клеток остеобластического ряда, уменьшении образования новых остеобластов, а также в усилении апоптоза и некроза. Результатом данных изменений является истощение клеточной популяции, способной к образованию кости.
Помимо прямого действия, ГК оказывают непрямые эффекты, опосредуемые локальными факторами: снижение синтеза коллагена 1-го типа и усиление экспрессии коллагеназы 3-го типа, что приводит к уменьшению костного матрикса, а увеличение синтеза связывающих белков, в свою очередь, способствует снижению костеобразования.
Значительный прогресс в понимании механизмов развития ГКОП был достигнут благодаря открытию новых членов семейства лигандов ФНО-α и их рецепторов (RANKL, RANK, остеопротегерина), которые играют ключевую роль в формировании, дифференцировании и активности остеокластов, кроме того, являются молекулярными посредниками других медиаторов ремоделирования костной ткани. В опытах in vitro было показано, что ГК подавляют образование остеопротегерина (ингибитор костной резорбции) и конкурентно стимулируют экспрессию RANKL (стимулятор костной резорбции) на остеокластах и стромальных костномозговых клетках. Высказано предположение о том, что быстрое снижение костной массы в начале ГК-терапии связано со способностью ГК увеличивать продолжительность жизни зрелых остеокластов, опосредуемой гиперэкспрессией RANKL.
Экспериментальные данные последних лет по оценке влияния ГК на костную резорбцию, выполненные на культуре остеокластов человека, свидетельствуют о стимулирующем влиянии ГК на остеокласты. Кроме того, повышенное содержание ГК в организме приводит к увеличению скорости резорбции костной ткани, обусловленному рядом патологических влияний.
Хорошо известно, что ГК подавляют продукцию ПГЕ2, который обладает способностью стимулировать синтез коллагена и неколлагеновых белков костными клетками, ИПФР-1 и ИПРФ-1-связывающего белка, активирующих синтез коллагена 1-го типа и пролиферацию остеобластов.
Еще один потенциальный механизм остеопоротического действия ГК определяется их влиянием на синтез половых гормонов. Установлено, что лечение ГК ассоциируется со снижением концентрации эстрадиола, Е2 тестостерона, ЛГ, ФСГ, что склонны связывать с подавлением синтеза кортикотропина и ГТГ. В свою очередь, дефицит этих гормонов, обладающих анаболической активностью, создает предпосылки для развития остеопороза.
Таким образом, причины развития остеодефицита при ВЗК разнообразны. Их изучение позволит выделить группы пациентов, нуждающихся в профилактических мероприятиях для предупреждения прогрессирования нарушений структуры костной ткани и развития осложнений.
Диагностика остеодефицита
К сожалению, клинически установить диагноз остеодефицита практически не представляется возможным. Главное, что отличает остеопороз от других заболеваний опорно-двигательного аппарата, это мизерная симптоматика. Жалобы имеют общий характер, их тяжело отличить от простого переутомления или жалоб основного заболевания. Клинически остеопороз проявляется общей слабостью, повышенной утомляемостью, болью по ходу позвоночника; при этом косвенными признаками могут быть усиление кифоза, сколиотические искривления позвоночника, нарушение походки. По мере прогрессирования остеопоротического процесса увеличивается количество жалоб на боль в суставах, позвоночнике, проекции таза, бедер, особенно в ночное время, боль принимает постоянный характер. Картина смазывается на фоне проявлений основного заболевания.
С учетом того, что остеопороз практически не имеет специфических клинических проявлений вплоть до возникновения переломов, основная задача — выявление больных с начальными нарушениями МПКТ с целью предупреждения прогрессирования потери костной массы и уменьшения риска переломов. Постановка диагноза остеопении и остеопороза основывается на дополнительных методах исследования.
К сожалению, лабораторные методы исследования состояния костной ткани не всегда информативны или специфичны (активность щелочной фосфатазы, концентрация минералов крови). Некоторые из них являются малодоступными, дорогостоящими и недостаточно изученными (гидроксипролин в моче, галактозилгидроксилизин и др.). Поэтому основными, наиболее точными в диагностике остеопороза на ранних стадиях при патологии кишечника являются инструментальные методы исследования.
Рентгенологические признаки остеопороза выявляются при значительном дефиците костной массы, составляющем 30–35 %. На рентгенограммах костей появляется крупнопетлистый рисунок вследствие рассасывания отдельных костных балок и увеличения костномозгового пространства. Наряду с этим определяется истончение кортикальной прослойки, деформация тел позвонков. Однако, к сожалению, при помощи обычного рентгенологического исследования остеопороз выявляется на поздних стадиях.
Золотым стандартом определения минеральной плотности позвоночника, бедренной кости и всего скелета является биэнергетическая рентгеновская абсорбциометрия. Метод основывается на измерении поглощения костью фотонов, излучаемых монохроматическим источником. Использование двухфотонного рентгеновского денситометра (Dual Energy X-Ray Absorptiometry — DXA) позволяет оценить минимальные изменения минеральной плотности костной ткани (от 2 %), что открывает новые возможности для оценки эффективности профилактических и лечебных мероприятий при остеопорозе.
Существуют также другие, менее распространенные в практической деятельности методы исследования скелета (магнитно-резонансная томография дистальных отделов лучевой кости, микротомография с высокой разделительной способностью, синхронная трехизмерительная радиотомография с использованием высокофотонного монохроматического рентгеновского луча, компьютерная количественная радиография и др.), которые используются в основном для научных исследований.
Одним из распространенных современных методов исследования минеральной плотности костной ткани является ультразвуковая костная денситометрия, которая базируется на определении скорости распространения ультразвука по кости. Самым известным представителем ультразвуковых денситометров является прибор Aсhilles 5+ (Lunar Corp., США). С его помощью измеряется время прохождения ультразвуковой волны через пяточную кость. Преимущества данного метода — доступность, отсутствие ионизирующего излучения, короткое время исследования, компактность и портативность оборудования, что является важным при проведении эпидемиологических исследований. Метод высокочувствительный, позволяет обнаружить ранние признаки рарефикации костной ткани.
Лечение остеопороза при ХВЗК
Высокая частота выявления остеопении и остеопороза у больных ВЗК диктует необходимость проведения остеотропной терапии. Целью лечения является замедление или прекращение снижения костной массы, увеличение минеральной плотности костной ткани, предупреждение возникновения переломов костей, нормализация процессов ремоделирования, уменьшение или прекращение боли в костях, улучшение общего состояния больного и расширение его двигательной активности, улучшение качества жизни пациента.
Лечение остеопороза базируется на таких принципах:
Необходимым компонентом в комплексе противоостеопоротических мероприятий при патологии кишечника является диета с повышенным содержанием Са. Основным источником Са являются молочные продукты (молоко, творог, твердые сыры), рыбные продукты, зерновые, лесные орехи, цветная и морская капуста, яйца. Усвоению Са препятствуют продукты с высоким содержанием щавелевой кислоты (шпинат, смородина, ревень). Однако часто пациенты с ВЗК, панкреатитом, лактазной недостаточностью плохо переносят молочные продукты.
Медикаментозные препараты для лечения остеопороза могут быть условно разделены на следующие группы:
В настоящее время нет идеального препарата для лечения остеопороза при заболеваниях органов пищеварения, который соответствовал бы всем требованиям успешной терапии остеопороза и приостанавливал значительные потери костной массы настолько, чтобы предотвратить во всех случаях переломы костей. Поэтому в терапии остеопороза при патологии кишечника является необходимым использование препаратов, которые угнетают костную резорбцию, действуют преимущественно лишь на костную ткань, остаются длительное время в скелете и не оказывают побочных эффектов на желудочно-кишечный тракт. Препараты для лечения остеопороза на фоне ВЗК могут использоваться как в виде монотерапии для непрерывного или курсового лечения, так и в разных сочетаниях для комбинированной терапии.
Таким образом, препараты, использующиеся для лечения остеопороза при ХВЗК, должны иметь такие свойства: увеличивать минеральную плотность костной ткани; снижать риск и частоту переломов; не нарушать нормальную структуру и минерализацию кости; хорошо переноситься и быть удобными в использовании; не усугублять основной патологический процесс и быть доступными.
Критериями эффективности лечения являются: улучшение самочувствия больного, отсутствие отрицательной динамики минеральной плотности костной ткани, прирост костной массы по данным количественной денситометрии (более 1 % в год), нормализация биохимических параметров.
В течение последнего десятилетия бисфосфонаты заняли ведущее место в лечении и профилактике остеопороза. Антирезорбтивные средства этой группы снижают костные потери путем подавления активности остеокластов и замедления костной резорбции, что приводит к увеличению костной массы. В клинических исследованиях было продемонстрировано, что бисфосфонаты (алендронат, ризедронат, этидронат, ибандронат) обладают достаточно высокой эффективностью: повышают минеральную плотность костной ткани в позвоночнике и бедренных костях, предотвращают новые переломы. Результаты плацебо-контролируемых исследований и данные метаанализа свидетельствуют о том, что лечение бисфосфонатами приводит к дозозависимому увеличению минеральной плотности костной ткани и снижению риска переломов на 30–50 % у больных с первичным и глюкокортикоидным остеопорозом.
Наиболее популярным препаратом этой группы является фосамакс (алендронат натрия) — аминобисфосфонат, который действует как мощный специфический ингибитор остеокластиндуцированной резорбции костной ткани, нормализующий скорость перестройки кости, что позволяет отнести его к патогенетическим антирезорбтивным средствам. В результате лечения фосамаксом формируется кость нормального качества без нарушения минерализации. Препарат назначается по 70 мг 1 раз в неделю.
Изучению эффективности бисфосфонатов при ВЗК посвящены несколько исследований. Однако ни в одном из них не показано влияние терапии на частоту переломов позвоночника.
Альтернативу бисфосфонатам составляют препараты группы кальцитонина (миокальцикс, сибакальцин, хубер кальцитонина). Они не только существенно уменьшают выведение Са из кости, но и эффективно снижают болевой синдром. Недостатком их является большое число побочных реакций и высокая стоимость.
Остеогенным действием обладают также флюориды, однако в некоторых исследованиях показано, что, вызывая прирост костной массы, флюориды не повышают ее прочность. К тому же препараты плохо переносятся больными ВЗК.
Соли кальция самостоятельного значения в терапии остеопороза не имеют, однако обязательно используются в комплексе с другими лечебными препаратами, а также для профилактики в группах риска по остеопорозу. У больных с диагностированным остеопорозом суточная доза Са должна составлять 1500–2000 мг, причем доза может изменяться в зависимости от индивидуальных факторов. Наиболее часто используются такие препараты кальция: хлористый кальций, глюконат кальция, глицерофосфат кальция, фосфат кальция, карбонат кальция, лактат кальция, цитрат кальция (препараты даны в порядке увеличения их биоусвояемости). В последнее время стало известно, что ночью происходит ускоренное снижение содержания минеральных компонентов в кости (циркадное ускорение резорбтивных процессов в кости). Таким образом, более целесообразным является вечерний прием препаратов кальция, что предупреждает ускоренное снижение его содержания во второй половине ночи.
Побочные эффекты в результате приема препаратов кальция перорально встречаются редко. Хотя необходимо помнить, что при употреблении кальция в высоких дозировках имеется риск развития мочекаменной болезни (особенно при использовании доз более 2000 мг/сут). Поэтому практическим врачам следует рекомендовать таким пациентам увеличить прием жидкости (1,2–1,5 л/сут).
Наряду с препаратами Са в лечении остеопороза существенное значение имеют активные метаболиты витамина D, которые улучшают всасывание Са и являются мощными антирезорбентами. За счет угнетения секреции паратиреоидного гормона, стимуляции клеточной дифференциации, модуляции иммунного ответа они способствуют увеличению кишечной абсорбции Са, активации стимуляции костного формирования и костного ремоделирования.
В клинической практике используются два синтетических метаболита витамина D — кальцитриол и альфакальцидиол. Кальцитриол повышает абсорбцию Са в кишечнике, снижает резорбцию кости, обеспечивает нормальную ее минерализацию. Особенностью этой формы является то, что для преобразования в конечный продукт — 1,25(ОН)2D3 необходимо только гидроксилирование в печени и непосредственно в костях, в связи с чем препарат не вызывает резкого подъема уровня 1,25(ОН)2D3 в крови и его можно принимать одноразово. Использование альфакальцидола приводит к улучшению структуры компактной и губчатой кости и функционального состояния костной ткани.
Препаратами кальция второго поколения являются комплексы солей кальция с витамином D3. Результатом такого сочетания стало увеличение биодоступности Са и улучшение эффективности лечения остеопенического синдрома.
Третье поколение препаратов кальция — комплекс Са, витамина D3 и микроэлементов.
Согласно международным консенсусам, заместительная терапия препаратами Са (500–1000 мг/день) и витамина D показана всем пациентам ВЗК со снижением минеральной плотности костной ткани, а также всем пациентам, которые получают кортикостероиды.
Однако использование комбинированных препаратов кальция с витамином D при заболеваниях органов пищеварения требует взвешенного подхода относительно длительности приема. Общеизвестно, что жирорастворимые витамины, в том числе витамин D, при длительном приеме склонны накапливаться в организме. При длительном приеме таких препаратов обязательным является регулярный контроль уровня Са в крови и моче.
В ГУ «Институт гастроэнтерологии АМНУ» предложена программа коррекции нарушений МПКТ у пациентов с ВЗК. При этом базисная терапия НЯК и БК была дополнена назначением карбоната кальция в сочетании с витамином D3. Карбонат кальция из всех солей кальция содержит максимальное количество элементарного кальция и оказывает минимальное раздражающее воздействие на желудочно-кишечный тракт. Кальций в форме карбоната обладает вяжущими свойствами, что очень важно для больных с диареей. Витамин D3 способствует улучшению абсорбции кальция в кишечнике и опосредованно уменьшает костную резорбцию. Две таблетки комбинированного препарата карбоната кальция с витамином D3 обеспечивают оптимальную потребность в кальции и витамине D для профилактики остеодефицитного состояния, а вечерний прием препарата предупреждает циркадное ускорение резорбтивных процессов в костях. Эффективность препарата изучена у 28 больных с ВЗК. Препарат назначался по 2 таблетки во время ужина. Оценка эффективности лечения проводилась по результатам денситометрии пяточной кости и состояния минерального обмена через 6–12 месяцев лечения.
Изменения МПКТ в динамике у обследованных больных представлены в табл. 2.
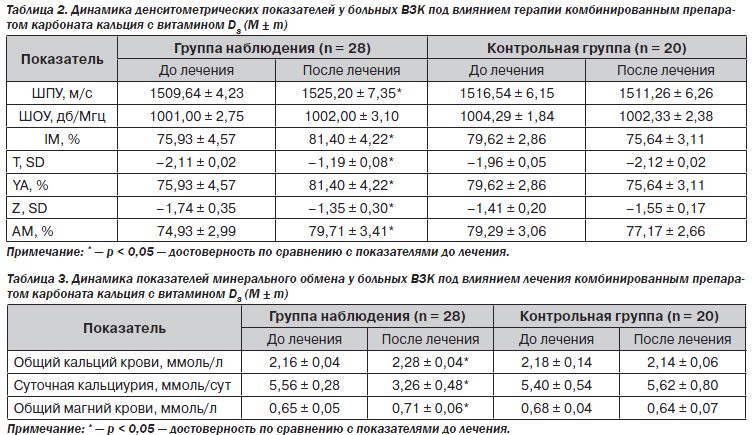
На фоне терапии комбинированным препаратом карбоната кальция с витамином D3 отмечалось достоверное увеличение показателя Т на 0,92 ± 0,06 SD, показателя Z — на 0,39 ± 0,05, индекса прочности кости — на 6,53 ± 0,35. При этом у 19 (67,8 %) больных наблюдалось увеличение костной массы, у 8 (28,6 %) не было ее потери и только у 1 (3,6 %) пациента отмечалась негативная динамика прироста.
У двух пациентов (7,1 %) с остеопенией І степени отмечена нормализация показателей ультразвуковой денситометрии, у двух (7,1 %) обследуемых с остеопенией ІІ степени и трех (10,7 %) с остеопенией ІІІ степени результаты обследования оказались на порядок лучше (І и ІІ степени соответственно). Уменьшилось количество больных с остеопорозом, после лечения у них наблюдалась остеопения.
В контрольной группе больных, которые не получали препараты кальция и витамина D, отмечалось неуклонное ухудшение денситометрических показателей: уменьшение показателя Т на 0,16 ± 0,03 SD, показателя Z — на 0,13 ± 0,97 SD, индекса прочности кости на 4,02 ± 0,25 %. При этом у двух пациентов (10,0 %) с остеопенией І степени результаты денситометрии ухудшились до ІІ степени, у одного больного (5,0 %) с остеопенией ІІІ степени при обследовании в динамике был выявлен остеопороз.
При сравнении частоты встречаемости нарушений МПКТ в двух сравниваемых группах больных по критерию c2 данные были достоверны (c2 = 10,32; р < 0,05). Таким образом, комбинированный препарат карбоната кальция с витамином D3 оказался эффективным средством стабилизации костной массы у больных ВЗК. Под его влиянием отмечалась также положительная динамика показателей минерального обмена (табл. 3). Через 6–12 месяцев лечения у всех больных выявлено повышение содержания общего кальция в крови с 2,16 ± 0,04 ммоль/л до 2,28 ± 0,04 ммоль/л (р < 0,05), магния в крови — с 0,65 ± 0,05 ммоль/л до 0,71 ± 0,06 ммоль/л (р < 0,05), уменьшение потери кальция с мочей — с 5,56 ± 0,28 ммоль/сут до 3,26 ± 0,48 ммоль/сут (р < 0,05). Случаев гиперкальциемии и гиперкальциурии в ходе лечения не было зафиксировано.
Параллельно с увеличением сроков приема препарата у пациентов уменьшались жалобы со стороны опорно-двигательного аппарата. Так, под влиянием остеотропной терапии уменьшение боли в поясничном отделе позвоночника отметили 17 (60,7 %) больных, в грудном отделе — 5 пациентов (31,6 %) (16 — до начала лечения), боль в костях перестала беспокоить 4 обследованных (44,4 %) (9 — перед началом лечения), тогда как в контрольной группе субъективное уменьшение боли в спине отметили только два пациента. Таким образом, использование комбинированного препарата карбоната кальция с витамином D3 дало возможность этим пациентам отказаться от употребления обезболивающих средств и тем самым избежать неблагоприятного воздействия на желудочно-кишечный тракт.
Определенное вспомогательное значение для нормализации кальциевого гомеостаза и улучшения костного обмена может иметь оссеин-гидроксиапатитный комплекс (остеогенон). Важно, что этот препарат практически не имеет противопоказаний.
Таким образом, несмотря на многолетние интенсивные исследования, проблема диагностики и лечения остеопороза при ВЗК еще далека от разрешения. Тем не менее использование рекомендаций по профилактике и лечению остеодефицита у данной категории пациентов позволит добиться существенного прогресса в помощи пациентам с этим тяжелым заболеванием.
1. Бензар І.М., Гусак О.М., Федонюк Я.І. Зміни мінеральної щільності кісткової тканини при неспецифічних запальних захворюваннях товстої кишки // Ортопедия, травматология и протезирование. — 2002. — № 4. — С. 111-113.
2. Бойко Т.Й., Сорочан О.В., Єгоров В.Ф. Стан мінеральної щільності кісткової тканини при хронічних неспецифічних запальних захворюваннях кишок // Сучасна гастроентерологія. — 2005. — № 5. — С. 48-51.
3. Головач І.Ю. Структурно-функціональний стан кісткової тканини при тривалому застосуванні ГКК // Український терапевтичний журнал. — 2004. — № 1. — С. 53-60.
4. Дедух Н.В., Бенгус Л.М. Возможные механизмы костной резорбции при алиментарном остеопорозе (Обзор литературы) // Український медичний альманах. — 2001. — Т. 4, № 4. — С. 213-217.
5. Златкина А.Р., Белоусова Е.А. Внекишечные проявления болезни Крона // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2000. — Т. 10, № 6. — С. 60-64.
6. Клубова А.Ф. Апоптоз и остеопороз // Доктор. — 2002. — № 1. — С. 55-57.
7. Комбинированные препараты кальция и витамина Д в лечении и профилактике остеопороза: современные доказательные позиции (по материалам клинических рекомендаций Российской ассоциации по остеопорозу «Остеопороз: диагностика, профилактика, лечение, 2005») // Мистецтво лікування. — 2005. — № 10. — С. 38-42.
8. Куликович Ю.Н., Латыш В.Д., Юрьева О.С. Остеопороз: диагностика и новые методы лечения // Журнал практичного лікаря. — 2002. — № 5. — С. 34-40.
9. Лобенко А.О., Таварткінадзе Н.Є. Роль прозапальних цитокінів у патогенезі остеопорозу у щурів // Журнал АМН України. — 2001. — Т. 7, № 1. — С. 121-127.
10. Лоренс Б. Риггз, Л. Джозеф Мелтон ІІІ. Остеопороз. Этиология, диагностика, лечение: Пер. с англ. / Под ред. Е.А. Лепарского. — М.: Бином; СПб.: Невский диалект, 2000. — 558 с.
11. Мазуров В.И., Зоткин Е.Т. Остеопороз в практике терапевта: патофизиология, факторы риска, классификация, диагностика, лечение // Врачебные ведомости. — 2000. — № 3. — С. 59-65.
12. Масик О.М., Сміян С.І., Жулкевич І.В. Сучасні аспекти застосування бісфосфонатів у клінічній практиці // Журнал АМН України. — 2000. — Т. 6, № 4. — С. 713-721.
13. Митник З.М., Головач І.Ю. Вторинний остеопороз у практиці лікаря-гастроентеролога: патогенетичні механізми виникнення та можливості лікування і профілактики // Проблеми остеології. — 2001. — Т. 4, № 1–2. — С. 105-106.
14. Насонова В.А., Цветкова Е.С. Фармакотерапия остеопороза // Лечащий врач. — 2004. — № 7. — С. 22-26.
15. Нейко Є.М., Головач І.Ю., Митник З.М. та ін. Сучасні методи оцінки стану кісткової тканини та діагностики її порушень при остеопорозі // Ортопедия, травматология и протезирование. — 2001. — № 4. — С. 107-113.
16. Корж Н.А., Поворознюк В.В., Дедух Н.В., Зупанец И.А. Остеопороз: эпидемиология, клиника, профилактика и лечение. — Харьков: Золотые страницы, 2002. — 648 с.
17. Пасиешвили Л.М., Андруша А.Б., Бабак М.О. Возможные механизмы костной резорбции при сочетанном течении заболеваний кишечника и остеохондроза // Украинский терапевтический журнал. — 2006. — № 2. — С. 47-49.
18. Поворознюк В.В. Остеопороз — проблема ХХІ сторіччя // Мистецтво лікування — 2005. — № 10. — С. 38-42.
19. Поворознюк В.В. Остеопороз и биохимические маркеры метаболизма костной ткани // Лабораторная диагностика. — 2002. — № 1. — С. 53-61.
20. Поворознюк В.В., Григорьева Н.В. Препараты кальция и витамина Д в профилактике и лечении остеопороза // Рациональная фармакотерапия. — 2006. — № 1. — С. 35-40.
21. Проблеми остеопорозу / За ред. Л.Я. Ковальчук. — Тернопіль: Укрмедкнига, 2002. — 443 с.
22. Пыжик А.Ю. Остеопороз // Лечащий врач. — 2004. — № 1. — С. 66-68.
23. Руководство по остеопорозу / Под ред. Л.И. Беневоленской. — М.: Бином. Лаборатория знаний, 2003. — 524 с.
24. Сорочан О.В. Синдром вторинного остеодефіциту у хворих на хронічні неспецифічні запальні захворювання кишок // Проблеми військової охорони здоров''я: зб. наук. праць Укр. військово-медичної академії. — К., 2006. — Вип. 15. — С. 363-369.
25. Сорочан О.В., Тропко Л.В., Бойко Т.Й. Порушення мікробіоценозу товстої кишки і метаболічні аспекти його впливу на формування позакишкових проявів хронічних неспецифічних запальних захворювань кишок, зокрема остеопорозу / Гастроентерологія: міжвід. зб. — Дніпропетровськ, 2006. — Вип. 37. — С. 354-361.
26. Чекман И.С., Козак Л.И. Препараты кальция и кальцитонина — клинико-фармакологические свойства // Журнал практичного лікаря. — 2004. — № 4. — С. 71-74.
27. Шостак Н.А. Остеопороз: современные аспекты диагностики и лечения // Лечащий врач. — 2004. — № 7. — С. 26-30.
28. Ardizzone S., Bollani S., Bettica P. et al. Altered bone metabolism in inflammatory bowel disease: there is a difference between Crohn''s disease and ulcerative colitis // J. Intern. Med. — 2000. — № 247. — P. 63‑70.
29. Bachrach L.K. Bland Rosemary Steroid hormone receptor ecspression and action in bone // Clin. Sci. — 2000. — № 98. — P. 217-240.
30. Bernstein C.N., Bector S., Leslie W.D. Lack of relationship of calcium and vitamin D intake to bone mineral density in premenopausal women with inflammatory bowel disease // Am. J. Gastroenterol. — 2003. — № 98. — P. 2468-2473.
31. Bernstеn C.N., Leslie W.D. The pathophysiology of bone in gastrointestinal disease // Eur. J. Gastroenterol. Hepatol. — 2003. — Vol. 15, № 8. — P. 857-864.
32. Canalis E. Mechanisms of glucocorticoid-induced osteoporosis // Curr. Opin. Rheumatol. — 2003. — № 15. — P. 454-457.
33. Dempster D.W., Lindsay R. Mineral metabolism // The Lancet. — 2003. — Vol. 314, № 3. — P. 797-802.
34. Fang Y., Rivadeneira F., van Meurs J.B. et al. Vitamin D receptor gene Bsml and Taql polymorphisms and fracture risk: a metaanalysis // Bone. — 2006. — № 39. — P. 938-945.
35. Gilman J., Shanahan F., Cashman K.D. Altered levels of biochemical indices of bone turnover and bone-related vitamins in patients with Crohn''s disease and ulcerative colitis // Aliment. Pharmacol. Ther. — 2006. — № 23. — P. 1007-1016.
36. Henderson S., Hoffman N., Prince R. A double-blind placebo-controlled study of the effects of the bisphosphonate risedro-nate on bone mass in patients with inflammatory bowel disease // Am. J. Gastroenterol. — 2006. — № 101. — P. 119-123.
37. Hofbauer L.C., Kühne C.A., Viereck V. The OPG/RANKL/RANK system in metabolic bone diseases // J. Muscutoskelet. Neuronal. Interact. — 2004. — № 4. — P. 268-275.
38. Jahnsen J., Falch J.A., Mowinckel P., Aadland E. Bone mineral density in patients with inflammatory bowel disease: a population-based prospective two-year follow-up study // Scand. J. Gastroenterol. — 2004. — № 39. — P. 145-153.
39. Max Reinshagen. Osteoporosis in inflammatory bowel disease // JCC. — 2008. — Vol. 2, № 3. — P. 202-207.
40. Mоschen A.R., Kаser A., Enrich B. et al. The RANKL/OPG system is activated in inflammatory bowel disease and relates to the state of bone loss // Gut. — 2005. — № 54. — P. 479-487.
41. Nemetz A., Toth M., Garcia-Gonzalez M.A. et al. Allelic variation at the interleukin 1 beta gene is associated with decreased bone mass in patients with inflammatory bowel diseases // Gut. — 2001. — № 49. — P. 644-549.
42. Pappa H.M., Gordon C.M., Saslowsky T.M. et al. Vitamin D status in children and young adults with inflammatory bowel disease // Pediatrics. — 2006. — № 118. — P. 1950-1961.
43. Reffitt D.M., Meenan J., Sanderson J.D. et al. Bone density improves with disease remission in patients with inflammatory bowel disease // Eur. J. Gastroenterol. Hepatol. — 2003. — № 15. — P. 1267-1273.
44. Robinson R.J., Iqbal S.J., Al-Azzawi F., Abrams K., Mayberry J.F. Sex hormone status and bone metabolism in men with Crohn''s disease // Aliment. Pharmacol. Ther. — 1998. — № 12. — P. 21-25.
45. Rosen C.J., Bilizikan J.P. Anabolic therapy for osteoporosis // J. Ciin. Endocrin. and Metabolism. — 2001. — Vol. 86, № 3. — Р. 957-964.
46. Sakellariou G.T., Moschos J., Berberidis C. et al. Bone density in young males with recently diagnosed inflammatory bowel disease // Joint Bone Spine. — 2006. — № 73. — P. 725-728.
47. Schulte C., Dignass A.U., Mann K., Goebell H. Bone loss in patients with inflammatory bowel disease is less than expected: a follow-up study // Scand. J. Gastroenterol. 1999. — № 34. — P. 696-702.
48. Schulte C., Goebell H., Roher H.D., Schulte K.M. Genetic determinants of lL-6 expression levels do not influence bone loss in inflammatory bowel disease // Dig. Dis. Sei. — 2001. — № 46. — P. 2521-2528.
49. Siffledeen J.S., Fedorak R.N., Siminoski K. et al. Randomized trial of etidronate plus calcium and vitamin D for treatment of low bone mineral density in Crohn''s disease // Clin. Gastroenterol. Hepatol. — 2005. — № 3. — P. 122-132.
50. Siffledeen J.S., Siminoski K., Jen H., Fedorak R.N. Vertebral fractures and role of low bone mineral density in Crohn''s disease // Clin. Gastroenterol. Hepatol. — 2007. — № 5. — P. 721-728.
51. Stokkers P.C., Deley M., Van Der Spek M. et al. Intravenous pamidronate in combination with calcium and vitamin D: highly effective in the treatment of low bone mineral density in inflammatory bowel disease // Scand. J. Gastroenterol. — 2006. — № 41. — P. 200-204.
52. Tirpitz C., Epp S., Klaus J. et al. Effect of systemic glucocorticoid therapy on bone metabolism and the osteoprotegerin system in patients with active Crohn''s disease // Eur. J. Gastroenterol. Hepatol. — 2003. — № 15. — P. 1165-1170.
53. Von Tirpitz C., Pischulti G., Klaus J. et al. Pathological bone density in chronic inflammatory bowel diseases-prevalence and risk factors // Gastroenterology. — 1999. — № 37. — P. 5-12.
