Газета «Новости медицины и фармации» Антимикробная и противовирусная терапия (310) 2010 (тематический номер)
Вернуться к номеру
Фармакокинетика антимикробных препаратов во время беременности и их действие на плод
Основным фактором, определяющим возможность лечебного применения антибактериальных препаратов во время беременности, является отсутствие неблагоприятного действия их на плод и организм беременной женщины.
Во время беременности высокая концентрация препарата увеличивает риск тератогенного и токсического действия на плод. С другой стороны, лечение субтерапевтическими дозами может не дать лечебного эффекта. Поэтому изучение фармакокинетики препаратов во время беременности необходимо для эффективной терапии гнойно-воспалительных заболеваний у беременных и внутриутробной инфекции плода.
Для фармакокинетических измерений используют следующие основные показатели:
В организме женщин во время беременности происходит ряд физиологических изменений: увеличивается объем жидкостей тела, усиливается сердечная деятельность, повышается выделительная функция почек за счет увеличения клубочковой фильтрации и почечного кровотока. Отмечается уменьшение тонуса и подвижности желудочно-кишечного тракта под влиянием смещения увеличенной матки, повышается печеночный метаболизм, изменяются и некоторые другие обменные процессы. В течение беременности значительно уменьшается концентрация протеинов в крови преимущественно за счет снижения альбуминовой фракции.
Все это оказывает существенное влияние на фармакокинетику антибактериальных веществ у беременных, воздействуя на процессы адсорбции, распределения в крови и органах, элиминации из организма (табл. 1). Наиболее существенным в фармакокинетике антибактериальных препаратов в организме беременных является их переход через плаценту от матери к плоду.
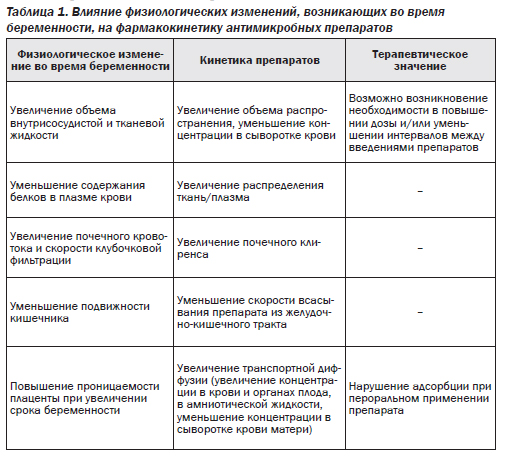
Во время беременности уменьшается адсорбция антибиотиков из желудочно-кишечного тракта. Это происходит вследствие увеличения времени эвакуации содержимого желудка, снижения подвижности кишечника, сдавливаемого беременной маткой, релаксации гладкой мускулатуры. Замедленное прохождение антибактериальных препаратов по желудочно-кишечному тракту повышает их биодоступность и приводит к более быстрому разрушению секретами пищеварительных органов.
Распределение лекарственных средств в тканях и жидкостях организма может быть активным и пассивным. Что касается антибиотиков, то их распределение происходит преимущественно путем диффузии (пассивный механизм). На степень диффузии влияют: градиент концентрации препарата, его молекулярная масса, степень связывания протеинами крови и степень ионизации, растворимость в липидах. Наибольшей скоростью диффузии обладают препараты с низкой молекулярной массой, мало связывающиеся протеинами плазмы, хорошо растворимые в липидах, имеющие большую степень ионизации.
Одним из важных факторов, влия-ющих на фармакокинетику антибиотиков во время беременности, является уменьшение альбуминовой фракции крови. Большинство антибиотиков связывается белками крови, при этом степень связывания различных препаратов существенно различается даже в пределах одной группы. Так, среди антибиотиков группы пенициллина величина связывания колеблется в пределах 10–15 % для ампициллина и метициллина, достигая 90 % для диклоксациллина. В группе цефалоспоринов наряду с препаратами, связывающимися белками крови на 15–20 % (цефалексин), имеются антибиотики, величина связывания которых достигает 80–90 % (цефазолин).
Степень связывания антибиотиков протеинами крови в значительной мере определяет их циркуляцию в организме, уровень в крови, диффузию в органы и ткани, метаболизм, скорость выведения из организма. Антибактериальной активностью и способностью к диффузии обладает лишь не связанная с протеинами фракция антибиотика. При этом имеет значение не только величина связывания, но и его характер, т.е. способность комплекса к диссоциации.
Существует прямая зависимость между антибактериальной активностью препарата и степенью связывания его белками: чем больше препарата находится в связанном состоянии, тем меньше его антибактериальная активность.
Уменьшение связывания антибиотиков белками крови приводит к повышению уровня свободной фракции, которая легче диффундирует из кровеносного русла в ткани и быстрее выводится из организма. Антибиотики с высокой степенью связывания протеинами имеют больший период полувыведения, медленнее проникают в ткани и дольше там сохраняются. Так, цефазолин связывается протеинами на 90 %, максимального уровня в тканях он достигает через 30–40 мин, период его полувыведения равен 2 ч. Цефалотин, например, мало связывается белками крови, максимального уровня в тканях он достигает через 15–20 мин, период его полувыведения составляет 30 мин, т.е. из организма он выводится в 4 раза быстрее, чем цефазолин. Снижение концентрации протеинов в сыворотке крови беременных приводит к меньшему связыванию антибиотиков, в результате чего создается более низкий уровень их в крови, наблюдается более быстрое выведение из организма.
Увеличение объема жидкости тела приводит к повышению объема распределения препарата в организме беременных и тем самым влияет на другие фармакокинетические параметры — уменьшение концентрации препаратов в сыворотке крови, увеличение почечного клиренса. У беременных происходит более интенсивное разрушение антибиотиков в печени. Это определяется большим накоплением в ней препаратов за счет лучшей диффузии свободной, не связанной с протеинами, фракции, а также увеличением метаболической активности печени в результате стимуляции ее энзимов прогестероном, уровень которого во время беременности повышается.
Выведение почками — основной способ элиминации антибиотиков из организма. Во время беременности выделительная функция почек повышается за счет ускорения клубочковой фильтрации почти на 60 % в первые 15 нед. Возрастание диффузии свободной фракции антибиотиков в почечную ткань также ускоряет его выведение.
Существенное влияние на содержание антибиотиков в организме беременных оказывает их переход через плаценту к плоду. Этот фактор не играет заметной роли в ранние сроки беременности, когда масса матки невелика, а диффузия препаратов ограничена. Однако по мере увеличения срока беременности к плоду переходит возрастающее количество препарата, что и влияет на содержание антибиотиков в организме матери.
Таким образом, физиологические изменения, развивающиеся у беременных женщин, способствуют уменьшению концентрации антибактериальных веществ в крови и органах по сравнению с небеременными; более всего это проявляется в III триместре беременности. Индивидуальные особенности организма, а также свойства препарата оказывают выраженное воздействие на особенности фармакокинетики антибиотиков во время беременности.
Различают две группы антибактериальных препаратов:
Снижение уровня антибиотиков в организме беременных женщин имеет важное клиническое значение. Чаще всего концентрация препаратов в крови, особенно тех, уровень которых снижается во время беременности, превышает их минимальную бактериостатическую концентрацию для возбудителей заболевания. Однако в некоторых случаях среднетерапевтические концентрации антибиотиков при лечении инфекций у беременных могут оказаться неэффективными, в связи с чем возникает необходимость в увеличении дозы. Без риска выраженных побочных реакций можно применять большие дозы антибиотиков, имеющих широкий диапазон между терапевтическим и токсическим действием, такие как пенициллины, цефалоспорины. Если указанный диапазон невелик, например, у аминогликозидов, препараты назначают только в среднетерапевтической дозе. При тяжело протекающем заболевании, неэффективности проводимого лечения, когда возникает необходимость в увеличении дозы антибиотиков, во избежание их эмбриотоксического действия целесообразно определять содержание препаратов в крови беременных женщин.
Фармакокинетика антибиотиков у беременных женщин с инфекционными процессами несколько отличается от таковой у здоровых беременных. Так, у беременных, страдающих пие-лонефритом, уменьшается скорость элиминации из организма цефуроксима и ампициллина.
В послеродовом периоде фармакокинетика антибиотиков существенно не изменяется. В раннем послеродовом периоде отмечается увеличение времени полувыведения некоторых антибактериальных препаратов (цефалексин, цефоперазон) по сравнению с данными исследования через 4 мес. после родов; объем распределения и почечный клиренс этих антибиотиков повышаются. У родильниц антибиотики обнаруживаются в лохиях и молоке. Так, в лохиях максимальная концентрация ампициллина выявлена через 1 ч после введения, затем уровень постепенно снижается, и через 12 ч имеются лишь его следы. В молоке содержание ампициллина выше, чем в лохиях, но ниже, чем в крови.
Наиболее хорошо изучена фармакокинетика b-лактамных антибиотиков, что объясняется их более частым применением во время беременности.
Различные заболевания (гипертония, гестоз, сахарный диабет и др.) могут существенно изменить проницаемость плаценты для антибиотиков. Среди факторов, влияющих на мембранные свойства плаценты, определенное значение имеет гипоксическое состояние материнского организма. В эксперименте острая гипоксия сопровождается значительным повышением проницаемости плаценты для ряда антибиотиков. Хроническая гипоксия, наблюдающаяся у беременных с разными формами порока сердца и явлениями ацидоза, не оказывает существенного влияния на проницаемость плацентарного барьера для антибактериальных препаратов. Нарушения функции печени и почек, приводящие к увеличению концентрации антибиотиков в крови матери, повышают риск токсического действия препаратов на плод.
Несмотря на определенные различия в переходе через плаценту антибиотиков, относящихся к разным группам, в целом этот процесс имеет общие закономерности. Абсолютное количество антибиотика, переходящее к плоду, пропорционально его концентрации в крови матери. Наи-высшего уровня в крови плода антибиотики достигают через 30–60 мин после создания максимальной концентрации в крови матери, затем их уровень снижается по экспоненте.
Для антибиотиков с низкой степенью связывания протеинами крови величина отношения максимальной концентрации в сыворотке крови плода и матери находится в пределах 0,3–0,9 (ампициллин, карбенициллин, клиндамицин, аминогликозиды), в то время как для антибиотиков с высокой степенью связывания белками крови (оксациллин, диклоксациллин и др.) переход через плаценту ограничен и величина соотношения их содержания в крови плода и матери значительно ниже (0,1 и менее). Из этого следует, что последние теоретически более пригодны для лечения заболеваний матери. Препараты с низкой степенью связывания белками крови, т.е. хорошо проникающие через плаценту, целесообразнее использовать при внутриутробной инфекции плода.
Распределение препаратов в плодовой части плаценты, в крови и в органах плода определяется фетальной гемодинамикой. Так как характер гемоциркуляции у плода в различные сроки беременности изменяется, существенно меняется и распределение различных антимикробных препаратов.
Антибиотики, прошедшие через плацентарный барьер, отчасти подвергаются метаболическим превращениям в органах и тканях плода. Печень плода обладает некоторыми метаболическими способностями взрослого органа и в небольшой степени способна инактивировать препараты. Преобладающая часть препарата выводится из организма плода почками. Вследствие незрелости систем элиминации это осуществляется значительно медленнее, чем из организма матери. В результате антибактериальные препараты могут накапливаться в тканях; при этом их уровень в сыворотке крови и тканях плода увеличивается при повторном введении антибиотиков матери. Такая возможность особенно велика, если интервалы между введениями непродолжительны для самостоятельного освобождения плода от активного препарата. Если уровень антибиотика в крови и тканях плода превышает его содержание в крови матери, возможна обратная диффузия, в результате чего устанавливается определенное равновесие между содержанием антибактериального препарата в организме матери и плода.
Слишком высокие дозы, вводимые матери, могут привести к созданию токсического уровня антибиотиков у плода, что особенно опасно для препаратов с малым диапазоном между токсическим и терапевтическим действием. Имеются заметные различия между связыванием одного и того же препарата протеинами крови плода и матери. Количество антибактериального препарата, связывающееся протеинами крови плода, существенно ниже, чем у матери. Это также может способствовать усилению токсического действия антибиотиков на плод вследствие более полного проникновения в его органы и ткани части препарата, не связанной белком. Было бы весьма желательно (хотя это крайне трудно осуществить на практике) во избежание токсического влияния антибиотиков на плод проводить мониторный контроль за уровнем препаратов в крови беременной женщины.
Содержание антибактериальных веществ в амниотической жидкости при введении их матери характеризуется рядом особенностей. Практически все антибиотики проникают в амниотическую жидкость, однако их накопление там происходит значительно медленнее и в меньшем количестве, чем в крови плода. Концентрация лекарственных препаратов в амниотической жидкости в начале беременности ниже, чем к моменту родов, когда их содержание может превышать уровень в крови плода. Это объясняется тем, что в поздние сроки беременности начинает функционировать выделительная система плода, и антибиотики попадают в амниотическую жидкость с мочой. Было показано, что через 6–8 ч после введения ампициллина и гентамицина женщинам в III триместре беременности их концентрация в амниотической жидкости превышает уровень в сыворотке крови матери. При этом однократное введение большой дозы создает в околоплодных водах более высокую концентрацию, чем продолжительная инфузия.
Ряд органов и систем плода, особенно желудочно-кишечный тракт, непосредственно сообщаются с амниотической полостью и наполняющей ее жидкостью, поэтому присутствующие в ней лекарственные вещества могут попадать обратно к плоду. Особенности циркуляции антибиотиков в амниотической жидкости следует учитывать при лечении хориоамнионита: только при живом плоде в амниотической жидкости создаются терапевтические концентрации препарата за счет выделения его в амниотическую полость с мочой плода.
Не исключается возможность параплацентарного перехода антибио-тика к плоду, о чем свидетельствует наблюдавшееся в ряде случаев накопление антибиотиков в околоплодных водах в ранние сроки беременности, когда плацента обладает выраженными барьерными свойствами. Так, степень перехода цефтазидима в кровь плода во II триместре беременности была почти одинаковой со степенью его перехода в амниотическую жидкость в конце беременности (19,1 и 14,6 %). Как известно, почки плода во II триместре еще не обладают функциональной зрелостью, в связи с чем относительно высокую концентрацию антибиотика в амниотической жидкости можно объяснить только его параплацентарным поступлением через плодные оболочки.
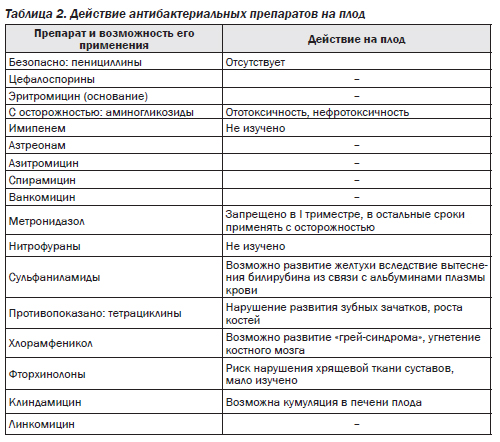
Действие антибиотиков на плод. При лечении беременных женщин антибиотиками возникает проблема, связанная с возможностью их неблагоприятного воздействия на плод (табл. 2).
Различают прямое и опосредованное действие антибактериальных препаратов на плод. Выделяют следующие виды повреждения плода: тератогенный эффект (развитие аномалий плода), эмбриолетальный эффект (до и постимплантационная гибель плода), эмбрио- и фетотоксический эффект (морфофункциональные нарушения отдельных клеточных систем эмбриона и плода). Реакция эмбриона и плода на воздействие фармакологических препаратов, в том числе и антибиотиков, определяется скоростью и степенью их трансплацентарного перехода, стадией эмбриогенеза в момент введения препарата, его химической структурой, а также особенностями метаболизма матери, плода и плаценты.
Антибиотики группы пенициллина. Несмотря на широкое применение пенициллина во время беременности исследования его фармакокинетики в этот период немногочисленны. Как показали A. Heikkila и R. Erkkoea (1994), при однократном введении 600 мг феноксипенициллина группе беременных и небеременных женщин, у первых период полужизни препарата был короче, объем распределения меньше, почечный и плазменный клиренс выше. Уровень антибиотика в плазме был ниже, что можно объяснить увеличением объема плазмы и жидкостей тела во время беременности.
Сравнительные исследования фармакокинетики ампициллина у беременных женщин с инфекцией нижних отделов мочевых путей и у тех же женщин вне беременности свидетельствуют о том, что уровень антибиотика во время беременности в сыворотке крови ниже на 50 %. Объем распределения препарата и почечный клиренс, напротив, у беременных женщин выше, чем вне беременности. Аналогичные закономерности наблюдаются и в отношении новых пенициллинов.
Фармакокинетика пиперациллина была изучена у 8 беременных, получавших
Таким образом, концентрация практически всех антибиотиков группы пенициллина в организме беременных женщин ниже, чем вне беременности. Чтобы достичь эффективной концентрации у беременных женщин, антибиотики группы пенициллина следует вводить в дозе не ниже среднетерапевтической.
Цефалоспорины. Во время беременности отмечается уменьшение их уровня в крови и тканях. При введении
Аминогликозиды. Фармакокинетика аминогликозидов во время беременности изучена недостаточно в связи с их ограниченным применением в гестационном периоде. Имеющиеся немногочисленные исследования свидетельствуют о том, что уровень гентамицина, канамицина, амикацина и тобрамицина в сыворотке крови беременных женщин существенно ниже, чем вне беременности и у мужчин. В то же время величина периода полувыведения для гентамицина заметно не изменяется, для амикацина и тобрамицина — становится короче у беременных.
Линкозамиды. После однократного введения клиндамицина во время кесарева сечения и во время аборта его уровень в сыворотке крови такой же, как и у небеременных женщин, в то время как период полувыведения оказывается короче.
Макролиды. У беременных женщин отмечено снижение уровня эритромицина в сыворотке крови.
Переход антибиотиков через плацентарный барьер
Изучение перехода антибиотиков от матери к плоду, определение их содержания в плаценте, органах плода и околоплодной жидкости необходимы для оценки потенциальной токсичности этих препаратов, возможности их лечебного использования во время беременности.
Основной путь — простая диффузия через плаценту. Она осуществляется вследствие разницы концентрации препарата в сыворотке крови матери и плода и определяется теми же факторами, которые регулируют диффузию лекарственных веществ через другие биологические мембраны. К ним относятся физиологические характеристики системы «мать — плацента — плод» и физико-химические свойства препаратов. Среди физиологических факторов имеют значение гемодинамические изменения в организме матери и плода, толщина и степень зрелости плаценты, уровень метаболической активности плацентарной ткани.
Скорость диффузии через плацентарный барьер прямо пропорциональна градиенту концентрации вещества в системе «мать — плод», величине поверхности плаценты и обратно пропорциональна ее толщине. Трансплацентарно лучше диффундируют препараты с низкой молекулярной массой (при ее значении более 1000 ограничивается переход лекарственных веществ), хорошо растворимые в липидах, с низкой степенью ионизации. Большое значение имеет степень связывания препарата белками крови, так как диффундирует только свободная (несвязанная) часть препарата. Поэтому антибиотики, мало связывающиеся белками крови, например, ампициллин (20 % связывания), проходят через плаценту лучше, чем препараты с высокой степенью связывания, например, диклоксациллин (90 % связывания).
На степень диффузии антибиотиков через плаценту оказывает влияние срок беременности. Это обусловлено прогрессивным увеличением числа вновь образуемых ворсин хориона, увеличением поверхности плацентарной мембраны, усилением кровообращения по обе ее стороны, изменением ее толщины. В начале беременности плацентарная мембрана имеет относительно большую толщину, которая по мере развития беременности постепенно уменьшается. В последнем триместре отмечается выраженное уменьшение эпителиального слоя трофобласта.
Существенную роль играет также интенсивность материнского кровотока. Как известно, во время беременности кровоток в матке значительно возрастает. Общая площадь поперечного сечения спиральных артерий увеличивается в 30 раз. Перфузионное давление, обеспечивающее обмен в межворсинчатом пространстве, с увеличением срока беременности возрастает, что способствует лучшему трансплацентарному переходу лекарственных веществ, особенно к концу беременности.
Зависимость степени диффузии через плаценту от срока беременности отмечается для антибиотиков практически всех групп. Антибиотики группы цефалоспоринов (цефазолин, цефотаксим и др.) в значительно больших количествах переходят к плоду в III триместре беременности, чем в I и во II. Исследования, проведенные в эксперименте на белых крысах в ранние и поздние сроки беременности и в разные триместры беременности у женщин, показали, что с увеличением гестационного срока степень перехода цефтазидима (цефалоспоринового антибиотика третьего поколения) к плоду увеличивается. Такие же данные получены для пенициллинов, аминогликозидов, макролидов. Изучение действия антибиотиков на плод, проведенное на эмбрионах, культивируемых in vitro, а также в условиях целостного организма, показали, что они не обладают тератогенным действием. Вместе с тем некоторые антибиотики могут оказывать эмбриотоксическое действие, осуществляющееся прямым и косвенным путем. Так, аминогликозиды повреждают VIII пару черепно-мозговых нервов, что влечет за собой нарушение развития органа слуха: они могут также оказывать нефротоксическое действие. Тетрациклины откладываются в костной ткани, нарушают развитие зубной ткани и рост плода; левомицетин может вызвать
апластическую анемию и так называемый «грей-синдром» (цианоз, желудочно-кишечные расстройства, рвота, нарушение дыхания, гипотермия, острые поражения легких). Косвенным путем антибиотики могут оказывать эмбрио-токсическое действие за счет уменьшения кислородонесущей способности крови матери, индукции гипо- и гипергликемии, уменьшения проницаемости плаценты для витаминов и других питательных веществ, а также в результате нарушений, приводящих к гипотрофии плода и замедлению его развития.
Чувствительность плода к антибактериальным препаратам различна в разные стадии эмбриогенеза. Во время беременности имеются 5 принципиально важных периодов, определяющих чувствительность эмбриона, плода и новорожденного к антибактериальным препаратам: 1-й — до оплодотворения или в период имплантации; 2-й — пост-имплантационный период или период органогенеза, соответствующий первому триместру беременности; 3-й период развития плода, соответствующий второму и третьему триместрам беременности; 4-й период — роды; 5-й — послеродовой период и кормление грудью.
Плод наиболее чувствителен к антибиотикам в постимплантационном периоде, т.е. в I триместре беременности, когда начинается дифференциация эмбриона. Во II и III триместрах риск повреждения меньше, так как на этой стадии развития большинство органов и систем плода уже дифференцировано и менее подвержено повреждающему воздействию лекарственных веществ. Было показано, что эмбрионы предымплантационного периода развития оказались менее чувствительными к действию антибиотиков по сравнению с эмбрионами периода органогенеза и плацентации. Под влиянием тетрациклина и фузидина в этот период отмечалось повышение показателей постимплантационной гибели, возникновение гипотрофии плода, недоразвитие плаценты.
Лекарственные вещества по степени их токсического действия на плод разделены на 5 категорий (категории риска применения лекарств при беременности разработаны Американской администрацией по контролю за лекарствами и пищевыми продуктами — FDA):
По этой классификации все антибиотики группы пенициллина, цефалоспорины, эритромицин, азитромицин, метронидазол, меропенем, нитрофураны, а также противогрибковые препараты (нистатин, амфотерицин В) относятся к категории В, тобрамицин, амикацин, канамицин, стрептомицин — к категории D. Известно, что аминогликозиды могут оказывать ото- и нефротоксическое действие на плод. При использовании гентамицина и амикацина этот эффект встречается редко (только при длительном применении больших доз препаратов).
Хлорамфеникол относится к категории С, так же как триметаприм, ванкомицин и фторхинолоны. Из антимикотических препаратов к этой же категории принадлежит гризеофульвин. Тетрациклин относится к категории D.
Для рационального использования антибактериальных препаратов во время беременности с учетом побочного действия на мать, плод и новорожденного антибиотики разделены на 3 группы. Группа I включает антибиотики, применение которых во время беременности противопоказано. В нее входят хлорамфеникол, тетрациклин, триметаприм, т.е. вещества, оказывающие эмбриотоксическое действие. В эту же группу включены фторхинолоны, у которых в эксперименте обнаружено действие на хрящевую ткань суставов. Однако действие их на плод человека мало изучено. К группе II относятся антибиотики, которые во время беременности следует применять с осторожностью: аминогликозиды, сульфаниламиды (могущие вызвать желтуху), нитрофураны (способные вызвать гемолиз), а также ряд антибактериальных препаратов, действие которых на плод недостаточно изучено. Препараты этой группы назначают беременным только по строгим показаниям при тяжелых заболеваниях, возбудители которых устойчивы к другим антибиотикам, или в случаях, когда проводимое лечение неэффективно. В группу III входят препараты, не оказывающие эмбриотоксического действия, — пенициллины, цефалоспорины, эритромицин (основание). Эти антибиотики можно считать препаратами выбора при лечении инфекционной патологии у беременных.
Ниже приведены данные относительно перехода через плаценту и действия на плод антибиотиков, наиболее широко используемых в акушерской практике.
Пенициллины
Степень перехода через плаценту от матери к плоду препаратов этой группы определяется уровнем связывания белками крови. Бензилпенициллин, ампициллин, метициллин мало связываются белками крови; они обнаруживаются в крови и тканях плода в более высокой концентрации, чем оксациллин и диклоксациллин, обладающие высокой степенью связывания.
При переходе бензилпенициллина через плаценту его концентрация составляет от 10 до 50 % от уровня в материнской крови. Из крови плода препарат достаточно быстро проникает в его органы и ткани. Терапевтическая концентрация антибиотика обнаруживается в печени, легких и почках плода. В конце беременности степень перехода бензилпенициллина через плаценту повышается.
Максимальное содержание ампициллина в сыворотке крови плода определяется через 2 ч после внутримышечного введения и составляет 20 % концентрации в крови матери. Его количество в околоплодных водах нарастает медленнее, чем в крови матери и плода, но удерживается более длительный срок в терапевтически активной концентрации. Препараты группы пенициллина не обладают тератогенным и эмбриотоксическим действием. Возможно аллергическое воздействие на плод.
В настоящее время представляет интерес переход через плаценту так называемых защищенных пенициллинов — комбинации пенициллинов с клавулановой кислотой и сульбактамом, наиболее часто применяющихся для лечения воспалительных процессов. Действие этих комбинаций на плод изучено еще недостаточно. Известно, что ампициллин/сульбактам быстро проникает через плаценту в невысоких концентрациях. При применении этого антибиотика отмечено снижение уровня эстриола в плазме крови и выделение его с мочой. Определение эстриола в моче используется в качестве теста и при оценке состояния фетоплацентарной системы. Снижение его уровня может являться признаком развития ди-стресс-синдрома.
Амоксициллин/клавулановая кислота, также как сам амоксициллин, хорошо проникает через плаценту и создает в тканях плода высокие концентрации. Данные о повреждающих действиях этого антибиотика и его комбинации с клавулановой кислотой отсутствуют. Однако в связи с недостаточной изученностью этого вопроса, отсутствием контролируемых исследований применение защищенных пенициллинов в I триместре беременности не рекомендуется, во II и III триместрах применять их следует с осторожностью.
Пиперациллин также легко проходит через плаценту: через 30 мин после введения антибиотика матери он определяется в тканях плода в терапевтически активной концентрации. Антибиотик проходит и в амнио-тическую жидкость, где его уровень достигает минимально подавляющей концентрации. Карбапенемы (имипенем, меропенем) обладают способностью накапливаться в амниотической жидкости, и их концентрация в ней выше таковой в сыворотке крови матери на 47 %. Эту особенность следует учитывать при повторном введении антибиотиков.
Цефалоспорины
Антибиотики этой группы также хорошо переходят через плацентарный барьер. Степень трансплацентарного перехода цефалоспоринов в значительной мере определяется сроком беременности: в первые месяцы она невысока и возрастает к концу беременности. Эта закономерность относится к цефалоспоринам разных поколений. Так, сравнение кинетики цефрадина в I и III триместрах беременности после внутривенной инфузии
При введении беременным женщинам терапевтических доз цефалоспоринов в крови плода, в околоплодных водах создается концентрация препаратов, которая выше минимально подавляющей для возбудителей внутриутробной инфекции. Экспериментальные и клинические данные свидетельствуют об отсутствии тератогенных и эмбриотоксических свойств у цефалоспоринов первого и второго, а также у некоторых препаратов третьего поколения.
Аминогликозиды
Переход аминогликозидов через плаценту и их действие на плод изучены недостаточно в связи с ограниченным применением этих препаратов при беременности из-за возможного токсического действия. Немногочисленные исследования свидетельствуют о хорошем проникновении антибиотиков этой группы через плацентарный барьер; после их введения беременной женщине концентрация в пуповинной крови достигает 30–50 % от уровня в крови матери. В плаценте аминогликозиды также накапливаются в значительном количестве, приближающемся к уровню в пуповинной крови. Гентамицин проникает через плаценту в средних концентрациях. В амнио-тической жидкости он появляется позже, чем в пуповинной крови, однако и в крови плода, и в околоплодных водах уровень антибиотика при введении матери терапевтических доз превышает его минимальную подавляющую концентрацию для ряда возбудителей инфекций. Его применение во время беременности не рекомендуется из-за риска ототоксичности. Нетилмицин отличается от других антибиотиков группы аминогликозидов большей степенью клинической безопасности, более высоким терапевтическим индексом. Он проникает через плаценту в высоких концентрациях и создает терапевтически активные концентрации в пуповинной крови и амниотической жидкости. Однако его безопасность при беременности изучена недостаточно, поэтому рекомендуется его применение с осторожностью только в случае крайней необходимости, так же как и других аминогликозидов.
Из других антибиотиков группы аминогликозидов относительно хорошо изучен трансплацентарный переход канамицина; концентрация антибиотика в крови плода после его внутримышечного введения составляет 50–70 % от уровня в крови матери. Содержание канамицина в органах плода несколько ниже — 30–50 %, в околоплодную жидкость он проникает в ограниченных количествах.
Существенное влияние на переход аминогликозидов через плаценту оказывает срок беременности. Отмечено уменьшение проницаемости плаценты для гентамицина в поздние сроки беременности. Возможно, это связано с более низкой концентрацией антибиотика в крови матери именно в этот период. Переход других аминогликозидов по мере увеличения срока беременности возрастает. Исследования, проведенные на животных, а также данные, полученные в клинике, свидетельствуют об отсутствии тератогенного влияния антибиотиков этой группы.
Введение стрептомицина и дигидрострептомицина беременным женщинам может вызвать у новорожденных детей ототоксический эффект. Другие аминогликозиды редко обусловливают поражение слухового нерва. Тем не менее эти препараты во время беременности применять не следует. Исключение составляют тяжело протекающие инфекционные процессы при отсутствии альтернативного метода лечения; в подобной ситуации их назначают короткими курсами или однократно суточную дозу.
Хлорамфеникол
Быстро переходит через плацентарный барьер, концентрация антибиотика в крови плода достигает 30–70 % от уровня в крови матери. Хлорамфеникол запрещено применять во время беременности из-за его способности вызывать тяжелые осложнения у матери и токсические поражения у плода. У новорожденных, родившихся у женщин, леченных во время беременности этим препаратом, может развиться так называемый «грей-синдром». Синдром обусловлен неспособностью печени и почек новорожденного к метаболизму и выведению антибиотика. Летальность при нем достигает 40 %.
Тетрациклины
Тетрациклины свободно переходят через плацентарный барьер, их концентрация в крови плода колеблется в пределах 25–75 % от уровня в крови матери. Концентрация антибиотика в амниотической жидкости не превышает 20–30 % от уровня в крови плода. Препараты группы тетрациклина оказывают выраженное эмбриотоксическое действие, проявляющееся в нарушении развития скелета плода и зубной ткани. Механизм действия тетрациклина на плод связан с его интерференцией с синтезом протеинов, взаимодействием с кальцием и другими катионами, принимающими участие в процессе минерализации костей скелета. Возможной точкой приложения влияния тетрациклина являются митохондрии клеток, участ-вующих в этих процессах. Действие тетрациклина на рост скелета начинает проявляться во II триместре беременности, когда возникают центры окостенения. В связи с выраженной эмбриотоксичностью тетрациклины во время беременности применять не рекомендуется.
Макролиды
Антибиотики этой группы проходят через плацентарный барьер, но уровень их в фетальной крови невысок, так же как в амниотической жидкости. Неблагоприятного действия на мать и плод макролиды не оказывают. Препараты рекомендуется применять во время беременности (при аллергии к пенициллинам и цефалоспоринам) для лечения гнойно-воспалительных процессов.
Что касается эритромицина, то данные об увеличении частоты врожденных аномалий развития плода после его приема отсутствуют. Антибиотик проникает через плаценту в низких концентрациях. Во время беременности противопоказано применение эритромицина-эстолата.
Для лечения хламидийной инфекции широко используется азитромицин. Длительное время его не рекомендовали применять во время беременности из-за отсутствия данных о влиянии антибиотика на плод. В последнее время появились исследования, свидетельствующие об отсутствии неблагоприятного действия. Получены также данные о возможности применения его для лечения хламидийной инфекции у беременных.
Действие других макролидов на плод (кларитромицина, спирамицина, рокситромицина, джозамицина) практически не изучено, вследствие чего их применение во время беременности не рекомендуется.
Из гликопептидов ванкомицин проникает через плаценту в сравнительно высоких концентрациях. Имеются сообщения о нарушении слуха у новорожденных при лечении матери ванкомицином. В I триместре беременности применение этого антибиотика запрещено, во II и III триместрах применять его следует с осторожностью (по жизненным показаниям).
Метронидазол. Препарат быстро проходит через плаценту и создает в крови плода концентрации, приближающиеся к уровню в крови матери. В амниотической жидкости его содержание также сравнительно высокое (50–75 % от уровня в крови плода). Сообщения о неблагоприятном влиянии метронидазола на плод отсутствуют, однако в связи с имеющимися данными о канцерогенном действии на грызунов и мутагенном — на бактерии, акушеры воздерживаются применять препарат внутрь и парентерально во время беременности (особенно в I триместре).
Клиндамицин и линкомицин хорошо проникают через плаценту к плоду при введении их женщинам как в первую половину беременности, так и в конце ее. При этом в органах плода — печени, почках, легких создается концентрация препарата более высокая, чем в фетальной крови. Однако информация о действии препаратов на плод недостаточная, вследствие чего во время беременности их используют с осторожностью.
Сульфаниламиды также легко проникают через плаценту, проходят в кровь и ткани плода, в амниотическую жидкость. Прямого токсического действия препаратов этой группы на плод не установлено. Однако сульфаниламиды конкурируют с билирубином за место связи с белками, вследствие чего уровень свободного билирубина в сыворотке крови новорожденного может повышаться, в связи с чем увеличивается риск развития желтухи.
Фторхинолоны проникают через плаценту в высоких концентрациях. Не обладают ни тератогенным, ни эмбриотоксическим действием. Не обнаружено также их мутагенного действия. Имеются экспериментальные данные об отрицательном влиянии фторхинолонов на рост и развитие хрящевой ткани у неполовозрелых животных. Подобного действия на хрящевую ткань у людей не отмечено, тем не менее вследствие недостаточного изучения влияния фторхинолонов на плод применение этих препаратов во время беременности и кормления грудью не рекомендуется.
Выделение антибактериальных препаратов с женским молоком
При выделении антибиотиков с женским молоком они попадают в организм ребенка и могут оказывать на него неблагоприятное действие, которое, в свою очередь, проявляется в виде токсических и аллергических реакций. Весьма существенные изменения может претерпевать нормальная микрофлора организма.
Неблагоприятному воздействию антибиотиков, попавших в организм новорожденного с молоком матери, способствует незрелость печени и почек, свойственная этому периоду развития. У новорожденных отмечается замедленное всасывание препаратов из желудочно-кишечного тракта, более низкий метаболизм по сравнению со взрослым организмом, главным образом за счет снижения метаболической активности печени, более медленное выведение препаратов почками.
Низкое связывание антибиотиков белками сыворотки крови, отмечающееся у новорожденных по сравнению с кровью взрослых, приводит к более полной диффузии их из крови в ткани, где создается высокий уровень препаратов. Указанные особенности циркуляции антибиотиков у новорожденных приводят к более длительному их пребыванию в организме, обусловливают кумуляцию препаратов и таким образом повышают возможность вредного воздействия на организм ребенка.
Практически все антибактериальные препараты, вводимые лактирующей женщине, проникают в молоко. Однако степень их перехода существенно отличается для препаратов разных групп. Одни антибиотики легко проникают в молоко и создают в нем сравнительно высокий уровень, другие переходят в молоко в малых количествах и не представляют реальной опасности для ребенка. Антибиотики попадают в молоко преимущественно путем диффузии, определяющейся такими же факторами, что и диффузия через плацентарный барьер и другие биологические мембраны. На степень диффузии в молоко влияют молекулярная масса препарата, степень ионизации, связывание белками крови, растворимость в липидах. По сравнению с плазмой крови молоко имеет более низкий рН (7,4 и 6,8 соответственно), вследствие чего препараты с кислотными характеристиками проходят в молоко труднее, чем со щелочными. Для оценки степени диффузии лекарственных веществ в молоко предложен индекс М/П, представляющий собой соотношение концентрации препарата в молоке и плазме крови. Величина индекса меньше 1 свидетельствует о низкой степени перехода вещества в молоко, индекс больше 1 характеризует высокую степень перехода.
Ниже приведены сведения о переходе в грудное молоко антибактериальных препаратов, наиболее часто используемых при лечении послеродовых инфекций.
Пенициллины
Антибиотики этой группы в ограниченном количестве переходят в молоко при введении кормящим родильницам. Бензилпенициллин содержится в грудном молоке в концентрации в 20–30 раз меньшей по сравнению с уровнем его в сыворотке крови при введении женщинам терапевтических доз. Такая же закономерность отмечается и для полусинтетических пенициллинов. Максимальная концентрация метициллина в молоке здоровых родильниц составляет 0,45 мкг/мл, что в 12–13 раз ниже максимальной концентрации в сыворотке крови. Содержание оксациллина в молоке в 19 раз ниже, чем в крови. При воспалительном процессе молочной железы переход этих антибиотиков в молоко уменьшается. При этом оксациллин переходит в грудное молоко больных в большем количестве, чем метициллин, что свидетельствует о более высокой способности этого антибиотика проникать в очаг воспаления.
Сравнительно низкая степень перехода в молоко характерна и для пенициллинов широкого спектра действия (ампициллин, амоксициллин, пиперациллин и др). Низкая экскреция пенициллинов с молоком связана с высокой степенью их связывания белками плазмы крови (кроме ампициллина) и интенсивным выведением почками. Индекс М/П для пенициллинов существенно меньше 1.
Цефалоспорины
Ряд данных свидетельствует об ограниченном переходе в молоко цефалоспориновых антибиотиков. Так, максимальная концентрация цефуроксима в молоке здоровых родильниц наблюдается через 1 ч после его введения и составляет 2,6 % от максимального уровня в крови. При воспалительном процессе в молочной железе отмечается увеличение перехода антибиотика в молоко по сравнению со здоровыми родильницами.
Цефрадин также проникает в материнское молоко в незначительном количестве. Воспалительный процесс в грудной железе увеличивает прохождение антибиотика в молоко, однако его количество не превышает 0,5–0,6 мкг/мл. Имеются сведения о плохом выделении с молоком цефалоспоринов второго и третьего поколений. Так, при внутривенном введении цефотаксима концентрация его в молоке была минимальна: концентрационный градиент составлял всего 0,035.
Таким образом, цефалоспориновые антибиотики, как и пенициллины, плохо проникают в молоко. Соотношения М/П для этих препаратов ниже 1. Однако их максимальная концентрация в молоке несколько выше, чем для пенициллинов.
Макролиды
Проникают в грудное молоко в сравнительно высоких концентрациях, достигая в среднем 50% от уровня в крови матери. Наиболее низкие концентрации отмечаются при введении эритромицина. Такие антибиотики, как кларитромицин, спирамицин создают в молоке высокие концентрации. Что касается азитромицина, то до настоящего времени нет достоверных данных о его уровне в грудном молоке. Отрицательного влияния на ребенка, получающего молоко матери, леченной макролидами, не отмечается. Поэтому при необходимости эти препараты могут быть использованы для лечения женщины во время лактации.
Аминогликозиды
Большинство антибиотиков этой группы проникает в грудное молоко в низких концентрациях. Однако адекватных и строго контролируемых исследований не проводилось, так как аминогликозиды не рекомендуется применять во время беременности и лактации из-за их ото- и нефротокcичности. Известно, что максимальная концентрация гентамицина составляет 30 % от его уровня в крови матери и создается через 1 ч после введения антибиотика. Амикацин, тобрамицин, канамицин, стрептомицин проникают в молоко в низких концентрациях. Возможен ототоксический эффект и влияние на микрофлору кишечника новорожденных.
Тетрациклины
Тетрациклины (доксициклин, тетрациклин) хорошо проникают в грудное молоко. Их уровень составляет 50–70 % от уровня в крови матери. Индекс проницаемости составляет 1,2–1,6. Тетрациклины вызывают нарушение развития зубных зачатков, роста костей, образуя комплексные соединения с кальцием. Вследствие этого тетрациклины при грудном вскармливании применять не рекомендуется.
Клиндамицин, линкомицин
Клиндамицин обнаруживается в молоке в сравнительно небольшой концентрации. Применять его в период лактации не рекомендуется из-за возможности развития псевдомембранозного колита. Линкомицин проникает в молоко в большом количестве: его концентрация составляет 50–90 % от уровня в крови матери. Применение препарата во время лактации запрещено из-за возможности изменения кишечной микрофлоры ребенка и его сенсибилизации.
Фторхинолоны
Известно, что все фторхинолоны проникают в грудное молоко. Наиболее высокие концентрации отмечены у ципрофлоксацина. Но адекватных и строго контролируемых исследований не проводилось. Применять препараты этой группы во время лактации не рекомендуется из-за высокого риска артротоксичности.
Сведений о проникновении в молоко других антибиотиков недостаточно и они часто противоречивы.
Подготовила Наталия Куприненко
