Газета «Новости медицины и фармации» Антимикробная и противовирусная терапия (310) 2010 (тематический номер)
Вернуться к номеру
Клиническая эффективность цефподоксима при лечении внебольничных пневмоний у часто болеющих детей раннего возраста
Авторы: А.Е. Абатуров, О.Н. Герасименко, И.Л. Высочина, Т.П. Квитницкая. Днепропетровская государственная медицинская академия
Версия для печати
В настоящее время наблюдается переход от традиционного представления о бактериях как строго одноклеточных организмах к представлению о микробных сообществах как целостных структурах, регулирующих свои поведенческие реакции в зависимости от изменения условий обитания. В современной микробиологии намечается постепенный переход к биосоциальному («биополитическому») мировоззренческому подходу к пониманию жизни микроорганизмов. Колонии практически всех видов бактерий демонстрируют способность к клеточной дифференцировке и многоклеточной организации. Эта способность наиболее очевидно проявляется при росте бактерий в их природных местах обитания, где они формируют различные многоклеточные структуры: биопленки, бактериальные маты, плодовые тела и др. [1, 2, 8, 9, 16].
Бактерии в колонии находятся в тесной клеточно-клеточной коммуникации. Показано, что грамположительные и грамотрицательные бактерии колонии биопленки, взаимодействуя с раздражителем, продуцируют сигнальные и «сенсинговые» молекулы, которые регулируют деятельность колонии. Одна из форм клеточно-клеточной коммуникации бактериальных колоний получила название Quorum Sensing. Понятие «ощущение кворума» (Quorum Sensing) было предложено в 1994 году. Оно означает восприятие клетками изменений среды, которые наступают при достижении бактериальной культурой некоторой пороговой численности, и реакцию на эти изменения. Quorum Sensing идентифицирован в колониях грамположительных бактерий (Str.pneumoniae, Bacillus subtilis, St.aureus), грамотрицательных бактерий (V.fischeri, P.aeruginosa, Agrobacterium tumefaciens, Erwinia carotovora). Бактерии продуцируют химические субстанции, получившие название «аутоиндукторы». С увеличением плотности колонии увеличивается и концентрация аутоиндукторов. Достигнув определенной концентрации, аутоиндукторы связываются с их рецепторами на поверхности мембран соседних бактерий (достижение кворума), активируют внутрибактериальные сигнальные пути, под действием которых меняется экспрессия определенных генов. Вызванные аутоиндукторами изменения транскрипционной активности генов обусловливают усиление защитной биолюминесценции, вирулентности, продукции бактерицидных пептидов и формирование биопленки [5, 6]. В последнее время установлено, что около 65 % бактериальных инфекций, поражающих человека, могут организовывать биопленку. Биопленка — это функционально координированная, связанная с поверхностью объекта в защитной полисахаридной оболочке колония ассоциированных между собой бактерий с синхронизированной генной экспрессией. В пределах одной биопленки могут сосуществовать грамположительные и грамотрицательные бактерии и грибы. Бактерии в биопленках отделены от свободно плавающих планктонных форм внеклеточной полимерной субстанцией и характеризуются более медленным темпом роста, сниженным регулированием определенных генов и высоким уровнем обмена плазмид [16, 19]. Экспериментально показано, что начальные элементы биопленки могут сформироваться в течение 2 часов инкубации, достигая максимальной интенсивности уже через 24 часа [7]. Бактерии биопленки более устойчивы к действию антибиотиков, чем планктонные бактерии, в связи с защитной функцией пленки, пространственно разобщающей бактерии и антибиотики и создающей благоприятную среду в пределах пленки. В результате бактерии в биопленках остаются в живых при концентрациях антибиотиков, которые в 1000 раз выше смертельных концентраций для планктонных бактерий. Были предложены три механизма, объясняющие резистентность бактериальных колоний биопленок к действию антибактериальных препаратов: снижение уровня проникновения антибактериального препарата в бактерии, медленный рост бактерий, индукция биопленочного фенотипа [17]. Представлены доказательства о значении развития биопленок при муковисцидозе [15], хронических неспецифических заболеваниях органов дыхания у взрослых. По мнению А. Гинцбург (2006), очаги биопленок появляются при всех рецидивирующих инфекционно-воспалительных заболеваниях, в частности бронхолегочных. Когда биопленки достигают определенного размера, от них начинают отрываться части, которые разносятся с кровотоком или через пищеварительный тракт по организму. Происходит образование новых очагов биопленки, что является аналогом метастазирования злокачественных клеток.
В последние годы отмечается неуклонная тенденция распространения пенициллинрезистентных штаммов Str.pneumoniae, устойчивых к аминопенициллинам, цефалоспоринам I–II поколений и макролидам, в то же время показано влияние на жизнедеятельность бактерий биопленок цефалоспоринов III поколения — цефподоксима, цефамандола в сочетании с дисперсином B.
Цефподоксима проксетил — перор-альный цефалоспорин III поколения, который обладает высокой антибактериальной активностью против широкого диапазона грамположительных и грамотрицательных бактерий. Цефподоксим показал хорошую антибактериальную активность против Str.pneumoniae, Haemophilus influenzae, метициллин-чувствительного Staphylococcus spp., Str.pyogenes, Str.agalactiae, Moraxella catarrhalis, Enterobacteriaceae и др. [13]. Проведенные в Испании в 2007 году исследования показали, что штаммы Str.pneumoniae, чувствительные к действию пенициллина, чувствительны к цефподоксиму в 99,5 % случаев [14]. По данным Z.Y. Sun и соавт. [11], чувствительность Str.pneumoniae к I (цефалексину), II (цефаклору) и III (цефподоксиму) поколению цефалоспоринов соответственно составляет 6,0; 45,1 и 88,7 %. При сравнительном анализе антибактериальной активности наиболее часто назначаемых пероральных цефалоспоринов (цефаклора, цефдинира, цефподоксима, цефпрозила, цефуроксима аксетила, цефалексина) и амоксициллина/клавуланата было показано, что цефподоксим по активности против H.Influenzae превосходит другие средства [10, 18].
В стандартном режиме цефподоксим не уступает амоксициллину с клавулановой кислотой, цефиксиму, цефуроксиму аксетилу, цефаклору или превосходит их при лечении детей с бактериальными инфекциями респираторного тракта [12]. Так, по данным 1090 исследований 22 бактериальных штаммов 15 различных медицинских учреждений Японии, проведенных T. Abe и соавт. [4] с июня 2000 по март
Цель работы. Бактериальные процессы органов дыхания у часто болеющих детей, механизмы защиты респираторного тракта которых характеризуются недостаточной активностью дефензинов, коллектинов, эфалина, лизоцима, лактоферрина, калпротектина, лактопероксидазы и других факторов, предупреждающих взаимодействие бактерий, протекают с возникновением биопленки. Учитывая спектр антибактериального действия и влияние на биопленки, целью нашей работы явилось изучение эффективности цефподоксима проксетила при внегоспитальных пневмониях у часто болеющих детей раннего возраста.
Задачи исследования: изучить клиническую эффективность применения перорального цефалоспорина III поколения цефподоксима проксетила (препарат Цефодокс, представленный в Украине компанией «Мегаком») в качестве стартового антибиотика при лечении внебольничных пневмоний у часто болеющих детей раннего возраста. Цефодокс содержит неактивное соединение (пролекарство), которое всасывается из желудочно-кишечного тракта и превращается в свой активный метаболит — цефподоксим. Формы выпуска: суспензия 50 мл со вкусом лимона, содержащая в 5 мл 50 мг (100 мг) цефподоксима проксетила; таблетки, покрытые пленочной оболочкой, содержащие цефподоксима проксетила 100 мг (200 мг), в одной упаковке 10 таблеток.
Материалы и методы исследования
Под нашим наблюдением находилось 17 часто болеющих детей раннего возраста с неосложненной формой внегоспитальной пневмонии, в терапию которых был включен Цефодокс в качестве стартового перорального антибиотика. Цефодокс назначался внутрь из расчета 10 мг/кг массы тела ребенка в сутки в 2 приема после еды. Длительность курса лечения определялась достижением стойкой нормализации температуры тела, положительной динамикой физикальных данных и составила в среднем 8,9 ± 1,5 дня. До начала включения Цефодокса в терапию амбулаторно лечение проводилось на протяжении 5,7 ± 1,3 дня. Клиническую эффективность Цефодокса оценивали по критериям, приведенным в Европейском руководстве по клинической оценке противоинфекционных лекарственных средств. Клинически эффективным препарат считали, если полностью исчезали клинические и рентгенологические симптомы заболевания после окончания лечения. Все дети получали наряду с Цефодоксом комплексную терапию, включающую муколитическую, витаминотерапию, пероральную дезинтоксикационную терапию, физиотерапевтические процедуры. В группу сравнения вошли 16 детей, которые соответствовали основной группе по возрасту, полу, тяжести состояния, ведущим синдромам, но в лечении которых использовался парентеральный антибиотик — цефалоспорин III поколения цефтриаксон. Предварительно эффективность лечения оценивали на 3–4-й день терапии, окончательно (с обязательным контрольным рентгенологическим исследованием органов грудной клетки, определением показателей гемограммы) — на 12–14-й день лечения. Контроль динамики клинических показателей и безопасность лечения оценивали ежедневно.
Методы исследования: анамнестические данные; объективное обследование детей; рентгенография органов грудной клетки; общие параклинические методы исследования; биохимическая гепатограмма и нефрограмма; бактериологическое исследование мокроты; бактериологическое исследование кала.
Результаты исследования и их обсуждение
В клинической картине большинства наблюдаемых больных доминировали до начала лечения интоксикационный и катаральный синдромы: субфебрильная и/или фебрильная лихорадка в течение 3–5 дней, бледность и/или мраморность кожи, изменение поведения (признаки возбуждения или апатии). Симптомы астенизации (общая слабость, недомогание, снижение аппетита) наблюдали практически у всех пациентов. Смешанная одышка была нерезко выраженной и непостоянной. Кашель был практически у всех больных в начале заболевания сухой, затем влажный. Перкуторно над легкими локально отмечалось укорочение перкуторного звука, над остальными участками — либо легочный звук (15 детей), либо коробочный (2 детей). Аускультативно в зоне укорочения выслушивались мелкопузырчатые влажные хрипы у 11 больных, крепитирующие — у 4, ослабленное дыхание — у 2 детей. Физикальные изменения в среднем наблюдались на протяжении 10–12 дней. Нарушения со стороны сердечно-сосудистой системы соответствовали выраженности интоксикационного синдрома, дыхательной недостаточности и проявлялись тахикардией (100 %), приглушенностью сердечных тонов — у 8 (47,1 %) детей. В общем анализе крови большинства больных до начала лечения отмечались: лейкоцитоз у 13 детей (76,5 %) — 9,7 ± 1,3 х 109/л, нейтрофилез — у 16 (94,1 %), со сдвигом влево — у 9 (52,9 %), повышение СОЭ — у всех детей — 15,7 ± 3,4 мм/час, нормохромная анемия — у 8 больных (47,1 %). Показатели биохимической гепатограммы и нефрограммы до начала лечения регистрировались в пределах возрастной нормы.
Через 2 дня после начала лечения у 16 (94,1 %) из 17 пациентов отмечалась положительная клиническая динамика течения болезни: уменьшились проявления интоксикационного синдрома (температура тела нормализовалась либо снизилась до субфебрильных величин (в среднем составила 37,3 ± 0,3 °С), повысился аппетит, уменьшились слабость, недомогание, дети стали более активными. Это позволило продолжить начатую эмпирически терапию антибиотиком Цефодокс. На 8–9-й день терапии отмечалась положительная динамика гематологических показателей: количество лейкоцитов уменьшилось и в среднем составило 7,2 ± 0,9 х 109/л, СОЭ снизилась до 5,7 ± 1,6 мм/час. Контрольная рентгенография органов грудной клетки, проведенная на 10–12-й день терапии, показала полное исчезновение очага пневмонической инфильтрации легких у 16 детей, у одного ребенка отмечалось значительное уменьшение инфильтративной тени. Нормализация физикальных изменений в легких отмечалась в среднем к 7–12-му дню лечения (рис. 1).
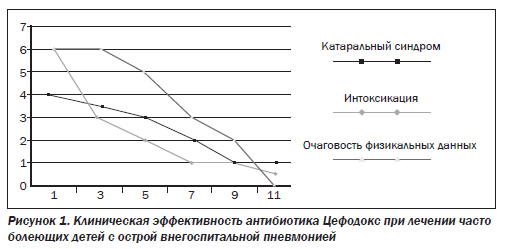
Цефодокс существенно не влиял на микробиоценоз кишечника, что подтверждено соответствующими микробиологическими исследованиями. Все дети хорошо переносили Цефодокс, побочных реакций не зарегистрировано.
Выводы
1. Применение перорального цефалоспорина III поколения цефподоксима проксетила (препарат Цефодокс, представленный в Украине компанией «Мегаком») можно считать одним из перспективных направлений антимикробной терапии в связи:
2. Цефподоксима проксетил (Цефодокс) можно рекомендовать в качестве стартового эмпирического антибиотика при лечении часто болеющих детей раннего возраста с внегоспитальной формой пневмонии.
1. Грузина В.Д. Коммуникативные сигналы бактерий // Антибиотики и химиотерапия. — 2003. — Т. 48, № 10. — С. 32-39.
2. Олескин А.В., Ботвинко И.В., Цавкелова Е.А. Колониальная организация и межклеточная коммуникация у микроорганизмов // Микробиол. — 2000. — Т. 69, № 3. — С. 309-327.
3. Aggarwal A., Rath S. Cefpodoxime — utility in respiratory tract infections and typhoid fever // Indian. J. Pediatr. — 2004. — Vol. 71, № 5. — P. 413-415.
4. Antibacterial activity of cefpodoxime against clinical isolates in 2000 and 2001 / T. Abe, T. Fukuoka, Y. Sato, K. Ito, M. Sei // Jpn. J. Antibiot. — 2002. — Vol. 55, № 6. — P. 827-843.
5. Bacterial communication («quorum sensing») via ligands and receptors: a novel pharmacologic target for the design of antibiotic drugs / R.B. Raffa, J.R. Iannuzzo, D.R. Levine, K.K. Saeid, R.C. Schwartz, N.T. Sucic, O.D. Terleckyj, J.M. Young // J. Pharmacol. Exp. Ther. — 2005. — Vol. 312, № 2. — P. 417-423.
6. Bauer W.D., Robinson J.B. Disruption of bacterial quorum sensing by other organisms // Curr. Opin. Biotechnol. — 2002. — Vol. 13. — P. 234-237.
7. Biofilm Formation by Stenotrophomonas maltophilia: Modulation by Quinolones, Trimethoprim-Sulfamethoxazole and Ceftazidime / G. Di Bonaventura, I. Spedicato, D. D''Antonio, I. Robuffo, R. Piccolomini // Antimicrob. Agents Chemother. — 2004. — Vol. 48, № 1. — P. 151-160.
8. Chicurel M. Bacterial biofilms and infections. Slimebusters // Nature. — 2000. — Vol. 408. — P. 284-286.
9. Costerton J.W., Stewart P.S., Greenberg E.P. Bacterial biofilms: a common cause of persistent infections // Science. — 1999. — Vol. 284. — P. 1318-1322.
10. Dabernat H., Seguy M., Faucon G., Delmas C. Epidemiology of Haemophilus influenzae strains collected in
11. Epidemiological study of Streptococcus pneumoniae in the nasopharynx of healthy children under 5 years of age in Wuhan / Z.Y. Sun, J. Zhang, L. Li, X.H. Zhu, H.W. Wang, Y. Ma // Zhonghua Er Ke Za Zhi. — 2007. — Vol. 45, № 5. — P. 382-386.
12. Fulton B., Perry C.M. Cefpodoxime proxetil: a review of its use in the management of bacterial infections in paediatric patients // Paediatr. Drugs. — 2001. — Vol. 3, № 2. — P. 137-158.
13. Hadley J.A., Pfaller M.A. Oral beta-lactams in the treatment of acute bacterial rhinosinusitis // Diagn. Microbiol. Infect. Dis. — 2007. — Vol. 57, № 3 (Suppl.). — P. 47S-54S.
14. Influence of penicillin/amoxicillin non-susceptibility on the activity of third-generation cephalosporins against Streptococcus pneumoniae / A. Fenoll, M.J. Giménez, O. Robledo, L. Aguilar, D. Tarragó, J.J. Granizo, J.E. Martín-Herrero // Eur. J. Clin. Microbiol. Infect. Dis. — 2007. Oct 18 [Epub ahead of print].
15. Koch C., Høiby N. Pathogenesis of cystic fibrosis // Lancet. — 1993. — 341. — Р. 1065-1069.
16. Lasa I., Del Pozo J.L., Penadés J. R., Leiva J. Bacterial biofilms and infection // An. Sist. Sanit. Navar. — 2005. — Vol. 28, № 2. — P. 163-175.
17. Mah T.C., O''Toole G.A. Mechanisms of biofilm resistance to antimicrobial agents // Trends Microbiol. — 2001. — Vol. 9. — P. 34-39.
18. Sader H.S., Jacobs M.R., Fritsche T.R. Review of the spectrum and potency of orally administered cephalosporins and amoxicillin/clavulanate // Diagn. Microbiol. Infect. Dis. — 2007. — Vol. 57, № 3 (Suppl.). — P. 5S-12S.
19. The physiology and collective recalcitrance of microbial biofilm communities / P. Gilbert, T. Maira-Litran, A.J. McBain, A.H. Rickard, F.W. Whyte // Adv. Microb. Physiol. — 2002. — Vol. 46. — P. 202-256.
