Газета «Новости медицины и фармации» 1(306) 2010
Вернуться к номеру
Систематический обзор и метаанализ клинической безопасности и переносимости ибупрофена в сравнении с парацетамолом при лечении болевого синдрома и лихорадки в педиатрической практике*
Авторы: Elizabeth R. Southey, Watermeadow Medical, Witney, Oxfordshire, UK; Karla Soares-Weiser, Enhance Reviews, Kfar-Saba, Israel; Jos Kleijnen, Kleijnen Systematic Reviews Ltd, York, UK, Care and Public Health Research Institute (CAPHRI),
University of Maastricht, The Netherlands
Версия для печати
Лихорадка и болевой синдром у детей, особенно связанные с такими инфекциями, как острый средний отит, очень распространены [1]. Повышенная температура тела, будучи лишь признаком или симптомом другого патологического состояния или заболевания, ассоциирована с дискомфортом и повышенным риском возникновения обезвоживания и развития судорог [2]. Естественной является озабоченность родителей относительно эффектов, которые развиваются вследствие лихорадки — одного из состояний в условиях педиатрической практики, наиболее часто требующего лечения. Лихорадка и болевой синдром легко поддаются лечению при использовании безрецептурных жаропонижающих/анальгетиков, таких как ибупрофен и парацетамол. Широкое применение данных препаратов показало, что они являются эффективными и в целом хорошо переносятся при использовании в целях уменьшения лихорадки и болевого синдрома в педиатрической практике, хотя оптимальные дозы, режимы дозирования и выбор лекарственных средств, как ни странно, четко не описаны в научной литературе [3, 4].
* Печатается с сокращениями. Southey E.R., SoaresWeiser K., Kleijnen J. Systematic review and metaanalysis of the clinical safety and tolerability of ibuprofen compared with paracetamol in paediatric pain and fever // Current Medical Research and Opinion. — 2009 September. — Vol. 25, № 9. — P. 22072222 (Прим. ред.).
Введение
Несмотря на широкое назначение ибупрофена и парацетамола, побочные эффекты (ПЭ) при терапевтическом использовании этих препаратов, по-видимому, являются редкостью. Ибупрофен переносится лучше, чем другие нестероидные противовоспалительные препараты (НПВП), хотя ранее его применение связывали с почечной токсичностью, аллергическими реакциями и неблагоприятным воздействием на желудочно-кишечный тракт (ЖКТ) [5–7]. Кроме того, в литературе было описано, что использование ибупрофена может привести к обострению симптомов лихорадки у детей с бронхиальной астмой в анамнезе [8, 9]. Эта связь была исследована в ходе клинических испытаний, но не была подтверждена [10, 11].
Гепатотоксичность, по-видимому, является наиболее серьезным и четко документированным ПЭ, связанным с использованием парацетамола у детей. Описания случаев свидетельствуют, что печеночная недостаточность может развиться при длительном лечении в дозе, которая несколько превышает рекомендованную максимальную дозу [12, 13]. Использованием парацетамола объясняли крапивницу и макулопапулезную сыпь [14] наряду с такими редкими кожными ПЭ, как острый генерализованный экзантематозный пустулез [15]. Информация об аллергических реакциях (в том числе кожных) приведена в сообщениях о бронхоспазме, васкулите и синдроме Стивенса — Джонсона [14]. Они часто возникали в течение первого часа после приема дозы либо в течение 4–5 ч после первичного лечения [16, 17]. Кроме того, с использованием парацетамола могло быть связано развитие аллергического ринита [18].
Несмотря на то что постоянно публикуются результаты рандомизированных контролируемых исследований (РКИ), посвященных оценке эффективности использования ибупрофена и парацетамола у детей [19, 20], и ранее проводились систематические обзоры в этой области [21, 22], по-видимому, нет ни одного систематического обзора, специально и всесторонне изучившего безопасность применения указанных средств в терапии боли и лихорадки в педиатрической практике.
Необычные ПЭ в рандомизированных исследованиях выявляли нечасто, и в данном обзоре изучены тщательно спланированные обсервационные исследования, способствующие выявлению серьезных ПЭ, к которым относятся: летальный исход, угрожающие жизни или требующие госпитализации состояния, а также другие, такие как бронхиальная астма, кардиоваскулярные ПЭ, абдоминальная боль, желудочно-кишечные кровотечения (ЖКК), почечная недостаточность любой этиологии (например, вследствие интерстициального нефрита), гепатотоксичность, кожные реакции гиперчувствительности или реакции со стороны системы крови, либо ПЭ, требующие отмены препарата, и, кроме того, системные реакции, такие как тошнота, потливость или кожная сыпь. Следовательно, основной целью данного обзора было сравнение переносимости и безопасности ибупрофена и парацетамола при использовании в качестве жаропонижающих и обезболивающих средств у детей возрасте от 0 до 18 лет.
Методы
Данный систематический обзор последовал за публикацией руководства для проведения систематических обзоров Центра составления и распространения обзоров (Centre for Reviews and Dissemination, CRD (Прим. ред.)) (CRD, 2001 [23]) и руководства по работе в Кокрановском сотрудничестве [24].
Источники данных и поиск
Стратегии поиска были разработаны специально для каждой базы данных.
Мы осуществляли поиск в следующих базах данных: MEDLINE (с 1950 по ноябрь
Отбор исследований
Критериями включения были: РКИ сравнения эффективности, переносимости и безопасности ибупрофена или парацетамола с плацебо; контролируемые обсервационные исследования по редким ПЭ; серии случаев более чем с 1 тыс. участников; возраст детей до 18 лет с болевым синдромом и/или лихорадкой.
Общие критерии включения были применены в целях сбора литературных данных и регулярного использования указанных препаратов в клинической практике; в то же время указанные критерии должны были выявить исследования, отличающиеся по качеству и дизайну.
Два рецензента независимо друг от друга изучили резюме каждой ссылки, идентифицированной поиском, и определили потенциальную релевантность каждой статьи. Для потенциально релевантных статей или в случае разногласия получали полный текст статьи, независимо изучали и применяли критерии включения. Любые разногласия урегулировались путем обсуждения и проверки третьим оппонентом. Обоснования исключения исследований из обзора документировали. Исследования исключали в том случае, если они не соответствовали критериям включения, если какие-либо релевантные данные невозможно было извлечь/оценить или если документ был не на английском, французском, испанском, голландском, немецком или португальском языках. К показателям исходов относили: серьезные ПЭ, а именно летальный исход, угрожающие жизни или требующие госпитализации состояния; серьезные ПЭ, которые не требовали госпитализации (например, бронхиальная астма, кардиоваскулярные ПЭ, абдоминальная боль, ЖКК, почечная недостаточность любой этиологии (в частности, интерстициальный нефрит), гепатотоксичность, кожные реакции гиперчувствительности или реакции со стороны системы крови); ПЭ, которые требуют отмены препарата; системные реакции, связанные с использованием ибупрофена или парацетамола (например, тошнота, потливость, кожная сыпь).
Извлечение данных и оценка качества
Формы извлечения данных были разработаны с использованием онлайн-сервиса SRS (www.srsnexus.com), управляемого независимо в соответствии с небольшой и, при необходимости, корректируемой выборкой различных по качеству исследований. Для каждого исследования данные были извлечены независимо двумя рецензентами. Любые разногласия решались путем консенсуса. Извлечение данных обсуждалось, и решения были задокументированы.
Качественные формы оценки были разработаны на основе регламента Оксмана для систематических обзоров [30], а также регламентов для рандомизированных клинических испытаний и других релевантных регламентов для исследований различных дизайнов исследований согласно протоколу 4 CRD (CRD 2001) (www.york.ac.uk/inst/crd/CRD_Reports/crdreport4_app3.pdf). Оценка качества была осуществлена независимо двумя рецензентами. Любые разногласия регулировались консенсусом.
Планировалось, если было доступно достаточное количество данных (10 исследований), включать каждый из качественных компонентов исследований как независимую переменную в метарегрессионный анализ для обоснования возможной неоднородности (3 Под неоднородностью в применении к систематическим обзорам понимают вариабельность или различия между исследованиями в оценке эффектов. Иногда различают статистическую неоднородность (различия в описанных эффектах), методологическую неоднородность (различия в типах исследований) и клиническую неоднородность (различия между исследованиями по основным характеристикам участников, вмешательствам или оценкам исходов). Статистические критерии неоднородности используются в целях определения того, насколько наблюдаемые различия в результатах различных исследований (размеры эффектов) больше, чем те, которые могли бы возникнуть случайно (Прим. ред.)). К сожалению, данных для осуществления этого было недостаточно.
Статистический анализ
Статистический анализ проводили с использованием программного обеспечения RevMan (версия 5.0.10). Дихотомические данные были проанализированы путем расчета относительного риска (ОР) для каждого использованного исследования методом Мэнтела — Хансцеля в соответствии с 95% доверительными интервалами (ДИ) [24]. Непрерывные данные были проанализированы путем расчета взвешенной разности средних (ВРС (Метод метаанализа применяется для объединения измерений непрерывных величин в случаях, если для каждой группы известны средние, стандартное отклонение и размер выборки. Вес, который дается каждому исследованию (то есть влияние каждого исследования на общие результаты метаанализа), определяется точностью оценок эффектов в каждом исследовании. В статистическом программном обеспечении RevMan используется метод взвешивания при помощи величины, обратной дисперсии. Он предполагает, что во всех испытаниях исход измеряли при помощи одной и той же шкалы (Прим. ред.))) между группами и в соответствии с 95% ДИ [24]. Для непрерывных данных стандартные отклонения и средние значения должны были быть представлены в публикации, посвященной исследованию, или получены от авторов. Если мы не могли получить указанные средние (Среднее — сумма результатов всех наблюдений, деленная на число наблюдений (Прим. ред.)), то рассчитывали их из данных, которые были предоставлены, или брали репрезентативное значение из других исследований. Мы только сводили данные, если нам казалось, что в исследованиях определялся один и тот же эффект, и если исследования имели одинаковый дизайн, и мы использовали нарративный (Повествовательный, описательный (Прим. ред.)) синтез, где это было не так. Таким образом, была использована модель с фиксированным эффектом (Статистическая модель, в которой единицы наблюдения являются предметом изучения и, таким образом, составляют полную популяцию. При использовании модели с фиксированным эффектом принимается, что на неопределенность результатов метаанализа (которую отражает доверительный интервал) влияет дисперсия только внутри исследования. Дисперсия между оценками эффекта в разных исследованиях (неоднородность) не влияет на доверительный интервал в этой модели (Прим. ред.)) для подсчета отношения шансов (ОШ) или ВРС. Неоднородность первоначально оценивали путем измерения степени несогласованности в результатах исследований (I2) [31].
Чтобы позволить читателю рассмотреть результаты с учетом различий в дизайнах исследований и потенциальных источников систематических ошибок для каждого из рассмотренных исследований, а также случаев, когда метаанализ был признан непригодным для некоторых или всех выявленных данных (например, в связи с неоднородностью исследований или отсутствием в отчете заслуживающих доверия данных), мы использовали метод нарративного синтеза.
Он включал изучение организации исследований в отношении (в соответствующих случаях) вмешательств, популяции, оценки исходов, обобщения результатов исследований, обобщения диапазонов и объемов отчетов, связанных с этими исследованиями, и описание наиболее важных характеристик включенных исследований.
Результаты
После двухуровневого скрининга 5517 выявленных ссылок был сделан запрос относительно 462 статей, а полный текст проверен еще раз независимо двумя рецензентами для включения и исключения. Из них нашим критериям включения соответствовали 36 исследований, а 426 ссылок мы исключили. Блок-схема исследования, в том числе основания для исключения, представлены на рис. 1. Информация о 24 РКИ сравнения ибупрофена с парацетамолом и обоих с плацебо, а также сообщения о ПЭ приведена в табл. 1 [15, 10, 19, 32–64]. Нашим критериям включения в отношении ПЭ соответствовало 12 исследований, не являющихся РКИ (табл. 1).
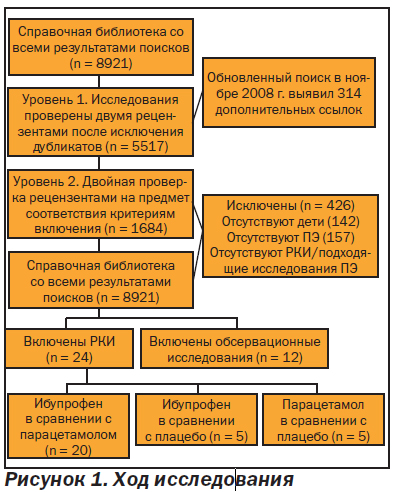 Из 24 выявленных РКИ генерация очередности при отнесении участников испытания к той или иной группе была нечеткой в 7 исследованиях. Кроме того, сокрытие порядка отнесения участников испытания к той или иной группе было нечетким в 12 исследованиях. Информация о том, кто был «ослеплен», была включена в 15 исследований. ITT-анализ (ITTанализ (IntentToTreat analysis) — анализ данных всех пациентов, которым назначено лечение, независимо от того, была ли впоследствии соблюдена схема лечения или нет (Прим. ред.)) был проведен в 17 исследованиях. В 8 из 23 исследований сообщалось, что они финансировались фармацевтической промышленностью.
Из 24 выявленных РКИ генерация очередности при отнесении участников испытания к той или иной группе была нечеткой в 7 исследованиях. Кроме того, сокрытие порядка отнесения участников испытания к той или иной группе было нечетким в 12 исследованиях. Информация о том, кто был «ослеплен», была включена в 15 исследований. ITT-анализ (ITTанализ (IntentToTreat analysis) — анализ данных всех пациентов, которым назначено лечение, независимо от того, была ли впоследствии соблюдена схема лечения или нет (Прим. ред.)) был проведен в 17 исследованиях. В 8 из 23 исследований сообщалось, что они финансировались фармацевтической промышленностью.
Серьезные ПЭ, такие как летальный исход, угрожающие жизни или требующие госпитализации состояния
Острые ЖКК, почечная недостаточность и анафилаксия
Риск госпитализации в связи с острым ЖКК, почечной недостаточностью или анафилаксией был количественно измерен в рандомизированных контролируемых исследованиях с участием 84 192 детей, получавших либо ибупрофен (5 или 10 мг/кг), либо парацетамол (12 мг/кг) [40]. В целом никаких различий в отношении серьезных ПЭ, таких как угрожающие жизни или требующие госпитализации состояния (ОР 1,31; 95% ДИ 0,87; 1,97), не было.
Показатели госпитализации по любым причинам в обеих группах лечения были сопоставимы, и каких-либо доказательств повышения риска развития острого ЖКК, острой почечной недостаточности, анафилаксии либо синдрома Рейе при лечении ибупрофеном по сравнению с парацетамолом не существовало. У 4 детей было диагностировано острое немассивное кровотечение (по два в группах ибупрофена); однако этот риск 7,2/100 000 (95% ДИ 2; 18/100 000) не был повышен по сравнению с группами, леченными парацетамолом (p = 0,31). В связи с небольшим количеством новых случаев развития ЖКК никаких различий в потенциальном риске между дозами ибупрофена не может быть выявлено. Ни в одной из исследуемых групп случаев почечной недостаточности, анафилаксии либо синдрома Рейе не наблюдалось.
Никаких других исследований, в которых бы сообщали о каком-либо риске развития почечных ПЭ при использовании ибупрофена или парацетамола, выявлено не было.
Синдром Рейе
В подтверждение упомянутых выше данных РКИ в 2 исследованиях «случай — контроль» [54, 55], в которых изучали использование ацетилсалициловой кислоты (АСК) или парацетамола на догоспитальном этапе и число новых случаев развития синдрома Рейе, какой-либо эпидемиологической связи между использованием парацетамола и последующим развитием указанного синдрома не наблюдали. Ассоциация между использованием АСК и синдромом Рейе уже признана, что привело к тому, что ее использование у детей противопоказано. Не выявлено никаких исследований «случай — контроль», в которых изучали бы использование ибупрофена и развитие синдрома Рейе.
Обнадеживает крупное исследование [32], в котором не зафиксировано каких-либо случаев развития синдрома Рейе, почечной недостаточности, анафилаксии или некротизирующего фасциита у 41 810 детей, леченных с использованием ибупрофена или парацетамола. Кроме того, в этом исследовании не наблюдали случаев ЖКК.
Инфекции, вызываемые стрептококками группы А
В этом обзоре выявлены 4 исследования «случай — контроль» по изучению риска развития инфекций, вызываемых стрептококками группы А (СГА) (в частности, некротизирующий фасциит/некротизирующая инфекция мягких тканей (НИМТ)) и ассоциированных с использованием НПВП во время первичной ветряной оспы у детей [53, 56, 58, 59]. Отчеты исследований содержат противоречивые результаты. Lesko et al. [56] не нашли доказательств в исследовании с 52 случаями инфекции СГА и 172 случаями контроля с неосложненной ветряной оспой: никакой ассоциации между использованием ибупрофена и некротизирующей инфекцией мягких тканей (ОР 1,3; 95% ДИ 0,33; 5,3) не было обнаружено, хотя в целом существовала ассоциация между использованием ибупрофена и инвазивными инфекциями СГА (ОР 3,9; 95% ДИ 1,3; 12). Тем не менее авторы заявляют, что никаких доказательств зависимости реакции от дозы не существует, и это основано на невозможности полного контроля факторов искажения, таких как показания/тяжесть состояния при ветряной оспе, включая степень выраженности и продолжительность лихорадки. Кроме того, эта ассоциация встречается только среди детей, которые принимали как ибупрофен, так и парацетамол в течение 7 дней до наблюдения. Использование парацетамола ассоциировалось с повышенным по сравнению с ибупрофеном риском развития некротизирующей инфекции мягких тканей (ОР 3,8; 95% ДИ 0,92; 16 и ОР 1,3; 95% ДИ 0,33; 5,3 соответственно), но без пересечения с пороговым значением для статистической значимости. Zerr et al. 1999 [59], наоборот, наблюдали ассоциацию между НФ и использованием ибупрофена в терапии первичной инфекции ветряной оспы (ОР 10,2; 95% ДИ 1,3; 79,5). Применение методов многомерного анализа для парацетамола (после корректировки по выделению СГА, возрасту и полу) продемонстрировало наличие ОР 0,6 (95% ДИ 0,1; 3,9). Это исследование было ретроспективным с малым объемом выборки (было сопоставлено лишь 19 случаев с 29 случаями контроля), поэтому исходя из его результатов никакие строгие выводы сделать невозможно. Кроме того, причинность не может быть доказана.
В другом исследовании на основании сведений базы данных фармакологического надзора Франции выявлено 38 случаев некротизирующей инфекции мягких тканей: 12 — у младенцев (в возрасте 0–23 месяца), 16 — у детей в возрасте 2–15 лет и 10 — у взрослых (> 15 лет) при сопоставлении с 228 случаями контроля [58]. Из 24 младенцев и детей с диагнозом ветряной оспы 22 принимали НПВП: из них 18 — ибупрофен, 2 — нифлумовую кислоту и 2 — как ибупрофен, так и нифлумовую кислоту одновременно. О количестве детей, которые принимали парацетамол, как это указано выше для ибупрофена или нифлумовой кислоты, не сообщалось. В исследовании фактически не указаны данные ОР для использования одного лишь ибупрофена и риска возникновения некротизирующей инфекции мягких тканей, но вместо этого указан ОР при использовании НПВП — 64,76 (95% ДИ 16,00; 284,20) и парацетамола — 5,69 (95% ДИ 2,34; 13,80). Этот повышенный риск НИМТ при использовании парацетамола противоречит выводам другого исследования «случай — контроль» [56, 59].
Авторы исследования, сходного с исследованием Zerr et al. 1999 [59], признают ограничения, связанные с факторами искажения, такими как вирусная инфекция сама по себе, отмечая, что использование НПВП «наблюдается после появления симптомов вторичной инфекции». Авторы также выносят на обсуждение множество случаев, выявленных в связи с этим: эти 38 включенных случаев составляют лишь 1,9 % от всех серьезных кожных реакций, указанных в базе данных.
Последнее по времени исследование «случай — контроль», в котором изучали риск развития тяжелых бактериальных осложнений кожи, выявленное в этом обзоре, также связано с парацетамолом (ОР 4,3; 95% ДИ 0,9; 28; р = 0,04), но эта ассоциация исчезает при корректировке с учетом таких факторов, как другие лекарственные препараты, продолжительность и интенсивность лихорадки [53] (мы связались с автором для уточнения указанного выше результата, так как начиная с 95% ДИ 0,9 не может быть ассоциации со статистически значимым p, однако никакого ответа не получили). Применение НПВП (длительность терапии и дозы не определены) по-прежнему связано с повышенным риском развития тяжелых бактериальных инфекций кожи (к которым относятся целлюлиты, заболевания, опосредованные эпидермолитическим токсином стафилококка, абсцессы, эктима, гангренозная форма ветряной оспы и скарлатинозная лихорадка) (ОШ 4,8; 95% ДИ 1,6; 14,4). По аналогии с другими исследованиями авторы признают, что факторы потенциального искажения относительно показаний по использованию НПВП могли оказать влияние на их результаты.
Передозировка
В серии случаев с участием 2282 лиц [62] отмечен значительный рост использования парацетамола при попытках суицида среди подростков (10–19 лет): в 1976–1977 гг. парацетамол был использован в 23,4 % случаев передозировок, в 1981–1983 гг. он был применен в 31,1 %, а в 1988–1989 гг. его использовали в 48,3 % случаев (p < 0,001 как у юношей, так и у девушек). Применение несовершеннолетними транквилизаторов и седативных препаратов также было зарегистрировано: их использовали в 20 % случаев передозировок при попытке самоубийства в 1976–1977 гг., в 15,7 % — в 1982–1983 гг. и только в 5,2 % в 1988–1989 гг.
Ни в одном исследовании данного обзора не сообщается о попытках использования детьми ибупрофена в суицидальных целях.
Повреждение печени
В исследованиях «случай — контроль» рассматривали истории 25 детей с лихорадочными состояниями и фульминантной печеночной недостаточностью и сравнивали с историями их 33 сверстников из госпитальной группы контроля [57]. Все 25 случаев (100 %) были связаны с употреблением супратерапевтических доз парацетамола (> 60 мг/кг в сутки) по сравнению только с 11 (33 %) случаями в группе контроля (ОР в публикации не представлен). В то же время проспективные обсервационные исследования показали, что в педиатрической практике у пациентов с острым воздействием парацетамола в дозах до 200 мг/кг и наблюдаемых на дому признаки и симптомы повреждения печени не развиваются [59].
Серьезные ПЭ, не требующие госпитализации
Гематология
В одном исследовании [40] представили данные по 8 из 55 785 пациентов, получавших ибупрофен, у которых наблюдалось пониженное количество лейкоцитов в крови (ОР 8,57; 95% ДИ 0,49; 148,55). Ни у одного из 28 130 пациентов, получавших парацетамол, данное явление не отмечалось. Все эти случаи были транзиторными и легкой степени тяжести с минимальным количеством лейкоцитов 1,5 × 109, и различия между отдельными схемами лечения не были значимыми. Ни о каких других гематологических параметрах не сообщают.
Бронхиальная астма
В ретроспективном анализе [10] ранее опубликованных РКИ [40] исследовали использование ибупрофена (5 или 10 мг/кг) или парацетамола (12 мг/кг) и любую ассоциацию с бронхоспазмом и другой заболеваемостью, связанной с бронхиальной астмой, у 1879 детей, которые соответствовали определению авторов о леченой бронхиальной астме. Дети не соответствовали требованиям исследования, если они обладали известной гиперчувствительностью к парацетамолу, ибупрофену, ацетилсалициловой кислоте или любому НПВП либо имели полипы носовой полости, отек Квинке и бронхоспастические реакции на ацетилсалициловую кислоту или другие НПВП.
В этой публикации не было никаких свидетельств в пользу того, что использование ибупрофена в сравнении с парацетамолом повышает риск развития бронхиальной астмы у детей. Действительно, детей, леченных ибупрофеном, реже госпитализируют, и они реже посещают врачей в амбулаторных условиях в связи с бронхиальной астмой по сравнению с детьми, леченными парацетамолом: ОР 0,63 (95% ДИ 0,25; 1,6) и 0,56 (95% ДИ 0,34; 0,95) соответственно. ОР для амбулаторных больных было существенно ниже для ибупрофена в сравнении с парацетамолом. Кроме того, доза назначенного ибупрофена не оказывала влияния на этот показатель. Авторы признают, что, поскольку плацебо не применялось в исследовании, утверждать об увеличении от применения парацетамола или уменьшении от использования ибупрофена краткосрочной заболеваемости бронхиальной астмой невозможно.
Также установлено, что использование парацетамола (по крайне мере один раз в год либо один раз в месяц) является фактором риска развития сухих свистящих хрипов (9 Клинический эквивалент бронхоспазма (Прим. ред.)) у детей в возрасте 2–6 лет [64]: по крайней мере один раз в год с результирующим ОР (1,53; 95% ДИ 1,04; 2,00; p < 0,007) для парацетамола, после коррекции с учетом различных демографических и семейных факторов, уровня образования родителей и наличия у них бронхиальной астмы в анамнезе. Для использования парацетамола по крайней мере один раз в месяц обнаружено аналогичное повышение риска, составившего после коррекции с учетом указанных выше факторов 2,41 (95% ДИ 1,50; 3,87), p < 0,001.
Крупное глобальное поперечное исследование также подтверждает указанные результаты с заключением о том, что использование парацетамола при лихорадке на первом году жизни ассоциируется с повышенным риском развития симптомов бронхиальной астмы в возрасте 6–7 лет (ОР 1,46; 95% ДИ 1,36; 1,56) [60]. В этой публикации сообщается о результатах исследования International Study of Asthma and Allergies in Childhood (10 Международное исследование по изучению бронхиальной астмы и аллергических реакций в детском возрасте (Прим. ред.)) (ISAAC) с участием 205 487 детей в возрасте 6–7 лет, выявившего, что применение на момент исследования парацетамола было связано с дозозависимым повышением риска развития симптомов бронхиальной астмы (ОР 1,61; 95% ДИ 1,46; 1,77) для средней интенсивности использования (применение парацетамола 1 раз в год) в сравнении с неиспользованием; ОР 3,23 (95% ДИ 2,91; 3,60) — для высокой интенсивности использования (применение парацетамола 1 раз в месяц) в сравнении с неиспользованием. Об аналогичном повышении риска при использовании парацетамола также сообщают относительно других аллергических симптомов, а именно риноконъюнктивита и экземы. Применение ибупрофена не оценивали. Хотя это было широкомасштабное и международное исследование, авторы указывают на ограничения, такие как ретроспективное воспроизведение в памяти фактов, связанных с использованием парацетамола. Факторы искажения, такие как место жительства, показания к применению антибиотиков и уровень образования матери, контролировали по мере возможности, но существует вероятность того, что результаты могут быть подвергнуты некоторым остаточным искажениям.
Желудочно-кишечные симптомы
Ludvigsson et al. (2006) [61] в когортном исследовании изучили факторы риска, включая использование парацетамола и салицилата, относительно развития желудочно-кишечных (ЖК) симптомов у 8 341 шведского ребенка. Всем мамам детей, родившихся с октября
ПЭ, требующие отмены препарата
ОР развития ПЭ, которые требуют отмены препарата, относительно ибупрофена в сравнении с парацетамолом был оценен в двух РКИ [51, 52] и составил 0,54 (95% ДИ 0,17; 1,71; 483 пациента) (рис. 2).
ОР развития ПЭ, которые требуют отмены препарата, относительно ибупрофена в сравнении с плацебо был оценен в одном РКИ с участием 142 детей с кистозным фиброзом, получавшим высокие дозы ибупрофена (20–30 мг/кг 2 раза в сутки) [41]. Лечение на протяжении 2 лет ибупрофеном или плацебо в результате привело к отказу от участия в исследовании 4 больных, леченных ибупрофеном (конъюнктивит; спазмы в животе, тошнота, диарея; тошнота, рвота, шум в ушах, ЖКК) и к отказу от участия в исследовании 7 пациентов из группы плацебо (абдоминальная боль, гастрит; боль в эпигастрии, диарея, тошнота; абдоминальная боль, рефлюкс-эзофагит; абдоминальная боль с госпитализацией по поводу гепатита; реактивный артрит; повышение уровня печеночных ферментов; абдоминальная боль). ОР составил 0,59 (95% ДИ 0,18; 1,92).
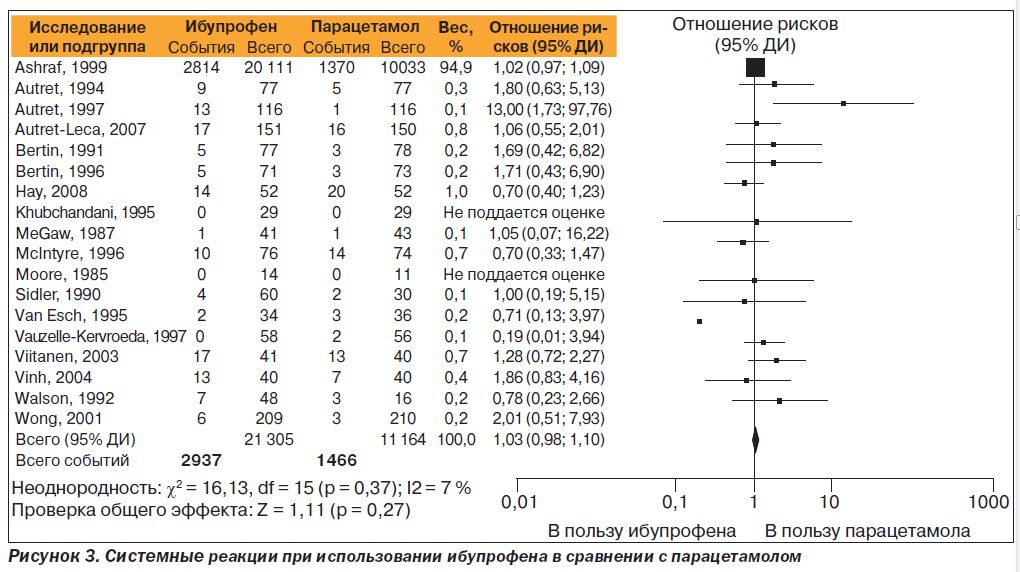
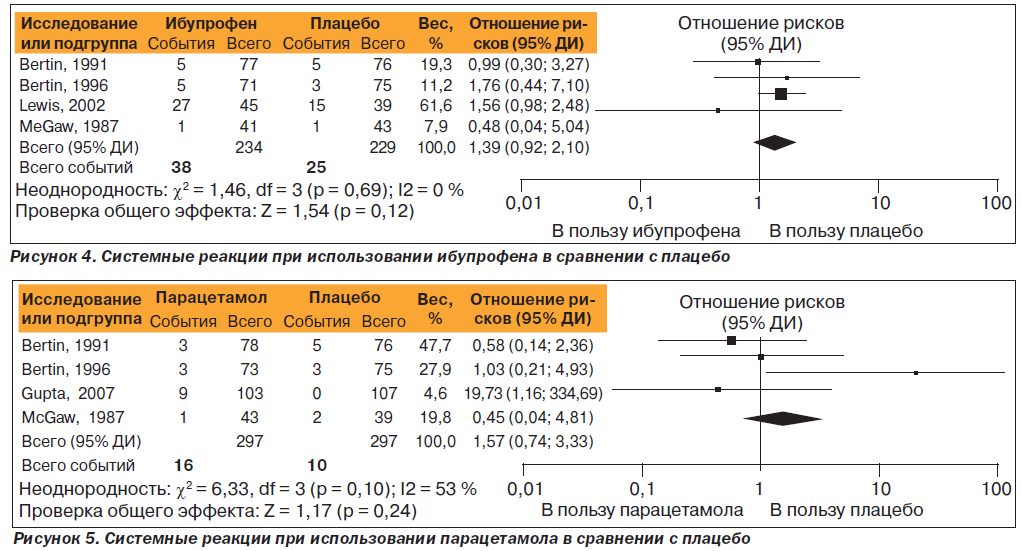
Системные реакции, связанные с использованием ибупрофена или парацетамола
В общей сложности в 18 исследованиях оценены системные реакции, связанные с использованием ибупрофена или парацетамола у 32 469 пациентов. Метаанализ этих исследований показал, что ОР развития ПЭ (системных реакций) при использовании ибупрофена в сравнении с парацетамолом составляет 1,03 (95% ДИ 0,98; 1,10) (рис. 3). ОР развития ПЭ (системных реакций) при использовании ибупрофена в сравнении с плацебо — 1,39 (95% ДИ 0,92; 2,10) (рис. 4). ОР развития ПЭ (системных реакций) при использовании парацетамола в сравнении с плацебо — 1,57 (95% ДИ 0,74; 3,33) (рис. 5). Метаанализ результатов сравнения ибупрофена с парацетамолом в основном базируется на исследовании Ashraf (1999). В этом крупном исследовании с участием 20 111 детей, принимавших ибупрофен, и 10 033 детей, принимавших парацетамол, сообщают о количестве случаев ПЭ у детей младшего возраста (< 2 лет) и старших детей (≥ 2 лет, но < 12 лет) [33]. Значимо больше ПЭ было зарегистрировано у пациентов, принимавших ибупрофен, в сравнении с группой парацетамола в обеих возрастных группах (17,6 в сравнении с 15,0 %, p < 0,001 для младших детей и 11,9 в сравнении с 10,7 %, p = 0,0 для старших детей). Лихорадка, рвота, диарея, ринит, сыпь и средний отит были ПЭ с частотой возникновения, превышающей 1 % в обеих группах лечения для младших детей. Ринит, фарингит и отит были единственными ПЭ с частотой возникновения > 1 % у старших детей.
Дозировка
Исследования доз ибупрофена или парацетамола представлены в рис. 2.
В большинстве исследований изучали ибупрофен в дозе 5–10 мг/кг в соответствии с рекомендациями, как по безрецептурному препарату; аналогично в большинстве исследований использовались рекомендованные дозы парацетамола 10–15 мг/кг.
Обсуждение
Мы исследовали переносимость и профиль безопасности как ибупрофена, так и парацетамола в случаях их использования в качестве жаропонижающего/анальгетического средства у детей в возрасте до 18 лет. В целом результаты этого систематического обзора показали, что ибупрофен, парацетамол и плацебо, как представляется, обладают сходными переносимостью и профилем безопасности (в отношении ЖК-симптомов, бронхиальной астмы и ПЭ, связанных с почками) с редким проявлением серьезных ПЭ. Противоречивые данные были получены относительно повреждения печени парацетамолом и инфекций СГА при лечении ибупрофеном или парацетамолом.
Этот обзор выявил значительное количество РКИ сравнения профилей переносимости и безопасности ибупрофена и/или парацетамола с плацебо, а также ряд обсервационных исследований, хотя их результаты не могут быть включены ни в какой из метаанализов. Действительно, всеобъемлющий характер этого обзора можно рассматривать в качестве сильной его стороны. Однако существуют некоторые ограничения: в то время как метаанализ был проведен там, где это возможно, разнообразный характер выявленных исследований и различная отчетность о результатах ПЭ означают, что он включает не все РКИ. Следовательно, может потребоваться определенная осторожность для того, чтобы делать выводы о конечных точках на основе результатов нескольких небольших исследований. Другая несогласованность переменных в исследованиях заключалась в размерах выборки, длительности последующего наблюдения, дозе и сроках. Следовательно, степень неоднородности определялась самими исследованиями. Разумеется, это отличие не отражает использования препаратов по данным литературы и в повседневной клинической практике.
Кроме того, не во всех РКИ использовали ITT-анализ, следовательно, отчетность по ПЭ не могла быть всесторонне зарегистрирована в результатах per-protocol (Perprotocol — в соответствии с требованиями протокола исследования (то есть пациенты прошли запланированный курс лечения, у них проведены необходимые измерения, отсутствовали существенные нарушения протокола) (Прим. ред.)) в связи с необходимостью исключения некоторых пациентов. Только в трех РКИ изучали безопасность в качестве основного исхода, и возможно, что сбор данных о ПЭ в остальных публикациях был неадекватным.
Включение данных обсервационных исследований в метод нарративного синтеза могло бы позволить выявить нечастые ПЭ, но, разумеется, этот дизайн исследований не столь надежен, как РКИ. Описание серии случаев и ретроспективный сбор данных подвержены систематическим ошибкам, связанным с отбором, искажением и неправильной оценкой данных, поэтому результаты этих публикаций должны быть истолкованы соответствующим образом.
Нарративный синтез результатов исследований, не являющихся РКИ, относительно ПЭ включает конфликтующие исследования по повреждениям печени (для парацетамола) и по НФ при первичной ветряной оспе (для ибупрофена и парацетамола). Трудно сделать определенные выводы из исследований, выявленных здесь. Два исследования относительно повреждения печени вследствие применения парацетамола достаточно различаются по своему характеру. Одно из них — крупное, но обсервационное исследование [63] с результатами, конфликтующими с опубликованными сообщениями о случае [12, 13]. И другое — небольшое исследование «случай — контроль» (25 случаев и 33 соответствующих контрольных), в котором ни о каких относительных рисках не сообщают [57]. Кроме того, интерпретация результатов четырех исследований, в которых изучали НФ при первичной ветряной оспе, также неэффективна [53, 56, 58, 59]: небольшой размер выборки, широкий диапазон ДИ и искажающие факторы не позволяют сделать твердые выводы. Несомненно, другие исследования «случай — контроль» показали, что широкое использование НПВП ассоциировалось с развитием тяжелых некротизирующих инфекций мягких тканей [65], однако, подобно исследованию Zerr [59], Souryi et al. [58] констатируют, что результаты могут быть искажены «систематической ошибкой показаний» в связи с тем, что НПВП назначают в качестве ответа на инфекцию у больных с тяжелым заболеванием, а не для того чтобы усугублять состояние».
В обзорной статье Leroy et al. [22] сообщают о ПЭ ибупрофена в сравнении с парацетамолом в терапии боли и лихорадки в педиатрической практике, а также об относительно повышенном риске развития инвазивных инфекций СГА после ветряной оспы и острой почечной недостаточности при гиповолемии после лечения ибупрофеном. Однако ни одно из исследований, приведенных в указанном систематическом обзоре, не выявило никаких свидетельств в поддержку развития острой почечной недостаточности при гиповолемии вследствие лечения ибупрофеном. Кроме того, Leroy et al. [22] описали возможность гастродуоденальных и геморрагических ПЭ, связанных с ибупрофеном, хотя причинность не может быть подтверждена. Подобным образом недавний обзор базы данных фармакологического надзора Франции на основе спонтанных сообщений об осложнениях, связанных с верхними отделами ЖКТ у детей в возрасте < 15 лет, получавших лечение лихорадки и болевого синдрома НПВП, выявил 61 случай ПЭ, в том числе 23 случая, связанные с ибупрофеном [66]. Применение парацетамола, по-видимому, не было изучено. Авторы указывают, что такие осложнения встречаются у детей нечасто, что подтверждается небольшой серией случаев в отчетности у детей в возрасте до 9 лет.
В свою очередь, наш обзор не обнаружил повышенного риска развития острых ЖКК, связанных с ибупрофеном, на основе следующих выявленных исследований: Lesko et al. [40] сообщили о 4 детях, у которых было диагностировано острое немассивное ЖКК (по два в каждой из групп, принимавших ибупрофен). Однако этот риск 7,2/100 000 (95% ДИ 2; 18/100 000) был не выше, чем при лечении парацетамолом (р = 0,31). Данный вывод подтверждается аналогичными результатами у подростков и взрослых [67]: в рандомизированном плацебо-контролируемом исследовании с участием 1246 здоровых лиц в возрасте 12–83 года, использующих безрецептурные анальгетики, количество случаев ПЭ со стороны ЖКТ было сравнимо в группах плацебо и ибупрофена (16 в сравнении с 19 %), а случаи ЖКК были также сопоставимы между обеими группами с общей частотой 1,4 % из числа пациентов, которые продемонстрировали по крайней мере один положительный результат при тестировании кала на наличие скрытой крови.
Вследствие ассоциации с «аспириновой астмой» у чувствительных взрослых принято считать, что должен быть высокий уровень распространенности перекрестной чувствительности к НПВП, влияющий на циклооксигеназный путь, что может также приводить к обострению бронхиальной астмы [68, 70]. Как парацетамол, так и НПВП, такие как ибупрофен, могут также приводить к обострению бронхиальной астмы у детей, однако эта ассоциация не кажется столь же четко прослеживаемой, как у взрослых [8, 9, 70]. Как недавний обзор литературы [70], наш систематический обзор не выявил при использовании ибупрофена повышенного риска, ассоциированного с заболеваемостью, связанной с бронхиальной астмой.
В действительности может быть даже протекторный эффект в сравнении с парацетамолом [40]. Кроме того, использование парацетамола у детей показало, что это является фактором риска развития свистящих хрипов и симптомов бронхиальной астмы [60, 64].
Другим важным наблюдением систематического обзора было установление того факта, что переносимость и безопасность ибупрофена не отличаются от таковых парацетамола в отношении развития системных реакций; метаанализ продемонстрировал, что переносимость и безопасность ибупрофена ничем не отличаются от плацебо в плане системных реакций, что также свойственно и парацетамолу: ОР при ибупрофене в сравнении с плацебо — 1,39 (95% ДИ 0,92; 2,10); ОР для парацетамола в сравнении с плацебо — 1,57 (95% ДИ 0,74; 3,33). Дополнительный метаанализ продемонстрировал, что в общей сложности 2937 системных ПЭ развились у 21 305 пациентов, принимавших ибупрофен, по сравнению с 1466 системными ПЭ у 11 164 пациентов, принимавших парацетамол: ОР 1,03 (95% ДИ 0,98; 1,10). Никаких значимых различий в системных реакциях между этими двумя группами, включая лихорадку, рвоту, диарею, ринит, кожную сыпь, отит и фарингит, не было. Хотя исследования выявили отсутствие обязательного выполнения условий безрецептурного отпуска препаратов, эти результаты по-прежнему актуальны для безопасного широкомасштабного их применения у детей.
Как ибупрофен, так и парацетамол признаны в качестве средств эффективного купирования лихорадки и болевого синдрома у детей: в опубликованном недавно систематическом обзоре и метаанализе пришли к выводу, что они эквивалентны по своим анальгетическим и жаропонижающим свойствам [21, 22, 71–73]. Однако ибупрофен и парацетамол — разные препараты, и пока неясно, осведомлены ли родители/опекуны относительно различий между ними, особенно в плане рекомендованных доз и интервалов дозирования: два недавно опубликованных перекрестных исследования, направленных на выявление факторов, влияющих на назначение жаропонижающих препаратов взрослыми для уменьшения лихорадки у детей в различных культурно-этнических условиях показали, что 35 % родителей дают препараты в дозах, превышающих рекомендованные [74], 21 % повторяют дозу с интервалом ≤ 3 ч [74] и 66 % используют безрецептурные лекарственные препараты без необходимости, чтобы «сбить» незначительное повышение температуры (< 38,5 °С) [75]. Все это приводит к последствиям, связанным с безопасностью использования обоих препаратов.
Руководства, опубликованные признанными организациями (NICE — National Institute for Clinical Excellence, Национальный институт здоровья и качества медицинской помощи Великобритании; ANZCA — Australian and New Zealand College of Anesthetists, Австралийская и Новозеландская коллегия анестезиологов), не сообщают о какой-либо обеспокоенности относительно переносимости или безопасности как ибупрофена, так и парацетамола в лечении болевого синдрома или лихорадки в педиатрической практике (руководство NICE, 2007 [76]; руководство ANZCA, 2007 [77]). Примечательно, что в руководстве NICE подчеркивается отсутствие доказательств, подтверждающих необходимость назначения жаропонижающего препарата при ведении лихорадки в детском возрасте, но рекомендуется назначать ибупрофен или парацетамол тем, кто представляется страдающим или нездоровым из-за повышенной температуры [76]. В руководстве ANZCА, однако, утверждают, что «безопасное дозирование парацетамола требует учета возраста и массы тела ребенка, а также продолжительности терапии». Похоже, что дозы ибупрофена (5–10 мг/кг) и парацетамола (10–15 мг/кг), используемые в исследованиях, указанных в настоящем обзоре, соответствуют рекомендованным дозам для безрецептурных препаратов.
Заключение
Рекомендации авторов заключаются в том, что предстоящие РКИ должны быть тщательно спланированы с целью изучения в качестве первичного критерия безопасности и переносимости ибупрофена и парацетамола при ведении болевого синдрома и лихорадки в педиатрической практике. Также необходимы дальнейшие долгосрочные исследования по мониторированию ПЭ для таких схем лечения.
Этот систематический обзор показал, что ибупрофен, парацетамол и плацебо обладают сходными профилями переносимости безопасности, особенно в отношении ЖК-симптомов, бронхиальной астмы и ПЭ со стороны почек.
Информационная открытость
Декларация финансирования. Этот обзор был профинансирован компанией Reckitt Benckiser Plc. Компания Reckitt Benckiser не принимала никакого участия в создании, написании или рецензировании данной статьи. Авторы несут полную ответственность за содержание и мнения, высказанные в этой статье, и они обладали полным редакторским контролем в подготовке статьи.
Декларация финансирования/другие отношения. Karla Soares-Weiser является сотрудником компании Enhance Reviews и научным сотрудником Kleijnen Systematic Reviews. Jos Kleijnen является сотрудником компании Kleijnen Systematic Reviews. Elizabeth R. Southey, являясь сотрудником компаний Kleijnen Systematic Reviews и Watermeadow Medical, получала средства от Reckitt Benckiser для подготовки настоящей статьи.
Благодарности. Авторы благодарны Willem Verberk (Kleijnen Systematic Reviews) и Elad Goldberg (Enhance Reviews) за помощь в сборе данных и анализ, а также Sheila Dunleavy (Watermeadow Medical) за помощь в подготовке рукописи. Компания Reckitt Benckiser спонсировала помощь по услуге медицинского райтинга, предоставленную компанией Watermeadow.